反复水肿、蛋白尿,伴腹胀、腹痛、便血
2013-04-26全军肾脏病研究所学术委员会
病史摘要
现病史23岁男性,因“反复水肿、蛋白尿9月,腹痛、黑便11d”于2012-07-30入院。
患者于2011年10月无明显诱因出现颜面部水肿,伴左下腹疼痛、腹泻(水样便,10次/d),我院查血清白蛋白(Alb) 19.8 g/L,血清肌酐(SCr) 99.89 μmol/L,D二聚体 1.30 mg/L,尿蛋白定量 11.19 g/24h,CT血管成像(CTV)提示两下肺动脉及分支多发血栓、左肾静脉及下腔静脉内血栓(图1),诊断“肾病综合征,深静脉血栓形成伴肺动脉栓塞”,予低分子肝素抗凝,泼尼松60 mg/d口服治疗原发病,1月后达完全缓解(CR),复查肾静脉CTV示下腔静脉及左肾静脉血栓消失,泼尼松规律减量。
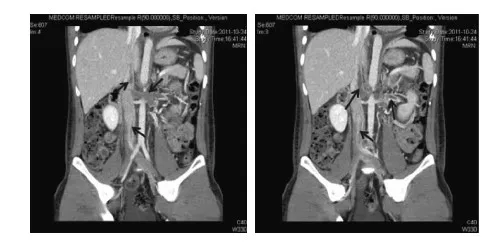
图1 2011-10-24行双肾CTV示:左肾静脉、下腔静脉内血栓形成(↑)
2012年1月和4月分别于泼尼松减至40 mg/d时复发,复发时均伴腹泻、腹痛(脐部右侧隐痛),尿量减少,可出现解黄色稀水样便、恶心、呕吐。2月13日行胃镜检查示慢性胃炎,胃体胃底交界处、胃窦黏膜斑片状充血,充血处活检,病理提示胃窦黏膜示中度慢性浅表性炎;胃底体交界黏膜示轻度慢性浅表性炎。5月17日查过敏原检测(食入组)提示螨虫过敏。予低分子肝素抗凝、对症治疗后腹部症状均好转。6月1日行肾活检术,病理诊断IgA肾病(IgAN)微小病变型,分别予足量泼尼松、泼尼松加环孢素A治疗均能达CR。
2012-07-20患者久站后出现冷汗、心慌,休息后好转,当晚出现恶心,呕吐胃内容物(10余次/d),无呕血及咖啡渣样物质;全腹持续性隐痛,阵发性加剧,伴腹胀、解黄色糊状便(3次/d),间断少量呈黑色稀便,无心慌、黑朦等症状,体重较前增加,当地医院查大便隐血阳性、Alb 15.6 g/L、D二聚体弱阳性。7月27日于我院查Alb 23.7 g/L,SCr 78.68 μmol/L,尿常规蛋白4+,D二聚体 0.88 mg/L,抗凝血酶Ⅲ 47.9%;粪常规及隐血:黄色软便、隐血(+)、红细胞镜检3~5/HP。7月29日解全程鲜红色血便约50 ml。为进一步诊治,于7月30日收入我院。本次复发后患者尿量约300~400 ml/d。病程中无皮疹、关节痛、口腔溃疡等不适。精神一般,睡眠尚可,禁食中,体力下降,体重较前增加。
既往史、个人史、家族史无特殊。
体格检查血压120/100 mmHg,体温 37℃,脉搏 101次/min,呼吸 19次/min,颜面、颈项及背部多发痤疮,全腹部、双下肢可见多处紫纹伴水泡及少许渗液。双眼球结膜水肿。双肺呼吸音清,右下肺呼吸音减低,未闻及啰音,心率101次/min,律齐,未闻及杂音。腹软,全腹广泛压痛,伴反跳痛,未扪及包块,肝脾肋下未及,腹水征阴性,肠鸣音减弱,双下肢轻度水肿。
实验室检查
尿液 蛋白定量 4.28 g/24h;尿沉渣红细胞计数2万/ml,白细胞0~1/HP;NAG酶64.3 U/(g·cr),视黄醇结合蛋白0.5 mg/L;尿C3 4.89 mg/L,α2微球蛋白5.78 mg/L;急性肾小管损伤标志物:中性粒细胞明胶酶相关胶质运载蛋白(NGAL)136.74 μg/L,肾损伤分子1(KIM-1)3.57 μg/L,白细胞介素18(IL-18)329.45 ng/L;尿溶菌酶<0.5 mg/L。
血液 血常规:血红蛋白162 g/L,白细胞7.9×109/L,中性/淋巴比例 79%/15%,血小板328×109L,C反应蛋白正常。血生化:Alb 21.2 g/L,球蛋白17.1 g/L,尿素氮9.6 mmol/L,SCr 83.10 μmol/L,尿酸 416 μmol/L,肝酶正常,总胆固醇 12.37 mmol/L,三酰甘油2.65 mmol/L,电解质正常,总二氧化碳 33.3 mmol/L,钙 1.82 mmol/L,磷 1.31 mmol/L,前白蛋白 54 mg/L。D二聚体0.52 mg/L。体液免疫:IgG 0.919 g/L,IgE 190.0 IU/ml,余免疫球蛋白正常。外周血淋巴细胞亚群CD4 223个/μl,CD8 308个/μl,CD4/CD8 0.72,CD20 119个/μl,调节T细胞 22个/μl。
粪便 7月30日至8月2日粪常规示黄色稀糊状,隐血阳性,镜检红细胞及白细胞均为0~1/HP;8月3日解果酱色稀便1次,量约20 ml,送检粪常规示果酱色稀汁样,隐血阳性,红细胞镜检满视野;8月4日后复查粪常规转为黄色稀糊状便,隐血阴性。
辅助检查胃镜:胃体黏膜光滑,色潮红,未见溃疡;胃窦黏膜红白相间,以红为主,未见溃疡及新生物(活检病理示慢性浅表性胃窦炎),慢性胃炎。结肠镜可见直肠黏膜密集出血点,远端结肠炎。仰卧位及俯卧位腹部扫描及血管成像提示:腹腔干与肠系膜上动脉共干,且起始处中度狭窄;空肠动脉分支减少,近端狭窄,肠系膜下动脉分支与肠系膜上动脉吻合,以供血空肠、降结肠区域(图2);左肾静脉局部充盈缺损,周围可见部分侧枝循环建立,腹腔少量积液;胃-十二指肠-空肠-回肠均显示清晰,未见明显节段性狭窄、扩张及异常沟通区域。经肛小肠镜检查,进镜距回盲部上约200 cm,退镜所见黏膜未见明显异常。
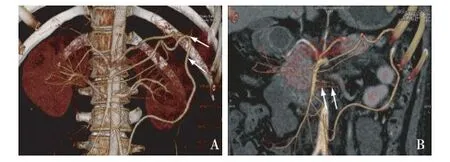
图2 A:结肠脾曲吻合处血管异常增粗(↑);B:空肠动脉分支减少,近端狭窄(↑)
肾活检
光镜 30个肾小球中1个球性废弃,余肾小球节段系膜区轻度增宽,系膜基质略增多,多数球毛细血管袢开放好,少数球袢皱缩,囊腔扩张,囊壁增厚。PASM-Masson:未见明确嗜复红物沉积。肾小管间质急性病变及慢性病变轻度,少量小管炎。
电镜 观察2个肾小球。节段肾小球系膜区增宽,基膜样物质增多,系膜区见少量中~高电子密度致密物沉积。肾小球毛细血管袢开放好,偶见内皮细胞成对,见单核细胞浸润。肾小球足细胞足突广泛融合(80%~90%),胞质少量微绒毛化,胞质内见空泡及吞噬性溶酶体。
免疫荧光 肾小球5个。IgG++、IgA++、C3+,呈颗粒状弥漫分布于系膜区。IgM、C1q阴性。
小结:符合IgAN,伴足细胞足突广泛融合。
诊疗分析青年男性,慢性病程,肾脏疾病表现为激素治疗依赖的肾病综合征,多次在泼尼松减量或劳累后疾病复发。患者起病及每次复发时,突出表现为合并消化系统症状(腹胀、腹痛、腹泻),本次复发还合并血便。经抗凝、对症处理及随着肾脏病缓解,消化道症状亦随之缓解,肾脏病复发时再次出现。行肾活检诊断为IgAN(微小病变型),起病时合并左肾静脉、下腔静脉血栓形成及肺动脉栓塞。病程中尿蛋白定量、Alb变化情况如图3。
该患者有腹痛腹泻症状,但多次查粪常规白细胞均为阴性,C反应蛋白持续正常,既往经抗凝治疗后消化道症状即能缓解,不支持肠道炎症及其他感染性疾病。根据上述特点,临床需与以下疾病鉴别。
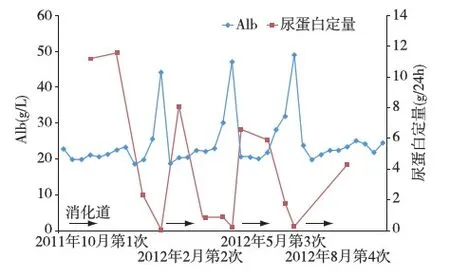
图3 患者Alb、尿蛋白定量变化
过敏性紫癜 青年男性,肾脏及消化系统受累,病情反复,既往过敏源检查提示对螨虫过敏,激素治疗有效,经肾活检证实为IgAN,考虑过敏性紫癜肾炎。但患者反复查尿检均无血尿,肾脏病理检查未发现肾小球毛细血管节段袢坏死、新月体形成等常见的血管炎表现,与典型的过敏性紫癜性肾炎的表现不同。患者病程中始终未出现典型的过敏性紫癜样皮疹,肠镜及胃镜亦未见消化道黏膜水肿、溃疡、糜烂等过敏性紫癜消化道黏膜损害表现,因此不支持该病。
克罗恩病 该患者临床表现为肾脏及消化道受累,肾脏受累经肾活检证实为IgAN,消化道受累表现为腹胀、腹泻、腹痛、血便,且激素等免疫抑制剂治疗有效,病情容易在激素减量时复发,需要与克罗恩病鉴别。克罗恩病是一种病因尚不清楚的胃肠道慢性炎性肉芽肿性疾病,从口腔至肛门各段消化道均可受累,呈节段性分布,临床为慢性病程,活动期与缓解期交替,表现为腹痛、腹泻,也可有全身多个系统损害,肠外可累及肾脏,病理类型以IgAN多见,糖皮质激素、免疫抑制剂治疗有效,内镜下可见纵行溃疡,溃疡周围黏膜呈鹅卵石样,慢性病变可见肠腔狭窄、炎性息肉等,需根据临床表现、内镜检查综合判断。但该患者行胃镜、结肠镜、小肠镜检查均未见明显异常,且亦无肠腔狭窄、炎性息肉等慢性化病变,因此不支持克罗恩病诊断。
缺血性肠病 患者临床有肾脏及消化道受累,伴肾病综合征的复发,反复出现消化道症状(腹胀、腹痛、腹泻、血便),经对症支持治疗后较快缓解,且随着肾病综合征缓解,消化道症状消失,肾脏病缓解期间消化道症状稳定。患者血液高凝,起病时有深静脉血栓形成及肺栓塞史,本次复发后腹部增强CT扫描提示腹腔干与肠系膜上动脉共干,且起始处中度狭窄;空肠动脉分支减少,近端狭窄,肠系膜下动脉与肠系膜上动脉分支吻合处较正常为粗。以上均高度提示患者存在肠系膜血管血栓形成的高危因素,但影像学检查未见明确肠系膜血管血栓形成的直接证据,可能与发病时间长、血栓小及受累血管分支小,行CT增强扫描敏感度有限有关。此外,该患者亦完成多种消化内镜检查,包括胃镜、结肠镜、小肠镜,均未发现黏膜缺血或坏死证据,考虑与患者病变轻,缓解快,病变恢复快,及检查时间相对较滞后等因素有关。虽未找到肠道缺血直接证据,但从临床表现及影像学检查间接证据考虑,且排除其他可能疾病后,能够支持缺血性肠病的诊断。
诊疗经过本次入院后予甲泼尼龙40 mg/d静脉滴注治疗原发病,禁食、肠外营养、泮托拉唑等改善消化道症状,间断输注血浆增加有效循环血容量,1周后消化道症状缓解,半月后尿蛋白定量降至0.49 g/24h,改泼尼松50 mg/d口服出院,低分子肝素抗凝预防血栓形成直至肾病综合征缓解。
最后诊断(1)IgAN(微小病变型);(2)缺血性肠病。
讨 论
缺血性肠病是20世纪60年代提出的一组疾病[1],是肠壁血液灌注不良引起的肠壁缺血性疾病,可累及各段消化道,常见于结肠,可分为急性肠系膜缺血(AMI)、慢性肠系膜缺血(CMI)及缺血性结肠炎(IC)。英国及美国系统分析显示,人群中IC的发病率为4.5~9.9/10万人年,随年龄增长而增加,40岁以上人群达到44/10万人年,女性发病率高于男性[2]。该病发病率低,早期无特异性表现,极易误诊。孙丹莉等[3]总结了近10年我国相关文献,发现该病的误诊率高达63.4%。目前,该病尚无统一的诊断标准,需综合高危因素、临床表现及辅助检查进行诊断。
病因缺血性肠病是由于肠道血流减少引起的肠壁器质性或功能障碍,肠道血流减少包括支配肠道血管本身的结构改变(闭塞)和(或)功能异常(挛缩),或者全身血液动力学变化(低灌注)等。多种原因均可导致血管病变引起缺血性肠病:(1)血管结构改变或功能异常:肠系膜动脉栓塞、血栓形成或导致血管闭塞的外伤[4];肠系膜血管的机械性阻塞,如肿瘤、肠扭转、憩室炎等[5];多种易引起肠道缺血的药物[6],如雌激素、化疗药物(生物碱和紫杉烷类)、麦角碱、可卡因;医源性因素[7],腹主动脉瘤修补术、冠脉搭桥术及结肠手术等。(2)全身血液高凝状态或血液灌注不足:蛋白C、蛋白S及抗凝血酶Ⅲ的缺乏[8-10],抗磷脂抗体综合征[11];充血性心力衰竭、各种原因引起的低血压或休克[5]。
该患者血液呈高凝状态,D二聚体升高,且起病时明确有左肾静脉、下腔静脉血栓形成,肠系膜静脉亦极有可能合并血栓形成;此外患者反复肾病综合征状态,低白蛋白血症,水肿,血管内有效循环血容量减少或不足,导致肠道血供不足,引起肠黏膜缺血。以上均为该患者出现缺血性肠病的高危因素。
临床表现该病的临床表现与缺血持续时间、程度、侧枝循环、肠内压、肠对缺血缺氧的耐受性及肠内细菌的毒力等有关。(1)AMI多见于>60岁的老年人,急性发病[12],临床表现突发的脐周疼痛[13],严重患者可迅速出现急腹症表现,24h内出现黑便或便血,一旦缺血改善,临床症状消失也快,病变恢复快[14]。(2)CMI表现为反复发作的餐后腹痛,持续2h左右逐渐缓解,且由于长期反复腹痛,导致患者畏食、消瘦。(3)IC占缺血性肠病的绝大部分,根据Brandt和Boley[15]的分型方法,可分为短暂的结肠缺血、一过性结肠缺血、慢性结肠炎、结肠狭窄、结肠坏疽和暴发性结肠炎,临床症状多无特异性,主要取决于病变的严重程度及范围。大部分患者表现为突发的痉挛性腹痛、腹泻和里急后重,腹痛多较轻,位于受累肠道部位,并在24h内有轻度出血,查体可见受累肠道部位轻中度压痛。该患者反复出现在肾病综合征复发后的腹痛、腹胀,本次入院后出现血便,提示有下消化道出血。结合患者反复发作临床特点,与肾病综合征复发密切相关,且治疗效果好,符合缺血性肠病临床特点。
肾病综合征与缺血性肠病多数文献总结的缺血性肠病为合并高血压、糖尿病、动脉粥样硬化的老年患者。肾病综合征合并缺血性肠病仅见个案报道,可能与对该病认识不足,导致误诊漏诊有关。Kim等[16]报道韩国一例膜性肾病合并肠系膜动脉血栓形成,患者在激素治疗过程中出现剧烈腹痛,并迅速发展为弥漫性全腹痛伴腹腔出血,剖腹探查手术证实肠系膜上动脉根部血栓形成,患者随后出现多脏器功能衰竭,最终死亡。2002年,Wang等[17]于报道一例微小病变性肾病合并肠系膜静脉血栓形成,患者消化道症状表现为腹胀、腹泻、恶心、呕吐,增强CT扫描显示脾静脉、肠系膜上静脉、门静脉分支及主干血栓形成,经抗凝、抗血小板治疗后复查血栓明显减少,肾病综合征缓解后消化道症状也明显好转。2008年,Yanagisawa等[18]报道一例激素依赖的局灶节段肾小球硬化症患者,消化道症状表现为剧烈腹痛、血便,腹部CT提示横结肠壁显著增厚,结肠镜提示横结肠弥漫水肿、出血、纵行溃疡,诊断为IC,对症治疗后腹痛和血便在72h内缓解。总结以上病例,肾病综合征患者出现缺血性肠病的临床表现无特异性,肠系膜动脉血栓、静脉血栓及IC均有报道。肠系膜动脉血栓形成起病急、预后差,其他两种类型经抗凝、对症治疗后均能迅速缓解。
该患者反复于肾病综合征复发后出现消化道症状,伴下消化道出血,消化道症状亦能在抗凝、对症治疗后迅速缓解,行消化内镜检查未见明确肠道病变,排除其他消化道疾病后,考虑为缺血性肠病。但遗憾的是,我们虽然对患者进行多项相关检查,除发现部分肠道供血血管稍狭窄之外,未见明确肠系膜血管内血栓及肠壁黏膜病变,考虑为较小的血管分支病变所致局部黏膜轻度缺血、病变缓解迅速,相关检查难以发现细微病变;另一方面可能与患者病变轻,恢复快,行相关检查时间相对滞后,导致检查时病变已恢复,从而难以发现典型病变有关。
治疗及预后缺血性肠病根据患者病因及临床表现不同而采取不同的治疗方法,其预后也不同。AMI多起病急、病情凶险、死亡率高,常常需要行手术治疗,预后与早期诊断、手术重建血运的时间有关。CMI可首先采用内科对症保守治疗,保守治疗无效者可采用手术行血管重建术等,多数患者呈长期慢性病程。IC相对预后较好,多数患者具有自限性,且内科对症治疗效果佳,多不需要手术治疗,对少数合并腹膜炎或中毒性休克患者需早期诊断,积极治疗,降低病死率。该患者多次发生腹胀、腹痛,但每次发作持续时间短,经积极对症治疗,及原发病治疗后能较快缓解,肾病综合征缓解期消化道症状稳定,提示肠道缺血轻。
小结:缺血性肠病是多种原因引起的肠壁缺血性疾病,临床表现及预后异质性大。本例患者表现为反复复发、激素治疗敏感的肾病综合征,合并突出的消化道症状,除发现肠道供血血管稍狭窄之外,未见明确肠系膜血管内血栓及肠壁黏膜病变,可能与患者病变轻、原发病经激素治疗后快速缓解,或检查时间相对延后有关。经抗凝治疗后消化道症状亦能较快缓解,符合缺血性肠病的临床特点。
(史明君 吴 燕 整理)
1 廖松林.缺血性肠病的病理学.诊断病理学杂志,1996,3(2):160-163.
2 Higgins PD, Davis KJ, Laine L. Systematic review: the epidemiology of ischaemic colitis. Aliment Pharmacol Ther,2004,19(7):729-738.
3 孙丹莉,张振玉, 张予蜀, 等.近10年我国主要文献缺血性肠病误诊荟萃.临床误诊误治,2009,22(6):68-70.
4 Gandhi SK, Hanson MM, Vernava AM, et al. Ischemic colitis. Dis Colon Rectum, 1996, 39(1): 88-100.
5 Green BT, Tendler DA. Ischemic colitis: a clinical review. South Med J,2005, 98(2):217-222.
6 Hass DJ, Kozuch P, Brandt LJ. Pharmacologically mediated colon ischemia. Am J Gastroenterol,2007,102(8):1765-1780.
7 Champagne BJ, Lee EC, Valerian B,et al. Incidence of colonic ischemia after repair of ruptured abdominal aortic aneurysm with endograft. J Am Coll Surg, 2007,204(4): 597-602.
8 Blanc P, Bories P, Donadio D, et al.Ischemic colitis and recurrent venous thrombosis caused by familial protein S deficiency.Gastroenterol Clin Biol,1989,13(11): 945.
9 Verger P, Blanc C, Feydy P,et al. Ischemic colitis caused by protein S deficiency. Presse Med,1996,25(29):1350.
10 Knot EA, ten Cate JW, Bruin T, et al. Antithrombin Ⅲ metabolism in two colitis patients with acquired antithrombin Ⅲ deficiency. Gastroenterology,1985,89(2):421-425.
11 Cervera R, Espinosa G, Cordero A, et al. Intestinal involvement secondary to the antiphospholipid syndrome (APS): clinical and immunologic characteristics of 97 patients: comparison of classic and catastrophic APS. Semin Arthritis Rheum,2007,36(5):287-296.
12 Stamatakos M,Stefanaki C,Mastrokalos D,et al. Mesenteric ische-mia: still a deadly puzzle for the medical community. Tohoku JExp Med,2008,216(3):197-204.
13 范建高,沈峰.提高缺血性肠病的临床认识.胃肠病学和肝病学杂志,2011,20(6):491-494.
14 Bryl W,Miczke A,Hoffmann K,et al.Chronic intestinal ischemia--not rare cause of abdominal pains-case description. Pol Merkur Lekarski,2007,23(133):52-54.
15 Brandt LJ, Boley SJ. Colonic ischemia. Surg Clin North Am,1992,72(1): 203-229.
16 Kim HJ, Park CH, Kang CM, et al. Arterial thrombosis associated with nephrotic syndrome-a case report and review (adult cases in the English literature). J Korean Med Sci,1993,8(3):230-234.
17 Wang J, Fan Q, Chen Y, et al. A case report of minimal change nephritic syndrome complicated with portal, splenic and superior mesenteric vein thrombosis. Clin Nephrol,2012,77(6):505-509.
18 Yanagisawa A, Namai Y, Sekine T, et al. Ischemic colitis as a complication in a patient with steroid-dependent nephritic syndrome. Pediatr Nephrol, 2008,23(4):655-657.