高迁移率族蛋白1与肾脏疾病
2013-04-26韩蕊,叶志斌
高迁移率族蛋白1(HMGB1)的生物学特性
HMGB1是一类广泛分布于高等真核生物细胞核内重要的染色体结合蛋白,辅助细胞核多种功能,参与DNA 重组、修复、细胞分化、染色质结构稳定及基因转录调控等生命活动,其功能对生物存活至关重要。当体内细胞处于稳态时,HMGB1主要存在于细胞核;当外界有适当的信号刺激时,HMGB1能通过炎症细胞的主动分泌和坏死细胞的被动释放转移至胞外,成为一种可被免疫系统识别的“坏死标志”,参与介导多种疾病炎症反应的发生与发展过程[1]。
目前,HMGB1相关的细胞信号转导机制尚不清楚,但可以明确的是,晚期糖基化终产物受体(RAGE)和Toll样受体家族(TLRs)部分成员是HMGB1发挥功能的重要受体。HMGB1通过RAGE途径,激活丝裂原活化蛋白激酶(MAPK)家族成员[p38、C-Jun氨基末端激酶(JNK)、细胞外调节蛋白激酶(ERK)等][2],最终使下游的核因子κB(NF-κB)活化[3,4]。DeMarco等[5]发现TLR2和TLR4可与巨噬细胞、中性粒细胞分泌的HMGB1结合,促使NF-κB活化,诱导炎症发生,这说明TLR2和TLR4亦是HMGB1的受体。该受体通路通过髓样分化蛋白(MyD88),肿瘤坏死因子受体相关受体(TRAFs)-IκB诱导激酶(IKKs)途径,活化MEK激酶(MEKKs),继而激活MAPKs及下游NF-κB(图1)[6]。
HMGB1释放到胞外成为一种重要的晚期致炎因子,其在炎症放大及维持中起着至关重要的作用。HMGB1本身并不是一个前炎症因子,本身很少或者根本没有促炎症活性,但当它与炎症介质[如干扰素γ(INF-γ)、脂多糖(LPS)、DNA、白细胞介素1β(IL-1β)等]结合时就能促发信号通路,导致NF-κB活化,进而启动后续炎症反应。多种炎症细胞(如单核巨噬细胞、中性粒细胞)、免疫细胞和固有细胞能够在上述致炎物质刺激下释放 HMGB1,又能够接受 HMGB1 的刺激而促进一系列细胞因子如单核细胞趋化蛋白(MCP-1)、肿瘤坏死因子α(TNF-α)和基质金属蛋白酶(MMP)等的大量释放,如此恶性循环,引发瀑布式的炎症反应(图1)[7]。HMGB1作为晚期促炎因子在炎症过程中具有潜在的中心作用,使得HMGB1成为抗炎治疗的新靶向分子。
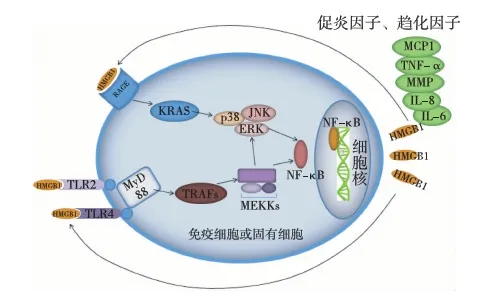
图1 HMGB1信号转导通路
HMGB1在肾脏疾病中的意义
狼疮性肾炎(LN) 系统性红斑狼疮(SLE)是一种侵犯多系统的自身免疫性疾病,常伴肾脏受累即LN。SLE的发病与免疫功能紊乱有关,尤其是体内大量异常释放的细胞因子(如TNF-α、IL-1和MMP-9等)在疾病发生发展过程中的作用备受关注。研究发现,SLE患者血清中HMGB1的浓度增加,皮损部位的表皮和真皮中HMGB1表达明显增加,其中浸润的单核细胞表达HMGB1能力尤为强大[8,9]。近年来,HMGB1在肾组织中的表达变化及在LN发病中的作用机制逐渐吸引了研究者的目光。
大量研究关注了HMGB1致炎作用的信号通路。在体外实验中用FR167653抑制p38MAPK后,成熟的树突细胞和增加的HMGB1表达均下降,表明树突细胞通过p38MAPK活化导致的HMGB1分泌增加,参与了MRL-Faslpr狼疮小鼠自身免疫性肾病的发病过程[10]。刘淑霞等[11,12]检测到在狼疮肾炎模型小鼠(BXSB小鼠)肾组织中HMGB1与NF-κB蛋白表达,NF-κB蛋白与TLR2、RAGE蛋白表达均呈显著正相关,从而表明HMGB1通过结合受体TLR2或者RAGE,激活NF-κB信号途径,促进肾小球固有细胞的增生,导致增生性肾小球肾炎。他们进一步用INF-γ刺激体外培养的人肾小球系膜细胞发现,HMGB1 mRNA和蛋白表达明显增加(P<0.01);培养上清中HMGB1浓度明显增加(P<0.01),MMP-2蛋白水平升高(P<0.01);培养上清中HMGB1浓度与MMP-2蛋白表达量呈正相关(r=0.915,P<0.01)。表明INF-γ通过促进系膜细胞合成和分泌HMGB1上调MMP-2的表达,可能与SLE肾脏损伤有关[13]。
Sanford等[14]发现,与对照组巴比塞小鼠(Balb/c小鼠)比较,注射凋亡的Balb/c源性髓系细胞(J774.1)和注射J774.1+HMGB1的小鼠自身抗体(组蛋白抗体、ssDNA、心磷脂)滴度均显著升高,但两者的经典自身抗体的滴度无显著差异;注射凋亡J774.1后的小鼠体内一不知名的大小为78 kD的蛋白滴度升高,而HMGB1能够改变这种未知的78 kD蛋白的亚细胞定位,使其在J774.1的胞质和细胞膜上表达。该研究表明HMGB1可改变自身抗原的亚细胞定位,使其具有更强的免疫反应活性;此外,HMGB1能够使注射凋亡的J774.1后的Balb/c小鼠肾脏中IgG的沉积更加广泛,出现系膜细胞和基质增生等LN样改变。HMGB1还通过与抗DNA抗体结合,在LN的发病过程中发挥作用:致病的抗DNA抗体1A3F能够与HMGB1结合,活化其受体TLR2、RAGE,通过协同作用上调肾脏系膜细胞促炎症基因的表达,增加Balb/c小鼠肾脏内趋化因子的表达。用HMGB1共孵育系膜细胞发现,1A3F与dsDNA结合活性大大提高,表明HMGB1可能在抗DNA抗体与DNA抗原的结合中起着连接的桥梁作用[15]。
HMGB1亦能够作为自身抗原,导致抗HMGB1抗体的产生。Abdulahad等[16]研究显示,在SLE患者体内抗HMGB1水平亦升高,且与HMGB1水平正相关(P=0.018,r=0.28)。血浆HMGB1、抗HMGB1抗体水平与SLE疾病活动度评分(SLEDAI)(P<0.000 1,r=0.57;P=0.013,r=0.30),抗dsDNA水平(P=0.000 6,r=0.40;P=0.003,r=0.35) 正相关,与C3(P=0.002,r=-0.36;P=0.003 5,r=-0.35)、C4水平(P<0.05,r=-0.23;P=0.03,r=-0.26)均呈负相关。有蛋白尿的患者血浆HMGB1与蛋白尿(P=0.000 1,r=0.53)呈正相关。这些结论表明除了HMGB1外,HMGB1-抗HMGB1抗体免疫复合物也在SLE发病机制中发挥重要作用,这种作用在有肾脏累及者更为显著[15]。
血浆HMGB1对SLE疾病活动的指示作用优于对器官损害的指示作用。Abdulahad等[16]发现,SLE缓解期患者血浆HMGB1水平明显高于正常对照组(P=0.026),疾病活动期患者HMGB1水平高于缓解期(P<0.000 1),活动期有肾脏累及者高于无累及者(P=0.014)。Li等[17]发现,疾病活动性SLE患者血HMGB1浓度明显高于缓解期患者(P<0.001);伴肾损害、皮疹、关节炎、血液系统、神经系统累及、浆膜炎的SLE患者与无上述器官受累的SLE患者相比,血HMGB1浓度无明显差异(P>0.05)。
抗中性粒细胞胞质抗体(ANCA)相关性血管炎(AAV)肾损害TNF-α拮抗剂应用于AAV中,能够较好地阻断TNF-α介导的炎症损伤,但不能为逆转AAV所造成的器官损害,表明除TNF-α外仍有其他的因子介导器官损害。肾脏是AAV的主要受累器官,Hewins 等[18]在AAV患者肾活检组织中发现IL-18的沉积,体外实验也证实了其诱导的超氧化物产生、p38MARK的磷酸化过程等作用无法被TNF-α抗体阻断,从而表明IL-18是一种介导AAV肾脏损害的重要因子。 Bruchfeld等[19]关注了HMGB1在AAV肾损害中的作用,在纳入的三种AAV(维格纳肉芽肿、显微镜下多血管炎、变应性肉芽肿)患者中,有肾脏累及的疾病活动者HMGB1水平较不活动者明显上升(P=0.01);活动期肾组织免疫组化提示HMGB1染色强阳性,其中7例患者于缓解期再次行肾活检发现,HMGB1着色明显减弱,同时缓解期血清HMGB1水平较活动期显著下降(P=0.03),缓解后体内HMGB1的低水平升高表明了低水平的炎症状态或组织损伤。HMGB1能否预测AAV的活动程度和预后转归,能否作为AAV器官损害的治疗靶点,则需更大规模的研究来证实。
急性肾损伤(AKI) 脓毒症是一种由感染引发的严重炎症反应,是重症患者的首要死因。AKI是脓毒症重要的并发症,ICU患者中死亡者70~80%都会发生AKI。HMGB1作为一种全身炎症反应的晚期介导因子,能否为临床上控制脓毒症的炎症级联反应提供一个足够的时间窗,HMGB1阻断剂能否通过抑制其表达起到预防AKI发生的作用呢?Hu等[20]的研究关注了这一点。手术造模后的各测量时间段(2h、6h、24h)内,脓毒症组较正常组血浆尿素氮(BUN)、肌酐(Cr)、谷丙转氨酶(ALT)、谷草转氨酶(AST)均明显上升,脓毒症组与正常组比较,HMGB1、RAGE、TLR4、iNOS和磷酸化的NF-κB p65 蛋白和(或)mRNA表达均明显升高,IκB-α则表达下降。免疫组化显示,在正常组和脓毒症谷氨酰胺(SG)治疗组,HMGB1主要分布在肾脏固有细胞尤其是肾小管上皮细胞的胞核中。在脓毒症组中,胞质中的HMGB1明显增加,细胞外也可见大量HMGB1分布。
谷氨酰胺是循环中氨基酸自由基最广泛的供者,具有免疫调节作用,且能通过阻断HMGB1表达,缓解脓毒症急性肺损伤。Hu等[20]首次证明了在脓毒症造成的AKI中,HMGB1介导了肾组织炎症和氧化应激损伤,且谷氨酰胺能够有效预防HMGB1上述作用。脓毒症启动48h后,SG组存活率明显高于对照组存活率(56%vs22%),谷氨酰胺能够显著下调HMGB1、RAGE、TLR4、MyD88、NF-κB p65,降低血浆BUN、Cr、AST、ALT水平,减轻肾脏损害,提高存活率,故而谷氨酰胺有望成为预防脓毒症性AKI的有效药物。
慢性肾脏病(CKD)及维持性透析患者Bruchfeld等[21]的横断面研究发现,HMGB1在CKD患者中明显升高,且与肾小球滤过率(GFR)及多种炎症、营养指标均有良好的相关性。该研究结果显示,CKD 3~5期患者与正常人相比血浆HMGB1明显增加(P<0.001),HMGB1水平与TNF(P<0.001,r=0.52),高敏C反应蛋白(hs-CRP)(P<0.001,r=0.38),IL-6(P<0.001,r=0.30),糖化血红蛋白(HbA1c)(P=0.02,r=0.14),主观总体营养评估(SGA) (P=0.002,r=0.21) 均呈正相关;与GFR(P=0.000 1,r=-0.69),血红蛋白(P<0.001,r=-0.60),血浆白蛋白(P<0.001,r=-0.31) 呈负相关[21]。
Sato等[22]则认为,HMGB1可能并非是一种炎症因子,而是提示一些特殊情况(如肾脏血管炎)。在ANCA相关性肾小球肾炎(ANCA-GN)、紫癜性肾炎(HSPN)、微小病变性肾病(MCD)、IgA肾病(IgAN)、膜性肾病(MN)、局灶节段性肾小球硬化(FSGS)、糖尿病肾病(DN)、LN等不同类型肾脏病患者中,仅ANCA-GN、HSPN、IgAN伴新月体形成者与血浆HMGB1阳性呈正相关,CRP、IL-6、IL-1β、TNF-α等炎症因子及抗HMGB1抗体均与血浆HMGB1阳性无明显相关性,IgAN的其他病变如肾小球细胞增生、间质浸润、肾小管萎缩亦未与血浆HMGB1阳性率相关。故在有肾脏血管炎的一些疾病如ANCA-GN、HSPN及IgAN新月体形成时,血浆HMGB1升高才更具诊断意义[22]。
慢性肾衰竭患者TNF-α、IL-6等细胞因子水平升高,CRP等急性时相反应物增多,呈现出“微炎症状态”。有证据表明,微炎症状态与慢性肾衰竭患者营养不良、心血管事件等并发症密切相关[23,24],作为致炎细胞因子的HMGB1能否对慢性肾衰竭患者的微炎症状态有指向作用?谷立杰等[25]研究表明,维持性血液透析(MHD)患者血清HMGB1、TNF-α和IL-6 水平均显著高于正常对照组(P<0.01),HMGB1水平与TNF-α(r=0.711,P<0.01)、IL-6(r=0.804,P<0.01)、可溶性血管细胞黏附分子(sVCAM-1)(r=0.454,P<0.01)、E选择素水平(r=0.601,P<0.01) 呈正相关;与血红蛋白(r=-0.260,P<0.05)和白蛋白呈负相关(r=-0.372,P<0.05);与总胆固醇、三酰甘油及空腹血糖等不相关(P>0.05),表明血清HMGB1水平升高与MHD患者血管内皮损伤密切相关,其作为一项评价MHD患者微炎症状态的新指标具有潜在临床应用价值。王婷婷等[26]研究显示,肾衰竭并发腹膜炎患者腹水(渗出液)HMGB1水平明显高于慢性肾衰竭无并发症患者及肾衰竭并发肺炎患者(漏出液)(P< 0.01);无并发症组与漏出液组腹水HMGB1水平的差异无统计学意义;漏出液组和渗出液组血浆CRP水平显著高于无并发症组(P<0.01)。表明HMGB1在腹水中表达水平的高低与慢性肾衰竭患者本身是否伴感染性并发症无明显相关性,而与腹水本身是漏出或渗出液的性质有关,HMGB1检测对慢性肾衰竭患者腹水性质的鉴别有较好的临床意义,若联合血浆CRP检测对临床鉴别诊断慢性肾衰竭有无并发其他感染性疾病也具有一定意义。
间质性肾炎在腺嘌呤喂养大鼠的肾组织、尿、血清中均发现高水平的HMGB1、MCP1表达,向腺嘌呤喂养大鼠腹腔内注射HMGB1能使其血清肌酐(SCr)、BUN升高。腺嘌呤喂养HMGB1+/-杂合小鼠建造相同模型,MCP-1表达明显减少,肾脏组织中巨噬细胞聚集减少。HMGB1的受体RAGE、 TLR4也在腺嘌呤大鼠肾组织中高表达,用HMGB1刺激肾小管上皮细胞,可发现明显的MCP-1分泌,应用ERK/JNK/p38及PI3K/Akt的抑制剂后,HMGB1刺激下的MCP-1分泌明显减少,表明HMGB1能够通过使肾组织表达MCP-1吸引巨噬细胞浸润,进而造成肾脏损伤,而MAPK、PI3K/Akt信号系统均参与这一过程[2]。
肾脏缺血-再灌注损伤(IRI) IRI是急性器官损伤及器官移植后不可避免的损伤,IRI后组织释放多种炎症介质,使中性粒细胞在损伤部位及远处器官趋化、活化、黏附、聚集,促发严重的炎症反应。已有研究证实HMGB1可能在心脏、脑、肝脏等器官的IRI模型中作为早期炎症因子发挥损伤效应[27,28]。Li等[29]的研究关注了HMGB1在肾脏IRI中的作用。正常小鼠肾实质细胞质内几乎无HMGB1表达,夹闭肾蒂造成小鼠肾缺血后1h,细胞核和细胞质内HMGB1均呈阳性,随着时间延长,HMGB1在胞质阳性程度呈增加趋势,再灌注3h达高峰,随后胞质HMGB1表达量呈下降趋势,再灌注24h后HMGB1表达量仍较高。冷缺血再灌注损伤具有研究肾移植更强的针对性,冷缺血再灌注组HMGB1、TNF-α、NF-κB 水平均显著高于假手术组(P<0.01),表明HMGB1参与了肾移植冷缺血再灌注的病理过程[30]。
TLR4是目前较为公认的HMGB1作用受体。肾脏IRI后,受损伤细胞释放的HMGB1能够增加野生型肾脏内皮细胞中内皮细胞黏附分子(CD54,CD106,CD62E)的表达,TLR4基因敲除(TLR4-/-)的内皮细胞对HMGB1无反应[31]。Wu等[32]也发现IRI后,TLR4-/-小鼠较野生型小鼠的SCr较低,肾小管损伤轻微,表明了HMGB1是通过与TLR4结合介导IRI损伤。 为了研究外源性的HMGB1能否加重肾脏IRI,再灌注的同时将重组HMGB1(rHMGB1)注射入小鼠体内,观察到小鼠的血浆肌酐水平升高,肾小管损伤加重;应用rHMGB1 24h后,肾组织IL-6、TNF-α、MCP-1表达进一步增加,但rHMGB1并未使中性粒细胞和巨噬细胞浸润进一步加重,也未造成TLR4-/-小鼠肾功能减退和肾小管进一步损伤[32]。
HMGB1作为一种炎症因子在肾脏IRI扮演重要角色,通过阻断HMGB1,抑制其导致的炎症级联反应,从而减轻肾脏IRI。经腹腔内予抗HMGB1中和抗体后,SCr及BUN明显低于对照组IRI小鼠(P<0.05);在组织学上,抗HMGB1抗体能够显著缓解IRI后中性粒细胞和巨噬细胞在肾脏间质的浸润,减少肾小管上皮细胞的凋亡,改善间质出血;还能够使肾脏组织IL-6、TNF-α、MCP-1表达显著减少。应用抗HMGB1中和抗体后,在肾组织发现明显的抗体沉积痕迹,表明HMGB1抗体能沉积于肾脏局部,中和组织局部的HMGB1[29,32]。应用抗HMGB1抗体后,并未对TLR4-/-小鼠的肾脏产生进一步的保护作用[32]。在IRI发生24h后应用抗HMGB1抗体仍有良好的肾脏保护作用,SCr下降,肾小管损伤改善。在肾脏IRI发生前后应用抗HMGB1或许能为肾脏IRI提供新的治疗靶点[32]。此外,HMGB1拮抗剂丙酮酸乙酯也被证实能够在肾脏冷缺血再灌注损伤中改善肾功能[30]。
目前研究证实,多种自身免疫性疾病(如类风湿关节炎、干燥综合征、多肌炎/皮肌炎、系统性硬化症等),脓毒症,休克,各种肿瘤(如乳腺癌、结直肠癌、胃癌等),高血压各种并发症(动脉粥样硬化、心肌梗死、血管重构、血管再狭窄等)及1型糖尿病等的发生发展中,都发现了HMGB1的参与,且HMGB1与疾病的临床表现、严重程度和预后转归均相关,且使用抗HMGB1抗体或rHMGB1 A box蛋白等拮抗HMGB1效应,能够对疾病产生抑制作用。上述疾病在发生发展中均有可能累及肾脏,HMGB1在继发肾脏病变中的表达情况、炎症通路,与临床表现、生化指标和疾病严重程度间的相关性,及拮抗HMGB1后的预防和保护机制等还有待进一步的研究证实。此外,各种原发性肾脏疾病(如IgAN、系膜增生性肾小球肾炎等)的发生多有免疫炎症机制的存在,HMGB1能否在细胞及基质增生、炎症细胞浸润、免疫复合物沉积中起关键作用还有待考证。HMGB1作为一种全身炎症反应的晚期介导因子,其控制炎症级联反应的作用仍需大规模的基础和临床研究证实。
1 Yang H,Tracey KJ.Targeting HMGB1 in inflammation.Biochim Biophys Acta,2010,1799(1-2):149-156.
2 Oyama Y,Hashiguchi T,Taniguchi N,et al.High-mobility group box-1 protein promotes granulomatous nephritis in adenine-induced nephropathy.Lab Invest,2010,90(6):853-866.
3 Huttunen HJ,Fages C,Rauvala H.Receptor for advanced glycation end products (RAGE)-mediated neurite outgrowth and activation of NF-kappaB require the cytoplasmic domain of the receptor but different downstream signaling pathways.J Biol Chem,1999,274(28):19919-19924.
4 Degryse B,Bonaldi T,Scaffidi P,et al.The high mobility group (HMG) boxes of the nuclear protein HMG1 induce chemotaxis and cytoskeleton reorganization in rat smooth muscle cells.J Cell Biol,2001,152(6):1197-1206.
5 DeMarco RA,Fink MP,Lotze MT.Monocytes promote natural killer cell interferon gamma production in response to the endogenous danger signal HMGB1.Mol Immunol,2005,42(4):433-444.
6 Ulloa L,Messmer D.High-mobility group box 1 (HMGB1) protein: friend and foe.Cytokine Growth Factor Rev,2006,17(3):189-201.
7 Park JS,Arcaroli J,Yum HK,et al.Activation of gene expression in human neutrophils by high mobility group box 1 protein.Am J Physiol Cell Physiol,2003,284(4):C870-C879.
8 Urbonaviciute V,Fürnrohr BG,Weber C,et al.Factors masking HMGB1 in human serum and plasma.J Leukoc Biol,2007,81(1):67-74.
9 Popovic K,Ek M,Espinosa A,et al.Increased expression of the novel proinflammatory cytokine high mobility group box chromosomal protein 1 in skin lesions of patients with lupus erythematosus.Arthritis Rheum,2005,52(11):3639-3645.
10 Iwata Y,Furuichi K,Sakai N,et al.Dendritic cells contribute to autoimmune kidney injury in MRL-Faslpr mice.J Rheumatol,2009,36(2):306-314.
11 刘淑霞,郝军,郭惠芳,等.HMGB1/TLR/NF-κB在狼疮性肾炎小鼠肾组织中的表达及意义.中国免疫学杂志,2009,25(5):450-453.
12 封晓娟,刘淑霞,张玉军,等.NF-κB信号途径在小鼠狼疮性肾炎发病中的可能作用.中国免疫学杂志,2010,26(2):169-173.
13 刘淑霞,郭惠芳,郝军,等.INF-γ对体外培养的系膜细胞HMGB1和MMP-2表达的影响.吉林大学学报(医学版),2009,35(1):47-50,195.
14 Sanford AN,Dietzmann K,Sullivan KE.Apoptotic cells,autoantibodies,and the role of HMGB1 in the subcellular localization of an autoantigen.J Autoimmun,2005,25(4):264-271.
15 Qing X,Pitashny M,Thomas DB,et al.Pathogenic anti-DNA antibodies modulate gene expression in mesangial cells: involvement of HMGB1 in anti-DNA antibody-induced renal injury.Immunol Lett,2008,121(1):61-73.
16 Abdulahad DA,Westra J,Bijzet J,et al.High mobility group box 1 (HMGB1) and anti-HMGB1 antibodies and their relation to disease characteristics in systemic lupus erythematosus.Arthritis Res Ther,2011,13(3):R71.
17 Li J,Xie H,Wen T,et al.Expression of high mobility group box chromosomal protein 1 and its modulating effects on downstream cytokines in systemic lupus erythematosus.J Rheumatol,2010,37(4):766-775.
18 Hewins P,Morgan MD,Holden N,et al.IL-18 is upregulated in the kidney and primes neutrophil responsiveness in ANCA-associated vasculitis.Kidney Int,2006,69(3):605-615.
19 Bruchfeld A,Wendt M,Bratt J,et al.High-mobility group box-1 protein (HMGB1) is increased in antineutrophilic cytoplasmatic antibody (ANCA)-associated vasculitis with renal manifestations.Mol Med,2011,17(1-2):29-35.
20 Hu YM,Pai MH,Yeh CL,et al.Glutamine administration ameliorates sepsis-induced kidney injury by downregulating the high-mobility group box protein-1-mediated pathway in mice.Am J Physiol Renal Physiol,2012,302(1):F150-158.
21 Bruchfeld A,Qureshi AR,Lindholm B,et al.High Mobility Group Box Protein-1 correlates with renal function in chronic kidney disease (CKD).Mol Med,2008,14(3-4):109-115.
22 Sato F,Maruyama S,Hayashi H,et al.High mobility group box chromosomal protein 1 in patients with renal diseases.Nephron Clin Pract,2008,108(3):c194-c201.
23 刘德慧,李宓.维持性血液透析患者动脉粥样硬化的发病机制研究进展.中国血液净化,2007,6(10):562-565.
24 严艳,洪明玉,汪年松,等.非透析肾衰竭患者微炎症、白蛋白、前白蛋白与营养不良的关系.中国中西医结合肾病杂志,2009,10(6):520-523.
25 谷立杰,朱楠,袁伟杰,等.高迁移率族蛋白B1与维持性血液透析患者微炎症及内皮损伤的相关性探讨.中国血液净化,2011,(6):315-318.
26 王婷婷,刘鸿生,蒋华振,等.慢性肾衰竭患者腹水高迁移率族蛋白检测及其意义.中华医院感染学杂志,2011(16):3373-3374.
27 Goldstein RS,Gallowitsch-Puerta M,Yang L,et al.Elevated high-mobility group box 1 levels in patients with cerebral and myocardial ischemia.Shock,2006,25(6):571-574.
28 Tsung A,Sahai R,Tanaka H,et al.The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion.J Exp Med,2005,201(7):1135-1143.
29 Li J,Gong Q,Zhong S,et al.Neutralization of the extracellular HMGB1 released by ischaemic damaged renal cells protects against renal ischaemia-reperfusion injury.Nephrol Dial Transplant,2011,26(2):469-478.
30 韦星,蔡明,石炳毅,等.高迁移率族蛋白B1在肾脏冷缺血再灌注损伤中的作用.中国组织工程研究与临床康复,2011,15(44):8297-8300.
31 Chen J,John R,Richardson JA,et al.Toll-like receptor 4 regulates early endothelial activation during ischemic acute kidney injury.Kidney Int,2011,79(3):288-299.
32 Wu H,Ma J,Wang P,et al.HMGB1 contributes to kidney ischemia reperfusion injury.J Am Soc Nephrol,2010,21(11):1878-1890.