激动网织红核因子相关因子2对大鼠氧化应激所致血管平滑肌细胞损伤的影响
2013-04-24何国祥刘建平
冯 健, 何国祥, 刘建平, 景 涛
激动网织红核因子相关因子2对大鼠氧化应激所致血管平滑肌细胞损伤的影响
冯 健, 何国祥*, 刘建平, 景 涛
(第三军医大学附属西南医院心血管内科, 重庆 400038)
探讨激动网织红核因子相关因子2(Nrf2)对氧化应激诱导的大鼠血管平滑肌细胞(VSMCs)损伤的影响。原代培养大鼠VSMCs,随机分为4组:对照组、氧化损伤组、Nrf2激动剂组、Nrf2干扰慢病毒组。Western免疫印迹法检测Nrf2蛋白表达变化,MTT法检测各组细胞活力,Hoechst 33342法及Annexin V/FITC法检测各组细胞凋亡情况。荧光显微镜显示,Nrf2干扰慢病毒成功感染VSMCs;Western免疫印迹检测显示,Nrf2干扰慢病毒感染细胞后,Nrf2蛋白表达与对照组比较显著降低(<0.05)。与氧化损伤组比较,Nrf2激动剂组VSMCs活力显著增加(<0.05),细胞凋亡显著降低(<0.05);而Nrf2干扰慢病毒组VSMCs活力显著减弱(<0.05),细胞凋亡明显增加(<0.05)。激动Nrf2能减轻氧化应激引起的VSMCs损伤,这可为VSMCs损伤的防治提出新的研究方向。
网织红核因子相关因子2; 氧化应激; 血管平滑肌细胞
动脉粥样硬化(atherosclerosis,AS)及其相关疾病的发生发展与血管老化有着密切的联系。氧化应激参与了血管老化并在血管老化中扮演着重要的角色。减轻血管细胞氧化应激损伤,对延缓细胞衰老,防治AS的发生有重要意义[1,2]。网织红核因子相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)是近来发现的调控细胞内氧化应激的主要转录因子。因此,本研究以血管平滑肌细胞(vascular smooth muscle cells,VSMCs)为研究对象,观察激动Nrf2对氧化应激导致VSMCs损伤的影响,以期为VSMCs损伤的防治提出新的研究方向。
1 材料与方法
1.1 材料
出生3~4周的清洁级Sprague-Dawley(SD)雄性大鼠,购于第三军医大学实验动物中心;齐墩果酸(美国Sigma公司);胎牛血清、达尔伯克改良伊格尔培养液(美国Gibco公司);Annexin V-FITC/PI凋亡检测试剂盒(北京四正柏生物科技有限公司);Hoechst 33342(碧云天生物技术研究所);Western blot化学发光检测试剂盒(美国 Amersham公司);其他试剂为国产分析纯或进口分装。
1.2 大鼠血管平滑肌细胞培养及鉴定
参照文献[3]方法进行,断颈处理雄性SD大鼠后,无菌条件下分离大鼠主动脉血管,采用贴块法培养细胞,0.25%胰酶消化传代并纯化后,经倒置相差显微镜及免疫组织化学鉴定为VSMCs,4~8代细胞用于实验。
1.3 实验分组
将用于实验的VSMCs随机分为4组:(1)对照组:不加干预因素;(2)氧化损伤组:加入过氧化氢(H2O2);(3)Nrf2激动剂组:加入H2O2及Nrf2激动剂齐墩果酸;(4)Nrf2干扰慢病毒组:加入H2O2并感染Nrf2干扰慢病毒。每个组均重复4次(=4)。
1.4 Nrf2干扰慢病毒感染细胞
参照文献[4]方法包装Nrf2干扰慢病毒后,将Nrf2干扰慢病毒液用移液器加入细胞培养液中感染各组VSMCs,24h换液1次,72h后可在荧光显微镜下观察细胞感染情况。
1.5 Western免疫印迹法检测蛋白表达
提取细胞蛋白并绘制标准曲线,测定样品浓度,灌胶,上样量为50μg,电泳后转至PVDF膜,加入一抗、二抗后用凝胶扫描成像,图像分析软件进行分析。
1.6 MTT法检测细胞活力
接种VSMCs于96孔板,用无血清DMEM培养24h后,加入干预因素,继续放入37℃、5%CO2孵箱中培养相应的时间后,每孔加入20μl MTT工作液,继续放入37℃、5%CO2中孵育4h;小心吸掉培养孔中上清液,每孔加入150μl DMSO,震荡10min,使结晶物质充分溶解并在酶标仪490nm波长处检测吸光度值。
1.7 Hoechst 33342检测细胞凋亡
将干预后的细胞取出,加入0.25%胰酶消化后,离心,去上清;用1ml 4%多聚甲醛的PBS重悬细胞,室温10min;离心,用PBS洗2次,加入5μl Hoechst 33342染色液;用移液枪混匀溶液后,冰浴10min;再次离心后,去上清,并用PBS洗1次;涂片,在荧光显微镜下观察蓝色荧光。
1.8 流式细胞仪检测细胞凋亡
将VSMCs干预后,按照Annexin V-FITC/PI凋亡检测试剂盒说明书进行操作,在流式细胞仪上检测细胞凋亡情况。
1.9 统计学处理
2 结 果
2.1 Nrf2干扰慢病毒感染大鼠VSMCs及Nrf2蛋白表达
将Nrf2干扰慢病毒液加入细胞培养液中感染VSMCs,培养24h后换液1次,72h后可在荧光显微镜下观察细胞绿色荧光表达(图1)。提取细胞核蛋白,Western 免疫印迹结果表明,与对照组比较,感染Nrf2干扰慢病毒后细胞Nrf2蛋白表达显著降低,差异有统计学意义(<0.05;图2)。
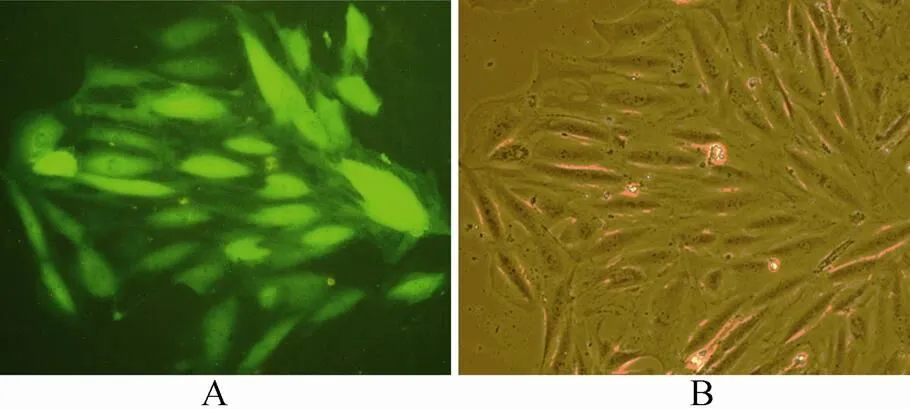
图1 Nrf2干扰慢病毒感染VSMCs
Figure 1 VSMCs are infected by Nrf2 siRNA-expressing lentiviral vector
VSMCs:血管平滑肌细胞。A: 荧光显微镜下照片(×100); B: 光镜下照片(×100)
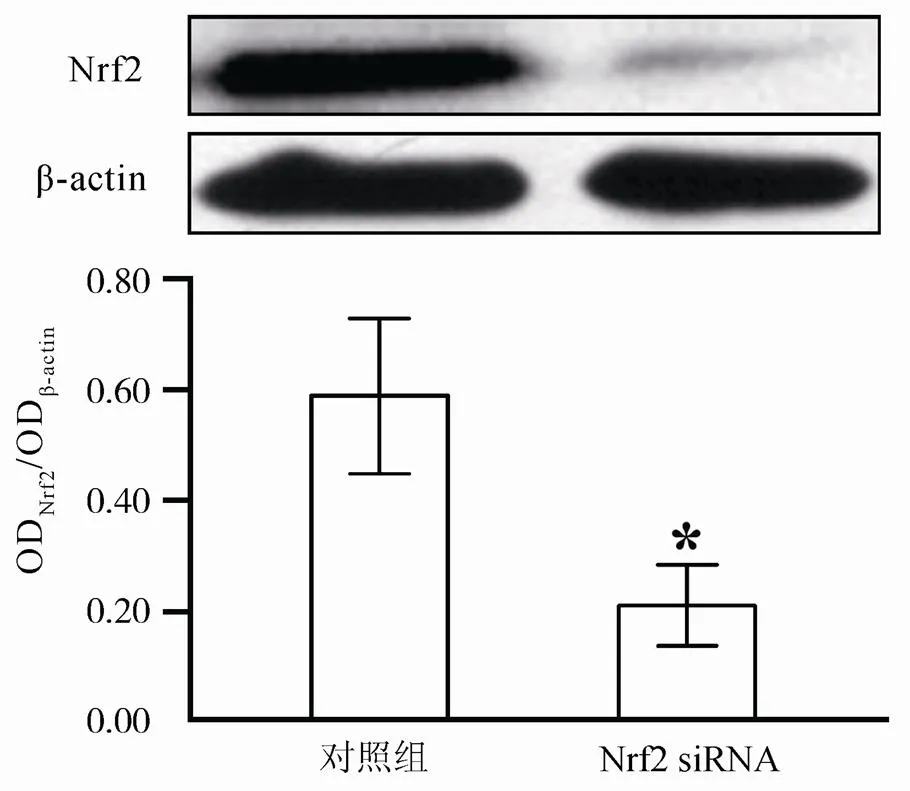
图2 干扰后VSMCs中Nrf2蛋白表达变化
Figure 2 Protein levels of Nrf2 in VSMCs after infection
VSMCs: 血管平滑肌细胞; Nrf2: 网织红核因子相关因子2。与对照组比较,<0.05
2.2 激动Nrf2对大鼠VSMCs氧化应激损伤的影响
MTT结果表明,与对照组比较,氧化损伤组VSMCs吸光度值显著降低(<0.05);加入Nrf2激动剂齐墩果酸后,VSMCs吸光度值与氧化损伤组比较显著增加(<0.05);而感染Nrf2干扰慢病毒后,VSMCs吸光度值再次降低(<0.05;表1)。
Annexin V结果显示,与对照组比较,氧化损伤组VSMCs凋亡率显著升高(<0.05);与氧化损伤组比较,Nrf2激动剂组VSMCs凋亡率显著降低(<0.05);与氧化损伤组比较,Nrf2干扰慢病毒组VSMCs凋亡率明显升高(<0.05;表1)。

表1 各组VSMCs活性及凋亡的变化
注: VSMCs: 血管平滑肌细胞。与对照组比较,P<0.05; 与氧化损伤组比较,#<0.05
Hoechst 33342结果再次显示,对照组细胞核呈蓝色;给予H2O2处理后大量细胞核呈致密浓染。给予Nrf2激动剂预处理后,再加入H2O2培养24h,大量细胞核呈蓝染,有少许细胞核呈致密浓染;当感染Nrf2干扰慢病毒后,VSMCs抗氧化应激损伤作用被削弱,大量细胞核呈致密浓染(图3)。
3 讨 论
越来越多的研究表明,AS血管中的细胞处于老化状态,血管老化是随着时间和细胞分裂、生长及功能逐渐丧失的过程,在血管老化的过程中,大量的自由基不断地生成,从而导致羟自由基的过度产生,进一步加剧血管老化与损伤[5,6]。VSMCs是血管壁的重要血管细胞之一,是血管抵御外界刺激的第一道屏障。大量的证据表明,VSMCs在老化中的改变与氧化和抗氧化的平衡有关。VSMCs在氧化应激的作用下产生适应性修饰则不可避免地引起血管老化[7]。
Nrf2是一种重要的核转录调控基因,参与了一系列抗氧化基因的表达调控,其激活后可以启动下游多种抗氧化基因的表达,作用涉及到AS的多个层面和环节[8]。VSMCs凋亡会导致AS斑块的不稳定,甚至发生破裂。因此,本研究以H2O2诱导VSMCs产生氧化应激损伤,实验发现,给VSMCs予以H2O2(400μmol/L)后,VSMCs凋亡显著增加。在本实验中,我们给予Nrf2激动剂齐墩果酸后,H2O2导致的VSMCs凋亡显著降低,并且激动Nrf2能增加细胞活力;而Nrf2干扰慢病毒感染VSMCs后,H2O2导致的VSMCs活力明显下降,细胞凋亡明显增加。这可能与干扰Nrf2后,细胞内Ⅱ相抗氧化酶基因表达减少,削弱了VSMCs的抗氧化应激损伤的能力有关[9]。近来也有研究表明转染Nrf2基因对VSMCs的生长发挥抑制作用[10]。Kim等[11]研究也表明血红素氧合酶-1介导了Nrf2抑制VSMCs增殖的作用。上述研究结果与本实验的差异,可能是因为不同的实验条件、不同的刺激因素以及时相性,引起了Nrf2启动相应效应的结果。因此,在选择依赖于Nrf2的治疗措施时,应综合考虑这些因素。
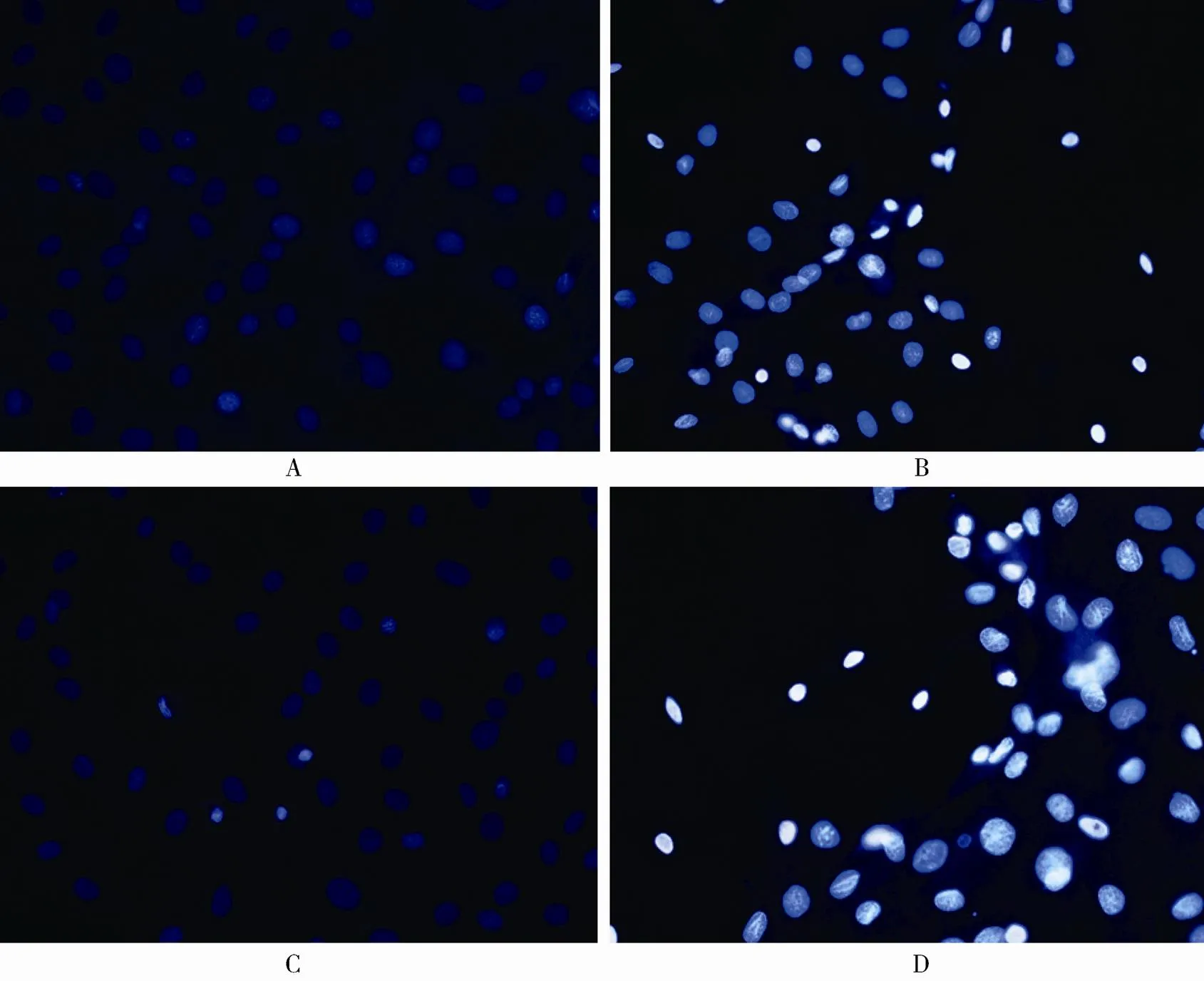
图3 Hoechst 33342检测各组细胞凋亡情况
Figure 3 Cell apoptosis were detected by Hoechst 33342 (Hoechst 33342×200)
A: 对照组; B: 氧化损伤组; C: Nrf2激动剂组; D: Nrf2干扰慢病毒组
综上所述,激动Nrf2能减轻氧化应激状态下VSMCs凋亡,提高细胞活力,提示Nrf2可能是防治VSMCs损伤的新靶点。但本实验未直接对激动Nrf2后VSMCs的老化及其具体机制进行深入具体的探讨,而且激动Nrf2后的体内疗效尚有待今后进一步研究。
[1] Liu Y, Chen KJ. Atherosclerosis, vascular aging and therapeutic strategies[J]. Chin J Integr Med, 2012, 18(2): 83-87.
[2] Dal-Ros S, Bronner C, Auger C,. Red wine polyphenols improve an established aging-related endothelial dysfunction in the mesenteric artery of middle-aged rats: role of oxidative stress[J]. Biochem Biophys Res Commun, 2012, 419(2): 381-387.
[3] 冯 健, 何国祥. 齐墩果酸对过氧化氢诱导血管平滑肌细胞凋亡的影响[J]. 中华老年心脑血管病杂志, 2012, 14(1): 66-68.
[4] Feng J, Zhang P, Chen X,. PI3K and ERK/Nrf2 pathways are involved in oleanolic acid-induced heme oxygenase-1 expression in rat vascular smooth muscle cells[J]. J Cell Biochem, 2011, 112(6): 1524-1531.
[5] Patel RS, AI Mheid I, Morris AA,. Oxidative stress is associated with impaired arterial elasticity[J]. Atherosclerosis, 2011, 218(1): 90-95.
[6] Collins AR, Lyon CJ, Xia X,. Age-accelerated atherosclerosis correlates with failure to upregulate antioxidant genes[J]. Circ Res, 2009, 104(6): e42-54.
[7] Ungvari Z, Bailey-Downs L, Sosnowska D,. Vascular oxidative stress in aging: a homeostatic failure due to dysregulation of NRF2-mediated antioxidant response[J]. Am J Physiol Heart Circ Physiol, 2011, 301(2): H363-372.
[8] Li J, Ichikawa T, Janicki JS,. Targeting the Nrf2 pathway against cardiovascular disease[J]. Expert Opin Ther Targets, 2009, 13(7): 785-794.
[9] Brunt KR, Fenrich KK, Kiani G,. Protection of human vascular smooth muscle cells from H2O2-induced apoptosis through functional codependence between HO-1 and AKT[J]. Arterioscler Thromb Vasc Biol, 2006, 26(9): 2027-2034.
[10] Levonen AL, Inkala M, Heikura T,. Nrf2 gene transfer induces antioxidant enzymes and suppresses smooth muscle cell growthand reduces oxidative stress in rabbit aorta[J]. Arterioscler Thromb Vasc Biol, 2007, 27(4): 741-747.
[11] Kim SE, Lee MY, Lim SC,. Role of Pin1 in neointima formation: down-regulation of Nrf2-dependent heme oxygenase-1 expression by Pin1[J]. Free Radic Biol Med, 2010, 48(12): 1644-1653.
(编辑: 周宇红)
Effects of activation of nuclear factor-erythroid 2-related factor 2 on oxidative stress-induced injury of vascular smooth muscle cells in rat
FENG Jian, HE Guoxiang*, LIU Jianping, JING Tao
(Department of Cardiology, Southwest Hospital, Third Military Medical University, Chongqing 400038, China)
To investigate the effect of the activation of nuclear factor-erythroid 2-related factor 2 (Nrf2) on the injury of rat vascular smooth muscle cells (VSMCs) induced by oxidative stress.Rat aortic VSMCs were cultured and divided into control group, oxidative damage group, Nrf2 activation group and Nrf2 siRNA-expressing lentiviral vector (Nrf2 siRNA) group. Protein level of Nrf2 was determined by Western blotting. Cell viability was measured by MTT assay, and cell apoptosis was determined by Hoechst 33342 and Annexin V/FITC.VSMCs were transiently transfected with Nrf2 siRNA. Nrf2 siRNA significantly inhibited the expression of Nrf2 at protein level compared to the control(<0.05). Compared to oxidative damage group, cell viability was significantly increased (<0.05) and cell apoptosis was decreased in Nrf2 activation group(<0.05). However, compared to oxidative damage group, cell viability was significantly decreased (<0.05) and cell apoptosis was increased in Nrf2 siRNA group(<0.05).Nrf2 activation can reduce oxidative stress-induced damage inVSMCs.
nuclear factor-erythroid 2-related factor 2; oxidative stress; vascular smooth muscle cells
R543
A
10.3724/SP.J.1264.2013.00058
2012-12-10;
2012-12-31
冯 建, 现在四川省泸州医学院附属医院心内科工作
何国祥, Tel: 023-68754268, E-mail: yyxnk@yahoo.com.cn
