化学发光法检测不同干燥方法对金银花抗氧化活性和化学成分的影响
2013-04-23王梅刘峰林昌虎张清海张永清刘建华王晓
王梅,刘峰,林昌虎,张清海,张永清,刘建华,王晓*
(1.山东师范大学生命科学学院,山东 济南 250014;2.山东省分析测试中心,山东 济南 250014;3.贵州省理化测试分析研究中心,贵州省科学院,贵州 贵阳 550002;4.山东中医药大学,山东 济南 250355)
金银花为忍冬科植物忍冬(Lonicera japonica Thunb.)的干燥花蕾或带初开的花[1],具有抗氧化、抗病毒、抗生育、降血脂、免疫调节、凉散风热,清热解毒等功效[2],对结核杆菌、大肠杆菌、伤寒杆菌等也有很强的抑制作用[3-4]。金银花中含有的丰富的黄酮类和多酚类物质具有较强的抗氧化活性[5],可以清除体内的O-2、HO·和H2O2等,起到增强机体免疫力和延缓衰老的作用。
目前已有文献研究不同干燥方法对金银花中某种活性成分的影响[6],但是对于不同干燥方法对金银花提取物的抗氧活性和总酚、总黄酮质量分数的影响研究很少。本实验采用操作简单、快捷灵敏的化学发光法[7],利用鲁米诺化学发光体系探讨了不同干燥方法对金银花的抗氧化活性以及其中的总酚和总黄酮的质量分数的影响,为金银花资源的进一步开发研究提供了理论依据。
1 仪器与材料
仪器:MPI-B型多参数化学发光分析测试系统(西安瑞迈分析仪器有限公司);722E型紫外可见分光光度计(上海光谱仪器有限公司);GZX-9140数显鼓风干燥箱(上海宏博实业有限公司);YZWZ-3型微波干燥箱3kW(南京研正微波设备厂);SB-5200D型超声波清洗机30 kHz(宁波新芝生物科技股份有限公司)。
金银花于2012年7月采于山东济南平阴基地。
试剂:0.1 mol/L Na2CO3-NaHCO3缓冲溶液,使用前新鲜配制,调节至pH=10.2;鲁米诺(Luminol)溶液,用pH=10.2,浓度为0.1 mol/L的Na2CO3-NaHCO3缓冲溶液配置成0.2 mmol/L,避光保存;邻苯三酚溶液,用1 mmol/L的HCl溶液配置成10mmol/L;FeSO4溶液,先用1mL的0.5 mol/L的H2SO4溶液将FeSO4晶体溶解,然后用水稀释至0.5 mmol/L;H2O2溶液,用水将H2O2配置为体积分数为0.6%和0.06%的溶液;抗坏血酸溶液,精确取抗坏血酸标准品2.48mg,用二次蒸馏水溶解配制成0.248mg/mL,然后用二次蒸馏水依次稀释为 0.0248、0.00496、0.00248、0.00124、0.000496、0.00031 mg/mL。本实验所用试剂均为分析纯,水为二次蒸馏水。
2 实验方法
2.1 金银花的干燥和提取
2.1.1 金银花的干燥
金银花采用3种不同的干燥方法做比较。(1)微波法:在微波干燥器中加入金银花鲜样100 g,设定微波功率3 kW,温度70℃,干燥时间10min,得到干基重22 g。(2)鼓风干燥法:在鼓风烘箱中加入金银花鲜样100 g,设定温度为40℃,干燥时间14 h,得到干基重22 g。(3)晾干法:将100 g金银花鲜样在自然条件下晾4 d,得到干基重22 g。
2.1.2 金银花的提取
取不同方法干燥的金银花样品,粉碎,过40目筛,各样品分别取1.0 g,以体积分数为50%的乙醇溶液按照料液比1:50(g/mL)超声提取30min,提取液过滤、离心后,用50%乙醇定容至50mL,得到不同干燥方法的金银花提取液。
2.2 金银花提取液化学成分的测定
2.2.1 总黄酮的测定
参照文献[8],采用NaNO2-Al(NO3)3-NaOH显色体系测定金银花提取液中总黄酮的质量分数。以试剂空白为参比,在510 nm处测定样品的吸光度值,得到的黄酮质量分数用相当于芦丁的毫克数来表示,测3次取平均值。得到线性回归方程:y=9.54278 ×10-4+0.01042x,R2=0.9996,芦丁质量分数在 0 ~10 μg/mL时与吸光度值呈良好的线性关系。
2.2.2 总酚的测定
参照文献[9],采用Folin酚法对金银花提取物中总酚质量分数进行测定。以试剂空白为参比,在765 nm处测定样品的吸光度值,得到的总酚质量分数以相当于没食子酸的毫克数来表示,测3次取平均值。得到回归方程:y=0.01166+0.11869x,R2=0.9992,没食子酸质量分数在0 ~74 μg/mL 时与吸光度值呈良好的线性关系。
2.3 金银花提取物抗氧化活性实验
采用鲁米诺-邻苯三酚化学发光体系[10],以体积分数7.5% 的乙醇溶液为空白。将3种不同干燥方法的金银花提取液配制成不同的浓度梯度(1%、3%、5%、10%、15%,乙醇体积分数均为7.5%),阳性对照组为抗坏血酸溶液配制成不同的浓度(0.0248、0.00496、0.00248、0.00124、0.000496、0.00031 mg/mL),打开反应池与光电倍增管的连接开关,将光电倍增管高压设置在800 V,在样品池中依次加入鲁米诺溶液4 mL、样品(或空白)溶液0.5 mL、邻苯三酚溶液0.4 mL,立即启动仪器,记录其在400 s内的发光积分强度。以空白的发光强度作为本底发光强度I0,以抗坏血酸溶液做阳性对照。以清除率为纵坐标,样品浓度为横坐标绘制曲线,计算清除率在50%时的浓度IC50,平行测定3次取平均值。
2.3.2 H2O2清除率的测定
采用鲁米诺-H2O2化学发光体系[11],以体积分数5%的乙醇溶液为空白。将3种不同干燥方法的金银花提取液配制成不同的浓度梯度(0.02%、0.05%、0.1%、0.3%、0.5%、1%、3%、5%、10%,乙醇体积分数均为5%),阳性对照为抗坏血酸溶液,浓度同2.3.1,打开反应池与光电倍增管的连接开关,将光电倍增管高压设置在600 V,在样品池中依次加入鲁米诺溶液4 mL、样品(或空白)溶液0.5 mL、H2O2溶液0.2 mL,立即启动仪器,记录其在200 s内的发光积分强度。以空白的发光强度作为本底发光强度I0,以抗坏血酸溶液做阳性对照,计算其IC50。平行测定3次取平均值。
2.3.3 HO·清除率的测定
采用鲁米诺-FeSO4-H2O2化学发光体系[12],以体积分数5%的乙醇溶液为空白。将3种不同干燥方法的金银花提取液配制成不同的浓度梯度(0.05%、0.1%、0.3%、0.5%、1%、3%、5%、10%,乙醇体积分数均为5%),阳性对照为抗坏血酸溶液,浓度同2.3.1,打开反应池与光电倍增管的连接开关,将光电倍增管高压设置在800 V,在样品池中依次加入鲁米诺溶液4 mL、样品(或空白)溶液0.5 mL、FeSO4溶液0.2 mL、H2O2溶液0.2 mL,立即启动仪器,记录其在400 s内的发光积分强度。以空白的发光强度作为本底发光强度I0,以抗坏血酸溶液做阳性对照,计算其IC50。平行测定3次取平均值。
2.4 数据统计与分析
实验所得数据,用Origin 6.0软件统计,计算所得曲线的积分面积为相对发光强度,计算清除率用如下公式:

其中I0表示不加样品时的空白发光强度,I表示加入金银花提取物样品时的发光强度。
所得清除率曲线,采用Origin 6.0软件进行Sigmoidal拟合,拟合公式为

其中y为清除率,x为提取物浓度,当y=50%时对应的x即为IC50。式中A1,A2,x0和p对应的值如表1所示。

表1 公式(2)参数数值Table 1 Parameter values of formula(2)
3 结果与讨论
3.1 不同干燥方法处理的金银花提取液中的总酚、总黄酮
不同干燥方法处理的金银花提取液中的总黄酮和总酚的质量分数如表2所示。其中在70℃微波干燥10min条件时,金银花提取液中的总酚和总黄酮质量分数最高,分别为30.40±2.75 mg/g和61.24±7.62 mg/g,而在自然阴干4 d的条件下,金银花提取液中的总酚和总黄酮的质量分数最低,分别为10.22±0.81 mg/g和17.50±2.28mg/g。由此可以得出,微波干燥的方法快捷且总酚、总黄酮质量分数最高。

表2 不同干燥方法处理的金银花提取物的IC50及其总酚总黄酮的质量分数Table 2 IC50and the content of total phnolic and total flavonoid of honeysuckle extracts by different drying methods
3.2 金银花提取物对O-2的清除作用
鲁米诺-邻苯三酚化学发光体系的原理[10]为:以鲁米诺为发光剂,邻苯三酚在碱性条件下自氧化产生的将鲁米诺过氧化,使产生的激发态中间产物返回到基态而产生化学发光,并且其发光强度与在一定强度范围内成线性关系。加入金银花提取物后,由于其含有丰富的黄酮类和多酚类化合物,其结构中含有酚羟基,可以提供活泼氢,从而阻断了该体系中自由基的反应,抑制了其化学发光。


3.3 金银花提取物对H2O2的清除作用
H2O2将化学发光剂鲁米诺过氧化,产生电子激发态中间产物,当其从激发态返回基态时,可集中释放光子,发出化学冷光[13],且其化学强度与H2O2的浓度在一定范围内呈线性关系。本实验中,加入金银花提取物后,由于其中含有丰富的黄酮类化合物和多酚类化合物,具有较强的还原性,阻断了该体系的反应,抑制了其化学发光。
图2显示,3种干燥方法处理的金银花对H2O2的清除率的IC50分别为微波<鼓风干燥<阴干,这与表2中的总酚和总黄酮的质量分数呈正相关。因此,可以得出微波干燥处理的金银花提取液的总酚和总黄酮的质量分数最高,去除H2O2的能力最强,清除H2O2的IC50相当于0.0019 mg/mL的抗坏血酸溶液。
3.4 金银花提取物对HO·的清除作用
由Fenton试剂中的Fe2+和H2O2反应生成羟基自由基,鲁米诺作为发光增效剂与HO·发生反应,发出化学冷光,并且其发光强度与HO·在一定强度范围内成线性关系。当加入金银花提取物之后,由于其中含有大量的黄酮和多酚,将Fe2+氧化为Fe3+,阻断了该体系的反应,抑制了其化学发光。
图3显示,3种干燥方法处理的金银花对HO·的清除率的IC50分别为微波<鼓风干燥<阴干,这与表2中的总酚和总黄酮的质量分数呈正相关。因此,微波干燥处理的金银花提取液的总酚和总黄酮的质量分数最高,其去除HO·的能力最强,清除HO·的IC50相当于0.0013 mg/mL的抗坏血酸溶液。
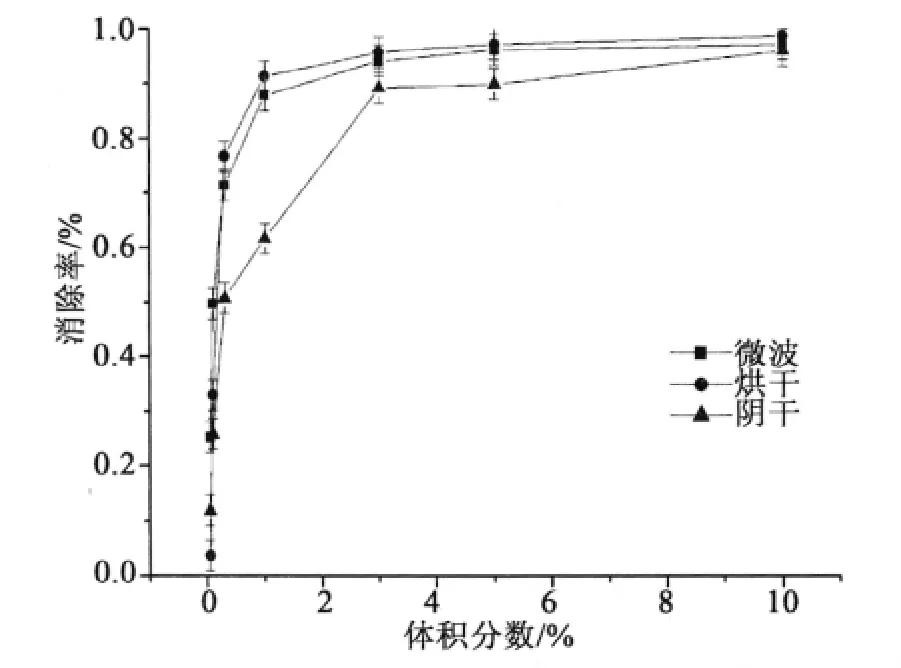
图3 不同干燥方法处理的金银花提取物的HO·的清除作用Fig.3 Scavenging activity of hydroxyl free radical of honeysuckle extracts by different drying methods
4 结论
金银花含有大量的酚类和黄酮类化合物,并且具有较强的抗氧化活性,且抗氧化活性与提取液的浓度呈正相关。不同干燥方法对金银花活性物质的质量分数和抗氧化活性有较大的影响,其中微波干燥的时间最短,总酚和总黄酮的质量分数最高,分别为30.40 ±2.75 mg/g、61.24 ±7.62 mg/g,并且抗氧化活性最强;鼓风干燥次之;而自然阴干的时间最长,总酚和总黄酮的质量分数最低,分别为10.22±0.81 mg/g、17.50±2.28mg/g,且抗氧化活性最弱。这表明,过长的干燥时间会导致活性物质的流失,不利于保持金银花的活性成分。
[1]国家药典委员会.中国药典2005年版一部金银花[M].北京:化学工业出版社,2005:152-153.
[2]中国科学院中国植物志编辑委员会.中国植物志:第72卷[M].北京:科学技术出版社,1988:143.
[3]马彦芳.金银花抗氧化作用的研究[J].安徽农业科学,2007,35(11):3241-3242.
[4]雷玲,李兴平,邓文龙,等.金银花抗内毒素、解热、抗炎作用研究[J].中药药理与临床,2012,28(1):115-117.
[5]罗磊,郭晓园.金银花提取液抗氧化活性研究[J].食品科学,2009,30(21):63-65.
[6]齐红,盛华刚,张超.不同干燥技术对金银花质量的影响[J].中国药业,2010,19(14):36-37.
[7]汪敬武,王建国.化学放光法比较5种抗氧化剂的活性[J].分析试验室,2008,27(s1):40-43.
[8]侯冬岩,回瑞华,杨梅,等.金银花种总黄酮的光谱分析及抗氧化性能测定[J].分析试验室,2004,23(11):52-55.
[9]郭兴峰,傅茂润,杜金华,等.不同干燥方法对荷花花瓣抗氧化活性和化学成分的影响[J].食品与发酵工业,2010,36(2):146-149.
[11]王园园,余伯阳,李星,等.灰色链霉素对芦丁的生物转化及产物的抗氧化性[J].中国天然产物,2006,4(1):66-68.
[12]上官小东,郎惠云.H2O2-Luminol流动注射抑制化学发光法测定银杏黄酮[J].分析试验室,2004,23(11):10-13.
[13]蔡卓,张娴,李园,等.Fenton-亚甲基蓝化学发光体系测定保健品对羟基自由基的清除率[J].光谱试验室,2011,28(2):583-586.
[14]WILCLES P D.Paraoxon and aldicarb pesticides[J].Analytical Chemistry,1973,294:35 -42.
