茜素黄R-γ-环糊精包合物与鲱鱼精DNA的作用机制*
2013-04-23欧亮龙王兴明
欧亮龙, 王兴明
(西南科技大学材料科学与工程学院化学系,四川 绵阳 621010)
小分子化合物与DNA之间相互作用的研究,将有助于人们从分子水平上了解生命现象的本质,了解生命过程中这种相互作用对生命活动的影响以及对生命体内的调节和控制作用,认识某些分子对DNA生理、物理化学性质的影响以及对DNA转移、复制的改变,基因调控和表达功能的影响等[1-3]。
茜素黄R(英文名为Alizarin Yellow R, 简称AYR)作为一种小分子染料可用作生物探针来了解和揭示蛋白质的结构和功能,以及阐明小分子与蛋白质分子之间的作用过程,具有重要的理论价值和潜在的实用价值[4]。
本文在在生理pH=7.4环境下,用紫外光谱法、荧光光谱法等研究了包合物γ-CD-AYR与鲱鱼精DNA(hsDNA)的作用,分析了两者的作用机制。
1 实验部分
1.1 试剂与仪器
γ-环糊精(γ-CD,A.R,成都科龙化工试剂厂);茜素黄R(Alizarin Yellow R ),成都科龙化工试剂厂) ;吖啶橙 (AO ) (A R,中国医药(集团)上海化学试剂公司);鲱鱼精DNA(hsDNA)(上海海洋生物技术有限公司);Tris(0.25 mol/L)-HCl缓冲液(pH=7.4)临时配制;水为二次重蒸水,其它试剂均为分析纯。
UNICO UV-2102 PCS型紫外可见分光光度计(尤尼科上海仪器有限公司);F96-荧光分光光度计(上海分析仪器公司);Nicolet 380智能傅里叶变换红外光谱仪(美国热电尼高力公司);D/max-RB X射线衍射仪(日本理学公司);pHS-3B型酸度计(成都方舟科技开发公司),AL204型电子分析天平(上海梅勒特-托利多仪器),HH-601超级恒温水浴(金坛金南仪器厂),PHG-9075A电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司);乌贝路德黏度计。
1.2 实验方法
1.2.1 紫外光谱法
以Tris-HCl缓冲溶液(pH 7.4)为研究介质,配制好待测溶液,静置5 min。在1 cm比色皿中加入3.00 mL AYR溶液,以Tris-HCl缓冲溶液为参比扣除空白,采用滴定法,滴定时每次加入体积为10 μL 的γ-CD溶液,共150 μL,扫描吸收光谱,计算出γ-CD与AYR反应摩尔比。
以Tris-HCl缓冲溶液(pH 7.4)为研究介质,配制好待测溶液,静置5 min。在1 cm比色皿中加入3.00 mL γ-CD-AYR溶液,以Tris-HCl缓冲溶液为参比扣除空白,采用滴定法,滴定时每次加入体积为10 μL 的DNA溶液,共200 μL,扫描吸收光谱,计算出γ-CD-AYR包合物与DNA反应摩尔比。
以Tris-HCl缓冲溶液(pH 7.4)为研究介质,配制好待测溶液,静置5 min。在1 cm比色皿中加入3.00 mLγ-CD-AYR溶液,以Tris-HCl缓冲溶液为参比扣除空白,采用滴定法,滴定时每次加入体积为10 μL的Na2HPO4溶液,共150 μL,扫描吸收光谱,以观察磷酸盐对γ-CD-AYR包合物的影响。
按照γ-CD-AYR包合物与DNA反应摩尔比方法中的步骤配制溶液,在1 cm比色皿中加入3.00 mL γ-CD-AYR溶液,分别在15oC和37oC条件下扫描紫外吸收光谱,用双倒数法进行计算。
1.2.2 荧光光谱法
1)荧光探针。各种溶液均用pH=7.40的Tris-HCl缓冲溶液配制,摇匀,放置5 min。在1 cm比色皿中加入3.00 mL AO-DNA溶液,以Tris-HCl缓冲溶液空白为参比,用γ-CD-AYR溶液进行滴定,滴定时每次加入体积为10 μL溶液,共150 μL,充分搅拌,使γ-CD-AYR和AO-DNA的浓度比值不断增加,扫描发射光谱。
2)Sctchard方法。分别用Tris-HCl缓冲溶液配制浓度比cγ-CD-AYR∶cDNA=0∶1、0.4∶1、0.8∶1、1.2∶1的四组溶液,再按照以上比例用含有0.5 gNaCl-100 mL的缓存溶液配制四组。在1 cm比色皿中加入3.00 mL 每组溶液,采用滴定法,滴定时每次加入体积为10 μL 的AO溶液,共200 μL,扫描吸收光谱。激发和发射光谱扫描狭缝宽度均为5 nm,荧光激发波长λex=411.7 nm。
1.2.3 黏度法 用Tris-HCl缓冲溶液配制DNA和γ-CD-AYR包合物溶液,在298.15 K恒温水浴槽中用乌贝路德黏度计测其黏度。
2 结果与讨论
2.1 紫外-可见光谱法
2.1.1 γ-CD与AYR反应紫外吸收光谱及其包合摩尔比 环糊精具有中空环状的特殊构造,可以通过范德华力等将填充进环中的客体分子络合成单分子包合物。因此环糊精与其他分子的包合属于典型的主-客体分子识别过程(即指主体对客体选择性结合并产生某种特定功效的过程)[5]。
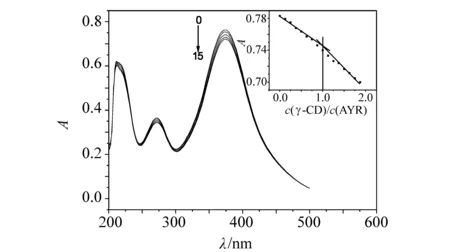
图1 γ-CD对AYR紫外吸收光谱的影响(376nm)Fig.1 Influence of γ-CD on UV-vis absorption spectra of Alizarin yellow R (pH7.40)cAYR= 4.00×10-5 mol/L; cγ-CD= 1.50×10-3 mol/L
由图1可知,固定AYR的浓度,逐渐加入γ-CD,AYR的吸收峰逐渐降低,表明AYR客体所在的化学微环境随着主体γ-CD 的加入而发生了变化,即由极性环境进入到γ-CD疏水空腔的非极性环境而形成了包合物,在包合过程中存在着能量的转移。
固定AYR的浓度,改变γ-CD的浓度,在376 nm处测定吸光度,结果如图1所示。即实验测得γ-CD与AYR的包合摩尔比[6]nγ-CD∶nAYR= 1∶ 1。根据Beer定律[7]∶A=εbc(A为γ-CD-AYR的吸光度;ε为γ-CD-AYR的摩尔吸光系数;c为γ-CD-AYR浓度;b为比色皿厚度)。计算得到γ-CD-AYR的表观摩尔吸光系数ε=1.85×104L/(mol·cm)。
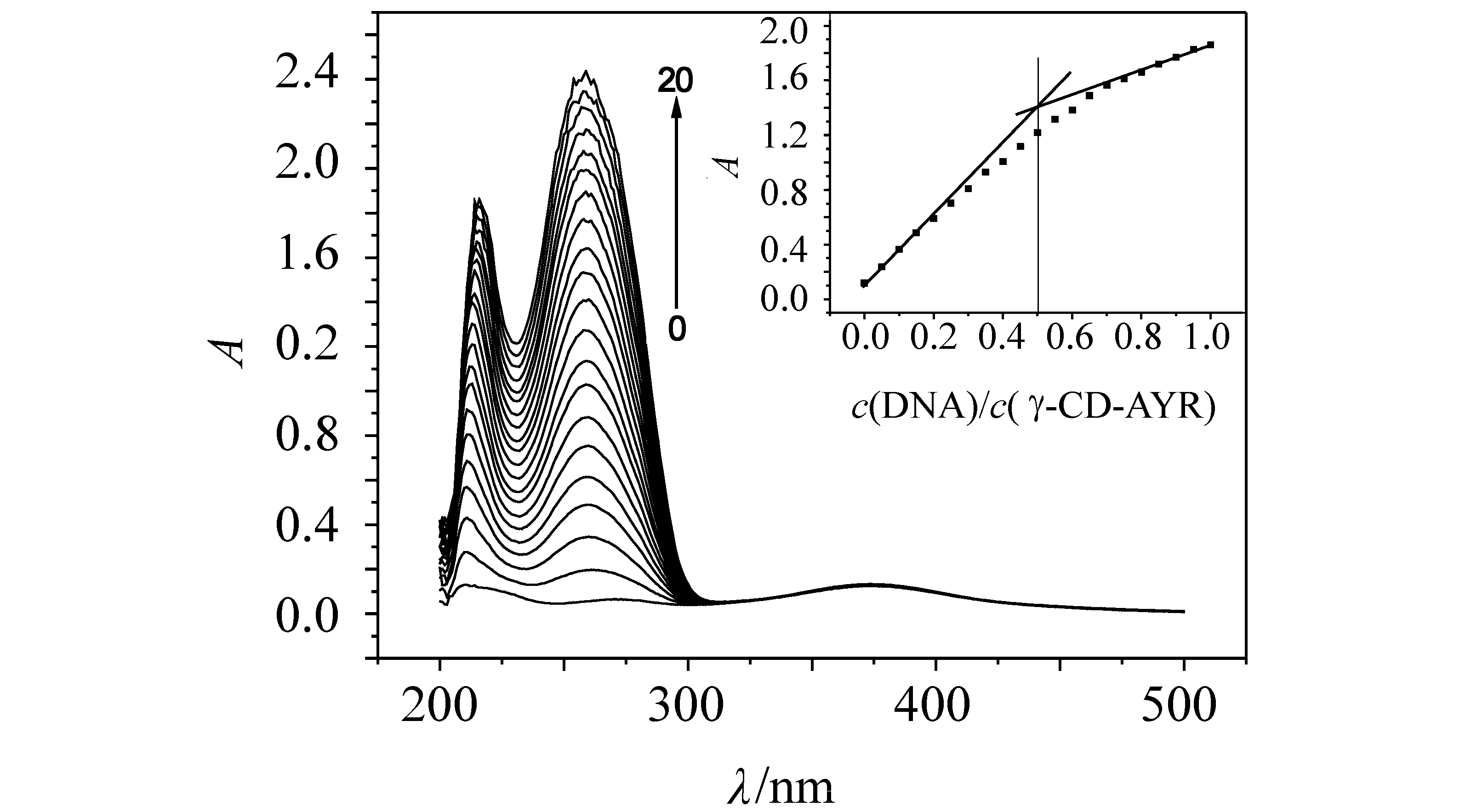
图2 DNA对γ-CD-AYR影响的紫外吸收光谱Fig .2 Influence of DNA to UV-vis absorption spectra of γ-CD-AYR (pH7.40) cγ-CD-AYR= 8.00×10-6 mol/L; cDNA= 1.20×10-4 mol/L (10μL per scan,0~20∶0~200μL)
2.1.2 γ-CD -AYR包合物与DNA作用紫外吸收光谱及其反应摩尔比 由图2可知,固定γ-CD -AYR的浓度,随着DNA浓度增加,体系的吸光度呈有规律增强,表明γ-CD -AYR与DNA分子之间发生了明显地相互作用。在216 nm处测定其吸光度,用摩尔比法得到DNA与γ-CD -AYR的结合比[8]nDNA∶nγ-CD-AYR= 1∶ 2。
2.1.3 双倒数法测定γ-CD-AYR与DNA的结合常数 Cramer最早发现环糊精能影响有机分子的UV-vis光谱,并提出这种光谱变化是环糊精空腔内的高电子密度诱导客体分子电子发生移动的结果。根据图2中216 nm处的数据以1/ΔA为纵坐标,1/cDNA为横坐标作图,如图3所示,根据双倒数公式
1/(A-A0)=1/A0+1/(K×A0×cDNA)
(1)
计算得到结合常数K288.15 K=3.10×104L/mol,K310.15 K=4.02×104L/mol。
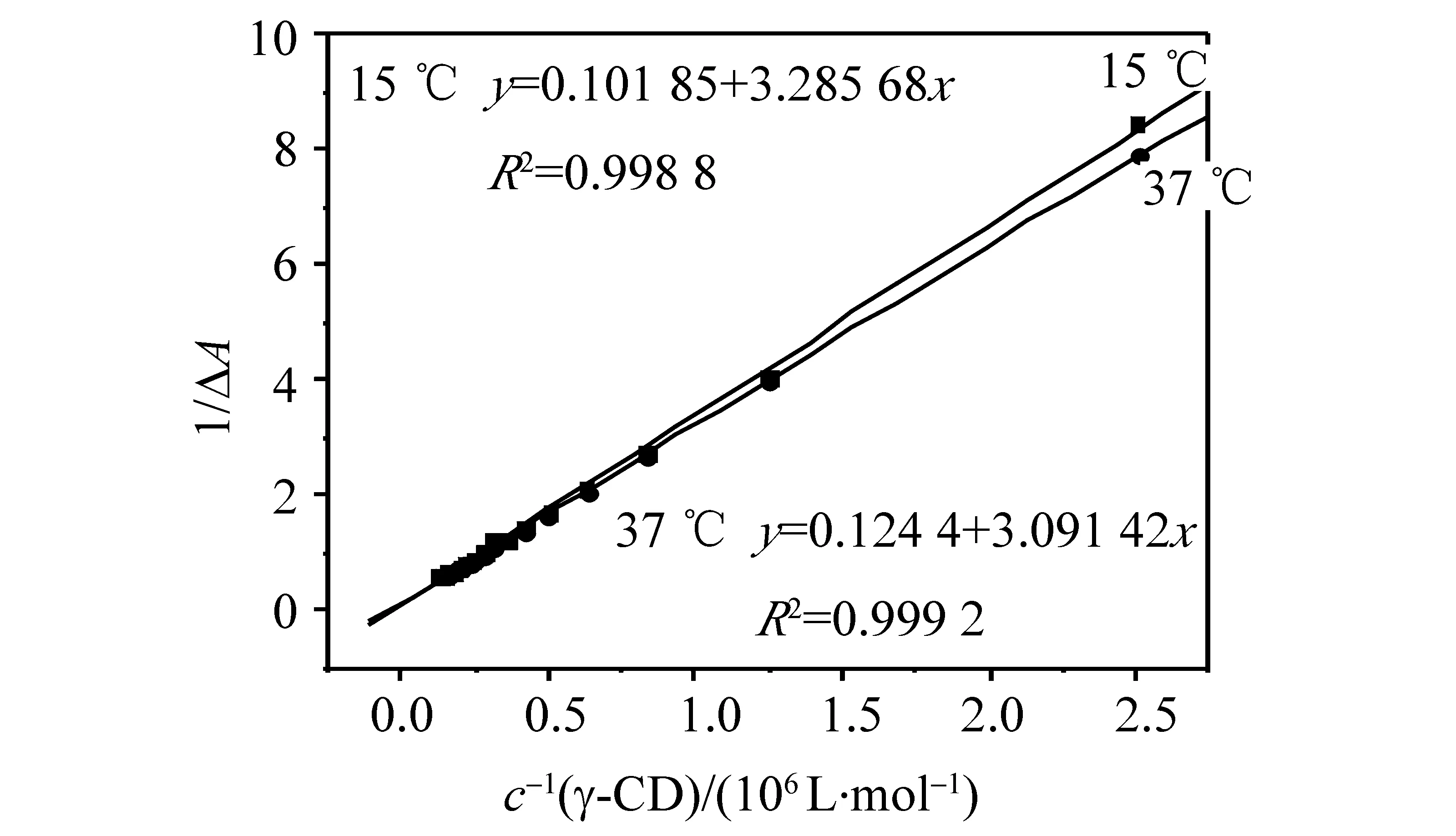
图3 双倒数法Fig.3 Double reciprocal method
再联用公式(2)、(3)、(4)
lnK2Ө/K1Ө=-ΔrHmӨ(1/T2-1/T1)/R
(2)
ΔrGmӨ=-RTlnKӨ
(3)
ΔrGmӨ=ΔrHmӨ-TΔrSmӨ
(4)
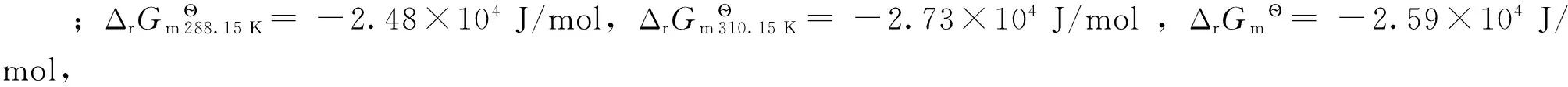
2.2 荧光光谱
2.2.1 γ-CD-AYR对AO-DNA荧光光谱的影响 吖啶橙(AO)是一种碱性染料,具有低毒等优点,广泛用于光谱学研究。AO能嵌插于 DNA 的碱基对之间,使荧光强度增加[9],因此AO可以作为荧光探针研究γ-CD-AYR包合物与DNA的作用方式。
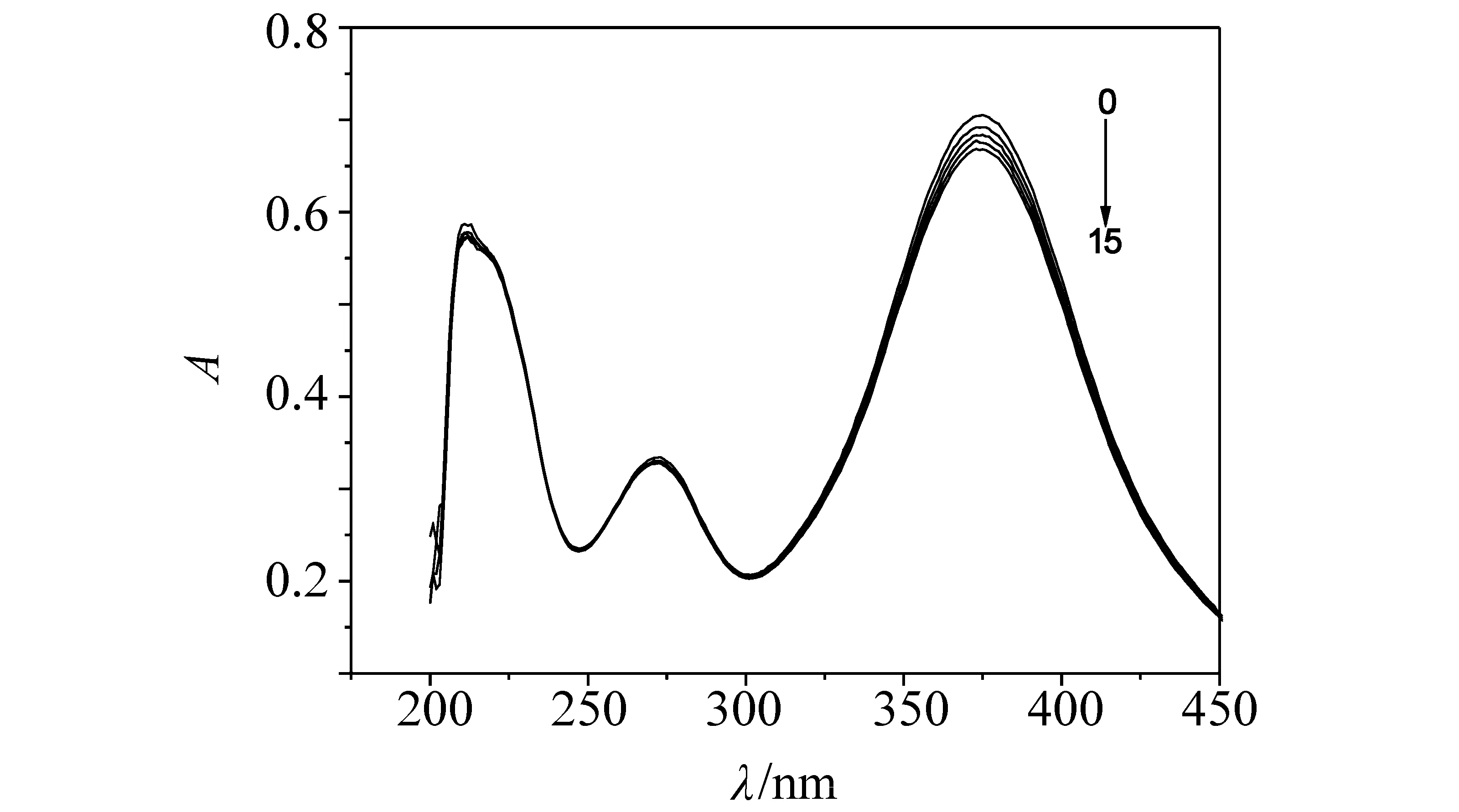
图4 磷酸盐对γ-CD-AYR影响的紫外吸收光谱Fig. 4 Influence of phosphate to UV-vis absorption spectra of γ-CD-AYR (pH 7.40)cγ-CD-AYR= 4.00×10-5 mol/L; cNa2HPO4= 1.00×10-3 mol/L
向一定浓度的AO-DNA配合物溶液中逐步加γ-CD-AYR包合物,溶液的荧光强度逐渐减少,但相对减少程度逐渐降低,当γ-CD-AYR加入浓度一定时,溶液的荧光强度下降趋于稳定,如图5所示。说明γ-CD-AYR包合物与AO形成了竞争,γ-CD-AYR将嵌插在DNA碱基对中的AO置换了出来。说明在本实验条件下, DNA与γ- CD-AYR包合物之间存在嵌插作用。这可能是因为γ-CD-AYR包合物中AYR的共轭 ,能够插入到DNA双螺旋碱基对中经π-π堆积作用而稳定[10]。
2.2.2 Scatchard法 以AO为研究γ-CD-AYR与DNA作用方式的荧光探针,由于AO能够嵌入到
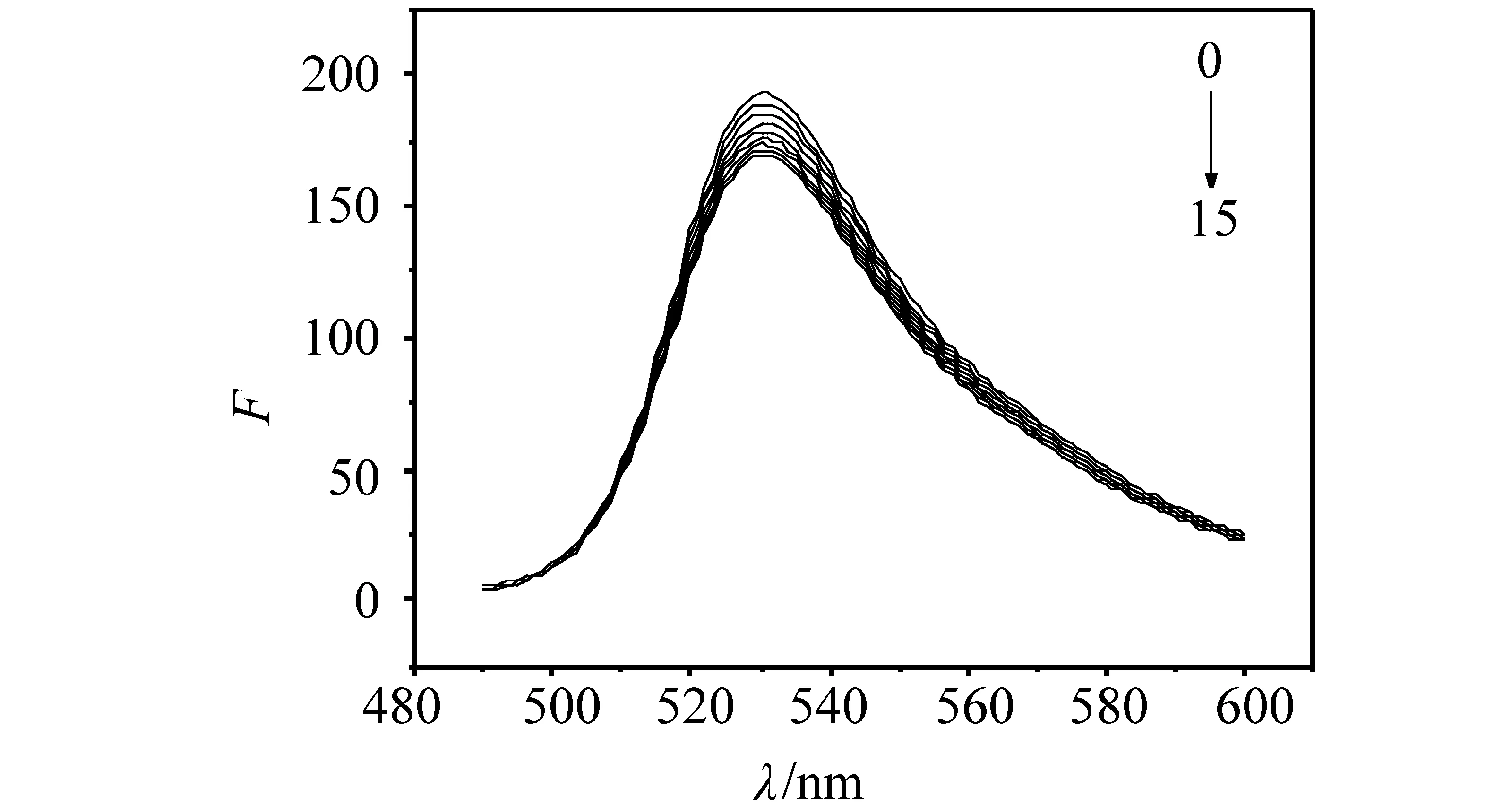
图5 γ- CD-AYR对AO-DNA荧光光谱的影响Fig.5 Flourescence spectra curve of γ- CD-AYR to AO-DNA (pH7.40)CAO-DNA= 2.00×10-5 mol/L; cγ- CD-AYR= 4.00×10-5 mol/L
DNA双螺旋链的碱基对之间,使荧光强度增加。在γ-CD-AYR-DNA体系中滴加AO,引起荧光强度的变化,因此利用AO存在下γ-CD-AYR与DNA作用的Scatchard图可判别包合物与DNA的作用方式。通过对溶液中有和无NaCl两组实验进行对照研究,AO与DNA作用的特点可用Scatchard方程阐述[11]
r/c=K(n-r)
(5)
式中,r为每个核苷酸结合AO的分子个数,c为AO游离浓度,n为r最大值,K为单个位点固有的结合常数。以r/c对r作图,得到一条直线。在存在与不存在包合物γ-CD-AYR的条件下,Scatchard图有相同的n值,则该物质与DNA为嵌插作用方式;若Scatchard图有相同的K值,则该物质与DNA的作用为非嵌插方式;若Scatchard图的K和n均不同,则该物质与DNA的作用为混合方式。
两组对照实验K值和n值的变化(见表1),结合图表明:有NaCl时的n值基本比没有NaCl时的小,说明有静电作用[9]。
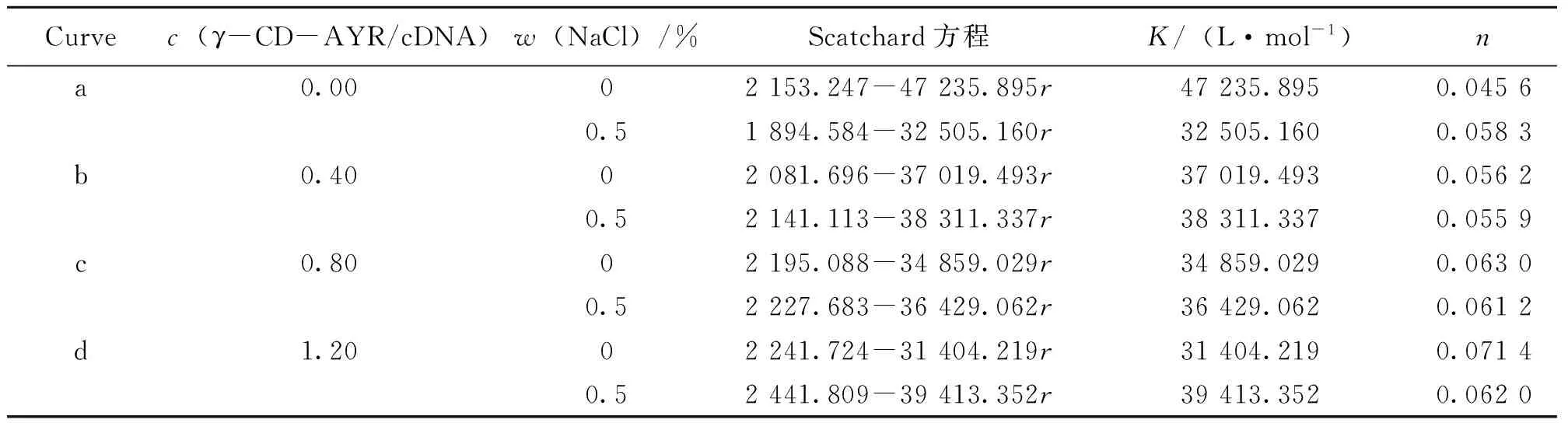
表1 γ-CD-AYR与鲱鱼精DNA相互作用的Scatchard方程 Table 1 Scatchard equation of the interaction between γ-CD-AYR and hsDNA
2.3 黏度法
黏度法是一种对 DNA 长度变化敏感的流体力学方法。一般来讲,当小分子包合物以插入模式与 DNA作用时,DNA 的相邻碱基对的距离会变大以容纳插入配体,因而导致 DNA 双螺旋伸长,DNA 溶液的黏度增加;当包合物以静电或沟面结合等非插入模式与DNA 作用时,DNA 溶液的黏度无明显变化;而以部分插入方式与 DNA 作用时,则可能使 DNA 的双螺旋扭结,使其黏度减小[12]。相对黏度公式η= (t-t0)/t0中,t0为单独DNA溶液流经毛细管所需时间,t为含浓度不等的包合物的DNA溶液流经毛细管所需的时间计算。η0和η为加入包合物前后 DNA 溶液的相对黏度,以(η/η0)1/3对cγ- CD-AYR作图,可得包合物对DNA黏度的影响图。γ-CD-AYR对DNA 黏度的影响如图6所示,可见,由于γ-CD的包合作用阻碍了AYR的插入,使γ-CD-AYR与DNA只有部分插入作用,因此,表现出黏度减小的现象。
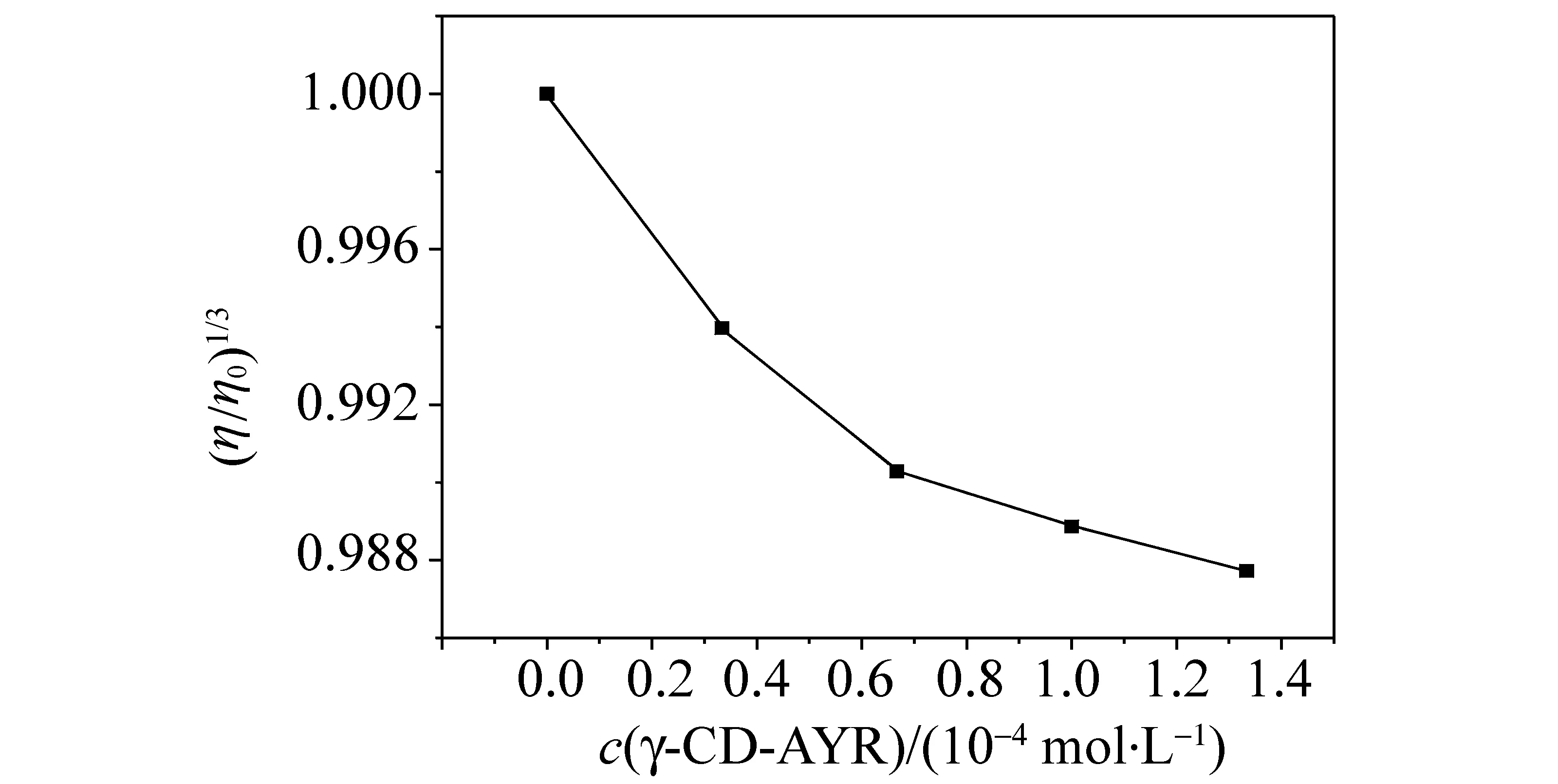
图6 γ- CD-AYR包合物对DNA黏度的影响Fig.6 Effect of viscosity on γ-CD-AYR on DNA cDNA= 1.00×10-4mol/L(分别在10 mL 比色管中加入1 mL); cγ-CD-AYR=5×10-5 mol/L
3 结 论
1)通过摩尔比发得到茜素黄R与γ-环糊精以摩尔比为1∶1形成包合物。
2)由热力学测算得到函数K288.15 K=3.10×104L/mol,K310.15 K=4.02×104L/mol,ΔrHmӨ=8.78×103J/mol,ΔrGmӨ= -2.59×104J/mol,ΔrSmӨ=116.45 J/(mol·K) ,说明γ-CD-AYR包合物与鲱鱼精DNA的相互作用为吸热反应,可自发进行,并为熵驱动。
3)通过使用荧光光谱、紫外光谱等多种方法的研究结果表明,该包合物γ-CD-AYR与鲱鱼精DNA之间的作用方式是静电作用和嵌插作用。由于γ-CD通过疏水作用对茜素黄R的包合,使得γ-CD-AYR包合物中只有处于γ-CD圆筒外的AYR分子的端基部分与DNA才有插入作用,故为部分嵌插。
参考文献:
[1] STROHSAHL C M, KRAUSS T D, MILLER BL. Identification of high-stringency DNA hairpin probes by partial gene folding [J]. Biosens Bioelectron, 2007, 23:233-240.
[2] MOHAMMAD H B, SAIED S H, ALI M. Study of interactions between DNA and aatoxin B1 using electrochemical anduorescence methods [J]. Analytical Biochemistry,2011, 411: 218-222.
[3] NEBRO A J, LUQUE G, LULLA F, et al. DNA fragment assembly using agrid-based Genetic algorithm [J]. Comput Operat Res, 2008, 35:2776-2790.
[4] 胡亚敏, 蒋琪英, 张欢, 等. 碱性介质中茜素黄R与牛血清蛋白相互作用研究[J]. 西南科技大学学报, 2007, 22(3):14-19.
[5] 鞠煜先.电分析化学与生物传感技术[M].北京:科学出版社,2006:344-347.
[6] 杨昌英, 刘义, 曾芳, 等.两种荧光探针法研究三种非甾体抗炎药与DNA的相互作用[J]. 化学学报, 2007, 65(18):2076-2080.
[7] 席小莉, 杨曼曼, 杨频. 表柔比星-铜体系与DNA作用的光谱和电化学法研究[J]. 化学学报,2008, 66(10):1181-1186.
[8] 叶宝芬, 朱永林, 鞠熀先. DNA与苯胺红T的相互作用与荧光定量检测[J]. 高等学校化学学报,2002, 23(12):2253-2255.
[9] 王兴明, 黎泓波, 胡亚敏, 等. 苏木素与DNA相互作用的光谱研究[ J ]. 化学学报, 2007, 65(2): 140-146.
[10] XU D L, WANG X M, DING L S. Spectroscopic studies on the interaction of γ-cyclodextrin- daunorubicin inclusion complex with herring sperm DNA[J]. Carbohydrate Polymers, 2011,83:1257-1262.
[11] LEPECQ J B, PAOLETTI C J. A fluorescent complex between ethidium bromide and nucleic acids[J]. J Mol Biol, 1967, 27:87-106.
[12] 张黔玲, 刘剑洪, 任祥忠, 等. 新型双核配合物的形成及荧光性质研究[J]. 高等学校化学学报, 2006, 27(10):1805-1810.
