腹腔镜辅助手术与传统开腹手术治疗局部进展期胃窦癌临床疗效的对比研究
2013-04-20王海江
方 法,王海江
对于胃癌的治疗,外科手术具有其他治疗方式不可比拟的临床疗效。1997年,Goh等[1]首次采用腹腔镜胃癌D2根治术治疗进展期胃癌,其带来的微创理念对传统开腹手术产生了极大的冲击,但其安全性、可行性及患者预后一直是人们争论的焦点。本研究选取我院胃肠外科近年收治的111例局部进展期胃窦癌患者,按照患者手术意愿及手术方式分为腹腔镜组和开腹组,对比两组患者的手术情况、并发症及累积生存率等,旨在探讨腹腔镜辅助手术治疗局部进展期胃窦癌的临床疗效,为临床工作提供参考。
1 资料与方法
1.1一般资料我院胃肠外科2009年1月—2010年12月收治的局部进展期胃窦癌患者共111例,其中男52例,女59例;年龄31~75岁;汉族97例,少数民族14例。按照患者手术意愿及手术方式分为腹腔镜组50例和开腹组61例。本研究在患者术前经医院伦理委员会审核批准,患者签署伦理同意书及手术知情同意书。两组患者性别、年龄、民族、肿瘤大小、有无术前合并症、手式方式、病理类型及肿瘤大体类型比较,差异无统计学意义(P>0.05,见表1),具有可比性。
1.2纳入与排除标准纳入标准:(1)经术前病理检查明确诊断为腺癌,并通过体检、胸部X线、胸腹盆腔CT、肿瘤相关抗原系列检查等确定双肺、肝脏、骨骼、腹腔无种植转移;(2)全身重要脏器无严重功能障碍,能耐受手术;(3)术前肿瘤临床T分期为T2~T3。排除标准:(1)多原发胃癌;(2)术中探查有远处转移;(3)幽门梗阻需急诊手术;(4)腹腔镜技术受限者纳入开腹组。
1.3手术方法两组患者的手术均由同一组手术医师完成。开腹组采用传统开腹手术,上腹正中绕脐切口,按传统方式行D2根治术。腹腔镜组采用腹腔镜辅助手术,常规5孔法操作,建立气腹,压力12~14 mm Hg(1 mm Hg=0.133 kPa),置入10 mm Trocar放置腹腔镜。术中遵循:(1)均行D2根治术;(2)肿瘤及周围组织整块切除;(3)无瘤原则。为预防腹腔和腹壁切口种植,同时采取以下措施:(1)勿直接钳夹肿瘤;(2)标本从切口保护圈中取出;(3)标本取出后0.9%氯化钠溶液冲洗腹腔和切口,并在腹腔内洒入氟尿嘧啶植入剂,移走保护圈后再次冲洗切口,先解除气腹后拔取套管。腹腔镜组镜下用超声刀和电刀分离横结肠系膜前叶(见图1),处理胃周血管(见图2),进行淋巴结清扫(见图3)[2]。

表1 两组患者一般资料比较
注:*为t值

图1游离胃结肠韧带图2游离胃网膜右血管图3清扫12a组淋巴结
Figure1Free gastrocolic ligamentFigure2Free gastroepiploic right vascularFigure3Cleaning lymph nodes of 12a
1.4观察指标(1)手术情况:包括手术时间、术中出血量、肿块距远切端距离、切口长度、淋巴结清扫数目、肠道功能恢复时间、术后住院时间等;(2)并发症:包括切口脂肪液化、肺部感染、吻合口狭窄、尿路感染、胃排空障碍等;(3)术后1、3年累积生存率及平均生存时间等,部分随访时间未满3年患者按照不完全数据进行处理。
1.5随访所有患者术后6个月内每个月复查胸部X线、腹腔B超及肿瘤相关抗原,每4~6个月行电子纤维胃镜及CT检查。截至2012年4月底,6例患者失访,随访率为94.6%,中位随访时间为27.9个月。失访患者按最后1次随访资料进行统计,完全失访或非肿瘤死亡患者按统计分析要求列为截尾数据进行处理。
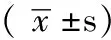
2 结果
2.1手术情况腹腔镜组46例患者完成根治手术,4例患者因既往行胆囊切除术、肝门部粘连较严重、12a组淋巴结清扫困难而中转开腹,但该4例患者腹腔镜下已完成除12a组淋巴结清扫以外其他手术操作,其数据仍归为腹腔镜组;开腹组61例患者均完成根治手术。围术期腹腔镜组有1例(2.0%)患者输血,开腹组有9例(14.8%),腹腔镜组输血率低于开腹组,差异有统计学意义(χ2=5.453,P=0.022)。腹腔组手术时间长于开腹组,术中失血量及切口长度小于开腹组,肠道功能恢复时间及术后住院时间短于开腹组,差异均有统计学意义(P<0.05);而两组肿块距远切端距离、清除淋巴结数目比较,差异均无统计学意义(P>0.05,见表2)。
2.2并发症腹腔镜组术后出现切口脂肪液化1例、肺部感染1例、吻合口狭窄1例、尿路感染1例、皮下气肿1例;开腹组出现切口脂肪液化7例、胃排空障碍2例、肺部感染2例、尿路感染2例、腹腔内出血1例、小肠梗阻1例、腹腔感染1例、淋巴漏1例。腹腔镜组并发症发生率(10.0%,5/50)低于开腹组(27.9%,17/61),差异有统计学意义(χ2=5.521,P=0.030)。

表2 两组患者手术情况比较
注:*为U值
2.31、3年累积生存率及平均生存时间腹腔镜组1年累积生存率为78.0%,开腹组为81.8%,差异无统计学意义(P>0.05);腹腔镜组3年累积生存率52.5%,开腹组为53.0%,差异亦无统计学意义(P>0.05)。腹腔镜组平均生存时间为(28.2±1.4)个月,开腹组为(28.5±1.2)个月,差异无统计学意义(P>0.05,见图4)。

图4 两组患者的生存曲线(Kaplan-Meier法)
3 讨论
由于胃供应血管丰富、解剖层面多、淋巴转移途径复杂、吻合技术难度大等原因,使得微创外科在胃癌手术中的应用受到了限制,目前对于腹腔镜辅助手术治疗的安全性和可行性仍缺乏大量的随机对照试验研究。1991年,Kitano等[3]完成了首例腹腔镜胃癌根治术,使得腹腔镜胃癌根治术成为现实;2002年,Kitano等[4]再次报道对 116 例早期胃癌患者进行了腹腔镜辅助下胃癌根治术,45个月的术后随访结果显示,患者无肿瘤复发或穿刺孔癌细胞种植转移。本研究结果显示,腹腔镜组与开腹组的肿块距远切端距离、淋巴结清扫数目无差异,表明腹腔镜辅助手术治疗局部进展期胃窦癌可达到与传统开腹手术相同的临床疗效,与文献报道一致[5-8]。
手术时间是评判一种新术式的一项重要指标。Tokunaga等[9]研究报道,即使经过专业的腹腔镜胃癌手术培训,腹腔镜辅助手术时间仍较开腹手术时间长。本研究结果显示,腹腔镜组手术时间长于开腹组,分析其原因主要有以下几个方面:(1)相对于传统开腹手术,腹腔镜手术操作难度更高,术区暴露相对困难,加之应用初期操作配合度较低,手术时间延长在所难免;(2)腹腔镜技术存在学习曲线[10-11];(3)部分患者因既往有腹部手术史,腹腔部分组织粘连导致操作难度进一步加大,使手术操作时间延长。目前,腹腔镜辅助手术治疗进展期胃窦癌仍处于手术模仿期和认识解剖平面阶段,相信随着操作技术的不断成熟以及腹腔镜手术经验的不断积累,等达到血管解剖认识期阶段时,相应的手术时间可以更接近传统开腹手术时间或更短。
超声刀技术的引进使腹腔镜手术中的出血量及组织分离难度下降,且与电刀相比,术中产生烟和碳更少[12-13];超声刀的正确使用能够减少手术对机体的副损伤,缩短患者术后恢复时间[14-18],而超声刀能否正确使用直接影响了其止血效果,切割时血管未完全凝固切断或在血管较多处仅夹住部分血管切断均可引起出血。目前,临床上使用较多的清洁方法为吸引器清洁视野,超声刀夹持出血点,慢速档凝固止血。Varela等[19]研究表明,腹腔镜组术中平均出血量明显低于开腹组(138 ml与357 ml),本研究结果显示,腹腔镜组术中失血量及切口长度小于开腹组,肠道功能恢复时间及术后住院时间短于开腹组,术后并发症发生率低于开腹组,具有明显优势,与文献报道结果相似[20-21]。
切口和腹腔癌细胞种植转移直接影响患者的预后,而CO2气腹压力大小是否引起脱落的癌细胞种植尚存争议。本研究随访中发现,腹腔镜组有1例患者短期内发生腹腔种植转移,分析可能与以下因素有关:(1)脱落癌细胞的直接种植;(2)Trocar切口损伤以及CO2沿Trocar的泄漏;(3)癌细胞的雾化状态;(4)人工气腹对细胞免疫的影响[22-25]。同时,当癌细胞达到一定数量后,会通过持续性CO2气腹的压力差从收集孔隙中逃逸,部分癌细胞会黏附于切口或切口周缘,从而造成切口种植,即“烟囱效应”[26]。因此,腹腔镜辅助手术应严格遵守无瘤原则,秉承无瘤技术的应用,取出标本时合理使用保护圈保护切口,采用蒸馏水浸泡或冲洗腹腔及切口,腹腔内局部使用氟尿嘧啶植入剂杀灭残存癌细胞,最终达到减少癌细胞种植风险的目的。
中转开腹是腹腔镜辅助手术常见的问题之一,如何降低中转开腹率一直是微创外科努力的方向。Dulucq等[27]报道,8例腹腔镜下全胃切除和11例腹腔镜下胃大部切除患者无一例中转开腹;Pugliese等[28]报道,48例腹腔镜全胃和胃大部切除患者仅1例因肿瘤巨大而中转开腹;Shimizu等[29]报道,100例腹腔镜胃癌患者有8例中转开腹,中转开腹率为8%。本研究腹腔镜组共有4例患者中转开腹,其中3例出现术后并发症,究其原因虽然与患者既往手术史有关,但器械操作熟练程度及操作者的经验欠缺也不容忽视,如操作者未能对中转开腹指征有效掌控,手术耗时必然增加,影响患者术后恢复。在实际工作中,当腹腔镜下发现以下情况时则需中转开腹:(1)肿瘤体积过大,侵犯周围组织严重;(2)肿瘤或肿大淋巴结包绕胃周重要血管主干;(3)正常解剖间隙丧失;(4)患者肥胖,腹腔组织广泛粘连;(5)疑有其他脏器转移,腹腔镜不能触诊,易遗漏病变;(6)术中大出血、医源性损伤等。
累积生存率是判断恶性肿瘤治疗效果的重要指标。日本的一项多中心非随机对照研究表明,1 294例腹腔镜下早期胃癌切除术患者的术中死亡率是0,术后Ⅰa期、Ⅰb期、Ⅱ期患者分别占93.7%、5.8%、0.5%;中位随访时间为36个月,只有0.6%的患者复发,Ⅰa期、Ⅰb期、Ⅱ期患者5年无病生存率分别为99.8%、98.7%、85.7%;腹腔镜辅助胃癌根治术的远期疗效较传统开腹胃癌根治术具有明显的优势[30]。本研究结果显示,腹腔镜组1、3年累积生存率及平均生存时间与开腹组相比均无差异。腹腔镜术前严格把握患者手术适应证、术中规范操作,腹腔镜辅助手术可取得与传统开腹手术相近的术后生存时间,与文献报道一致[30]。
综上所述,腹腔镜辅助手术治疗局部进展期胃窦癌可达到与传统开腹手术相同的临床疗效,并有助于缩短切口长度及术后恢复时间,减少术中出血量,降低并发症发生率,具有明显的微创优势。但由于本研究样本量较小、随访时间较短,未能得到腹腔镜辅助手术治疗局部进展期胃窦癌的远期临床疗效。相信随着腹腔镜手术技术的不断成熟,腹腔镜辅助手术治疗局部进展期胃窦癌一定会具有更广阔的发展前景。
1Goh PM,Khan AZ,So JB,et al.Early experience with laparoscopic radical gastrectomy for advanced gastric cancer[J].Surg Laparosc Endosc Percutan Tech,2001,11(2):83-87.
2Bouras G,Lee SW,Nomura E,et al.Comparative analysis of station-specific lymph node yield in laparoscopic and open distal gastrectomy for early gastric cancer[J].Surg Laparosc Endosc Percutan Tech,2011,21(6):424-428.
3Kitano S,Iso Y,Moriyama M,et al.Laparoscopy assisted BillrothⅠgastrectomy[J].Surg Laparosc Endosc,1994,4(2):146-148.
4Kitano S,Shiraishi N,Kakisako K,et al.Laparoscopy-assisted Billroth-Ⅰ gastrectomy(LADG)for cancer:our 10 years′experience[J].Surg Laparosc Endosc,2002,12(3):204-207.
5Huscher CG,Mingoli A,Sgarzini G,et al.Laparoscopic versus open subtotal gastrectomy for distal gastric cancer:five-year results of a randomized prospective trial[J].Ann Surg,2005,241(2):232-237.
6Weber KJ,Reyes CD,Gagner M,et al.Comparison of laparoscopic and open gastrectomy for malignant disease[J].Surg Endosc,2003,17(6):968-971.
7Lee SI,Choi YS,Park DJ.Comparative study of laparoscopy-assisted distal gastrectomy and open distal gastrectomy[J].J Am Coll Surg,2006,202(6):874-880.
8Fujiwara M,Kodera Y,Misawa K,et al.Longterm outcomes of early-stage gastric carcinoma patients treated with laparoscopy-assisted surgery[J].J Am Coll Surg,2008,206(1):138-143.
9Tokunaga M,Hiki N,Fukunaga T,et al.Quality control and educational value of laparoscopy-assisted gastrectomy in a high-volume center[J].Surg Endosc,2009,23(2):289-295.
10Kim MC,Jung GJ,Kim HH.Learning curve of laparoscopy-assisted distal gastrectomy with systemic lymphadenectomy for early gastric cancer[J].World J Gastroenterol,2005,11(47):7508-7511.
11Jin SH,Kim DY,Kim H,et al.Multidimensional learning curve in laparoscopy-assisted gastrectomy for early gastric cancer[J].Surg Endosc,2007,21(1):28-33.
12Minutolo V,Gagliano G,Rinzivillo C,et al.Usefullness of the ultrasonically activated scalpel in laparoscopic cholecystectomy:our experience and review of literature[J].G Chir,2008,29(5):242-245.
13Tucker RD.Laparoscopic electrosurgical injuries:survey results and their implications[J].Surg Laparosc Endosc,1995,5(4):311-317.
14Zeng YK,Yang ZL,Peng JS,et al.Laparoscopy-assisted versus open distal gastrectomy for early gastric cancer:evidence from randomized and nonrandomized clinical trials[J].Ann Surg,2012,256(1):39-52.
15Oz BS,Mataraci I,Iyem H,et al.Comparison of ultrasonically activated scalpel and traditional technique in radial artery harvesting:clinical research[J].Thorac Cardiovasc Surg,2007,55(2):104-107.
16Satoh S,Okabe H,Kondo K,et al.Video.A novel laparoscopic approach for safe and simplified suprapancreatic lymph node dissection of gastric cancer[J].Surg Endosc,2009,23(2):436-437.
17Ogura G,Nakamura R,Muragaki Y,et al.Development of an articulating ultrasonically activated device for laparoscopic surgery[J].Surg Endosc,2009,23(9):2138-2142.
18Martínez-Ramos D,Miralles-Tena JM,Cuesta MA,et al.Laparoscopy versus open surgery for advanced and resectable gastric cancer:a meta-analysis[J].Rev Esp Enferm Dig,2011,103(3):133-141.
19Varela JE,Hiyashi M,Nguyen T,et al.Comparison of laparoscopic and open gastrectomy for gastric cancer[J].Am J Surg,2006,192(6):837-842.
20Usui S,Yoshida T,Ito K,et al.Laparoscopy-assisted total gastrectomy for early gastric cancer:comparison with conventional open total gastrectomy[J].Surg Laparosc Endosc Percutan Tech,2005,15(6):309-314.
21Kim YW,Han HS,Fleischer GD,et al.Hand-assisted laparoscopic total gastrectomy[J].Surg Laparosc Endosc Percutan Tech,2003,13(1):26-30.
22Person B,Cera SM.Prolonged postlaparoscopy carbon dioxide pneumoperitoneum[J].Surg Laparosc Endosc Percutan Tech,2008,18(1):114-117.
23Fuganti PE,Rodrigues Júnior AJ,Rodrigues CJ,et al.A comparison of the effects of pneumoperitoneum and laparotomy on natural killer cell mediated cytotoxicity and Walker tumor growth in Wistar rats[J].Surg Endosc,2006,20(12):1858-1861.
24Kosugi C,Ono M,Saito N,et al.Port site recurrence diagnosed by positron emission tomography after laparoscopic surgery for colon cancer[J].Hepatogastroenterology,2005,52(65):1440-1443.
25Hirabayashi Y,Yamaguchi K,Shiraishi N,et al.Port-site metastasis after CO2pneumoperitoneum:role of adhesion molecules and prevention with antiadhesion molecules[J].Surg Endosc,2004,18(7):1113-1117.
26Iwanaka T,Arya G,Ziegler MM.Mechanism and prevention of port-site tumor recurrence after laparoscopy in a murine model[J].J Pediatr Surg,1998,33(3):457-461.
27Dulucq JL,Wintringer P,Stabilini C,et al.Laparoscopic and open gastric resections for malignant lesions:a prospective comparative study[J].Surg Endosc,2005,19(7):933-938.
28Pugliese R,Maggioni D,Sansonna F,et al.Total and subtotal laparoscopic gastrectomy for adenocarcinoma[J].Surg Endosc,2007,21(1):21-27.
29Shimizu S,Noshiro H,Nagai E,et al.Laparoscopic gastric surgery in a Japanese institution:analysis of the initial 100 procedures[J].J Am Coll Surg,2003,197(3):372-378.
30Kitano S,Shiraishi N,Uyama I,et al.A multicenter study on oncologic outcome of laparoscopic gastrectomy for early cancer in Japan[J].Ann Surg,2007,245(1):68-72.
