异育银鲫体内盐酸双氟沙星血浆蛋白结合率的变化与其药代动力学研究
2013-04-19章海鑫胡鲲阮记明郑卫东符贵红杨先乐王会聪刘
章海鑫胡 鲲阮记明郑卫东符贵红杨先乐王会聪刘 攀
(1.上海海洋大学国家水生动物病原库, 上海 201306; 2. 江西省水产科学研究所, 江西 南昌 330039; 3. 中国水产科学研究院长江水产研究所, 武汉 430223; 4. 中国水产科学研究院东海水产研究所农业部,海洋鱼河口渔业资源及生态重点开发实验室, 上海 200090)
异育银鲫体内盐酸双氟沙星血浆蛋白结合率的变化与其药代动力学研究
章海鑫1,2*胡 鲲1阮记明1郑卫东3符贵红4杨先乐1王会聪1刘 攀1
(1.上海海洋大学国家水生动物病原库, 上海 201306; 2. 江西省水产科学研究所, 江西 南昌 330039; 3. 中国水产科学研究院长江水产研究所, 武汉 430223; 4. 中国水产科学研究院东海水产研究所农业部,海洋鱼河口渔业资源及生态重点开发实验室, 上海 200090)
为了研究盐酸双氟沙星(Difloxacin, DIF)在异育银鲫体内血浆蛋白结合率的变化及其与药代动力学之间的关系, 实验采用超滤法测定了DIF在异育银鲫体内血浆蛋白结合率, 运用HPLC测定其对应时间点药物浓度, 并分析了血浆蛋白结合率变化对DIF体内处置的影响。实验以感染嗜水气单胞菌的异育银鲫为感染组, 健康异育银鲫为对照组。结果显示: 感染组各时间点DIF血浆蛋白结合率均高于对照组, 感染组与对照组DIF血浆蛋白结合率与总药物浓度呈对数关系: y=−9.01ln x+74.34和y=−4.81ln x+65.15, DIF血浆蛋白结合率与游离药物浓度的对数关系式分别为: y =−6.36ln x + 64.91和y = −4.36ln x+ 60.63; 感染组和对照组血浆药时曲线均可使用开放性二室模型描述; 感染组DIF的吸收和消除慢于对照组, 其表观分布容积和曲线下面积大于对照组。结果显示异育银鲫体内感染嗜水气单胞菌促使DIF血浆蛋白结合率升高; 血浆蛋白结合率升高导致药物以结合药物的形式储存于血液中可能是导致药物组织分布受限、消除缓慢、长时间滞留于血液原因之一。
盐酸双氟沙星; 异育银鲫; 嗜水气单胞菌; 血浆蛋白结合率; 药代动力学
动物感染病菌后机体生理功能的改变影响着治疗药物的血浆蛋白结合率, 血浆蛋白结合率的增高或降低势必制约药物的体内游离浓度, 从而进一步影响药物在动物体内的分布、代谢和消除规律[1,2]。血浆蛋白结合率越高, 游离药物浓度越低, 药物的生物利用度也越低[3,4]。在临床药动学研究中, 药物在患病动物体内的血浆蛋白结合率的变化也相应的对其代谢动力学产生影响。然而, 目前大多水产药代动力学是以健康养殖动物为研究对象, 均未考虑患病水产动物生理变化及血浆蛋白结合对药代动力学的影响[5—8], 其研究结果不能完全反应患病水产动物体内实际代谢状况, 也未研究血浆蛋白结合率对药物体内过程的影响[9,10]。虽然有些研究中测定了血浆蛋白结合率, 但均未分析其与药物体内处置过程的关系[11—13]。因此, 比较感染组与对照组水产动物体内药物血浆蛋白结合率的变化情况和药代动力学的差异, 分析血浆蛋白结合率对于药物体内处置过程的影响, 对于规范、合理地使用水产药物及有效地控制药物残留具有极其重要的实践意义。
本文以盐酸双氟沙星(Difloxacin, DIF)[14]为研究对象, 比较了DIF在感染嗜水气单胞菌(Aeromonas hydrophila)与健康异育银鲫(Carassais auratus gibebio)体内血浆蛋白结合率和药代动力学差异, 分析了在不同生理条件下药物血浆蛋白结合率对于药物体内处置的影响。从而填补了DIF水产动物药代动力学中的血浆蛋白结合的空白, 并为临床使用DIF治疗嗜水气单胞菌感染提供科学的理论依据。
1 材料与方法
1.1 药品与试剂
双氟沙星(DIF)标准品(含量≥99.9%)、购于Sigma公司; 盐酸双氟沙星原料药(纯度为98%)由浙江国邦药业有限公司提供。乙腈、四丁基溴化铵均为HPLC级; 二氯甲烷、正己烷、柠檬酸、柠檬酸三钠、氯化钠、磷酸氢二钠、磷酸二氢钠、高氯酸均为分析纯, 以上药品均由国药集团化学有限公司提供。
1.2 仪器与设备
Agilent-1100型高效液相色谱仪(配荧光检测器); 漩涡混合器; 氮气吹干仪; METTLER AB104-N型精密电子天平; Allegrax-15R型高速冷冻离心机,超滤管(Amicon 10kD)。
1.3 试验动物
健康的异育银鲫购买于江苏省南通某国营农场,体重为(40±5) g, 使用自动控温充气系统控制水温为(25±1)℃, 供氧充足; 每两天换水1次, 并及时清除水体残饵和排泄物。暂养一月后选取200尾试验, 20尾做空白对照。90尾异育银鲫感染嗜水气单胞菌(感染组), 90尾正常药物代谢试验(对照组)。
1.4 嗜水气单胞菌感染
嗜水气单胞菌(BYK-080916)由上海海洋大学国家水生动物病原库提供, 试验前腹腔注射健康异育银鲫复壮, 菌株制成菌悬液。按0.2 mL/尾注射含菌量为107cells/mL的菌液时, 异育银鲫没有出血症状;注射109cells /mL的菌液12h, 异育银鲫死亡率达到50%, 24h达到90%; 注射108cells/mL的菌液12h后, 鱼体出现有细菌性败血症的的症状。如体表出血、眼球突出、腹部膨大、腹鳍和胸鳍充血; 腹腔内充红腹水, 内脏充血, 肛突, 腹膜及鳔出血、肠壁发红, 内有黄色黏液, 选择此类活力均等的异育银鲫进行试验。
1.5 给药与取样
按20 mg/kg鱼体重标准用细导管灌盐酸DIF口服液入感染组和对照组鱼的前肠, 无回吐的留作实验。分别在给药后0.017、0.25、0.5、1、3、6、12、24、48、72、96、120、168和210h尾静脉采血0.5 mL/尾, 同一时间点采5尾。加入等体积ACD抗凝(n=5); 在4℃条件下3000 r/min离心10min, 分离血浆放入−70℃冷冻保藏至样品处理。
1.6 血浆样品处理
血浆总药物浓度 取1 mL血浆加入酸化乙腈(乙腈∶盐酸∶水=250∶1∶1) 5 mL, 漩涡混合10 min, 4℃条件下8000 r/min离心10min, 取上清液, 45℃恒温氮气条件下吹干, 加1 mL流动相溶解, 经0.45 μm微孔滤膜过滤, HPLC测定。
游离药物浓度与结合率 血浆游离药物浓度: 取0.5 mL血浆加入超滤管(10 KD), 4℃条件下14350 r/min离心120min, 收集超滤液。超滤液中加入5 mL二氯甲烷, 漩涡混合10min, 4℃条件下8000 r/min离心10min。取有机相, 45℃恒温氮气条件下吹干。1 mL流动相溶解残留物, 0.45 μm微孔滤膜过滤后HPLC分析。
药物结合率=(总药物浓度−游离药物浓度)/总药物浓度×100%
1.7 药物检测
血浆总药物浓度与游离药物浓度采用高效液相色谱法(HPLC)进行检测, 色谱条件采用李海迪等[15]的方法。血浆标准曲线为y=16.49x 1.57, R2=0.999,超滤液标准曲线为y=29.10x4.78, R2=0.999。DIF在血浆和超滤液中的绝对回收率均大于92.5%和95.0%, 日内精密度RSD(n=5)均小于0.99%和0.48%,日间精密度RSD(n=5)均小于0.84%和0.90%。
1.8 统计方法
图表制作使用Office 2007软件进行; 数据处理、方差分析采用SPSS 13.0软件进行; 药代动力学参数使用DAS 3.0软件进行计算。
2 结果
2.1 感染组与对照组总药时曲线和游离药时曲线
感染组和对照组总药时曲线(图1), 图中可见感染组前1h药物浓度均很低, 6h才达到峰值, Cmax为6.39 μg/mL; 1—6h时间段药物浓度稳定, 未出现重吸收峰。210h时血浆中药物浓度降到所有测定样品的最低值。对照组对于药物的吸收明显快于感染组,对照组血浆盐酸双氟沙星达峰时间Tmax为0.25h; 达峰浓度Cmax为15.06 μg/mL, 3h出现重吸收峰; 之后快速下降; 6h前药物浓度高于感染组, 之后药物浓度低于感染组。210h时已检测不出药物。结果表明感染组对于DIF的吸收、排泄滞后于对照组。
图2为感染组总药时曲线与游离药时曲线, 由图可知感染组的游离药时曲线与总药时曲线达峰时间Tmax均为6h, 达峰浓度Cmax分别为2.53和6.39 μg/mL, 且均在1—6h有一段浓度平缓期, 之后缓慢消除; 总药物浓度与游离药物浓度变化不平行。图3为对照组总药时曲线与游离药时曲线, 对照组游离药时曲线与总药时曲线达峰时间Tmax均为0.25h, 达峰浓度Cmax分别为7.04和15.07 μg/mL; 3h也出现重吸收峰, 之后缓慢消除, 总药物浓度与游离药物浓度变化不平行。
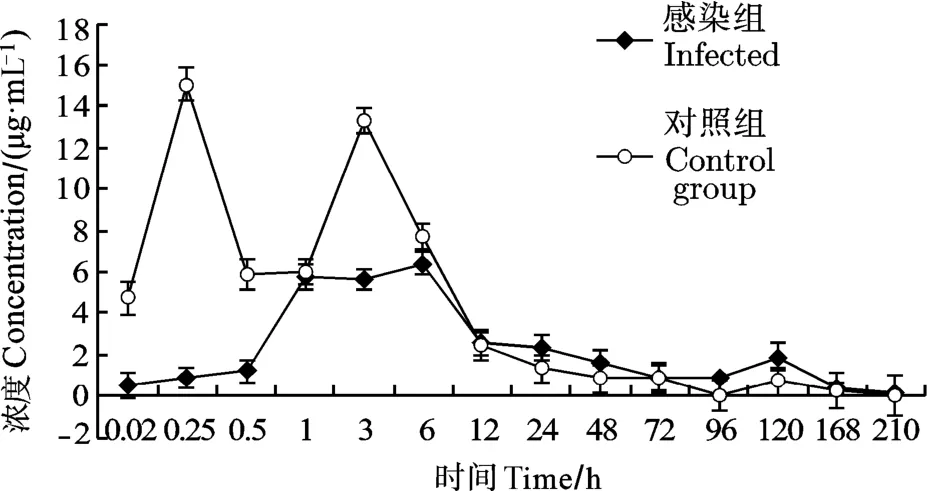
图1 感染组与对照组异育银鲫血浆中DIF药时曲线(n=5, Mean±SD)Fig. 1 Concentration time curve of difloxacin in plasma of the infected and healthy Carassais auratus gibebio(n=5, Mean±SD)

图2 感染组异育银鲫血浆中DIF游离与总药时曲线(n=5, Mean±SD)Fig. 2 Concentration time curve of free and total difloxacin in plasma of infected Carassais auratus gibebio(n=5, Mean±SD)
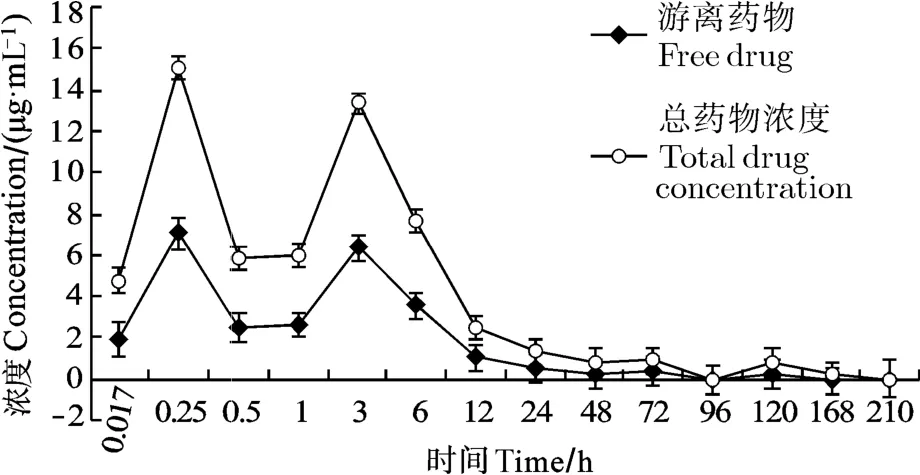
图3 对照组异育银鲫血浆中DIF游离与总药时曲线(n=5, Mean±SD)Fig. 3 Concentration time curve of free and total difloxacin in plasma of control group Carassais auratus gibebio(n=5, Mean±SD)
2.2 感染组与对照组总药物与游离药物药代动力学
感染组与对照组异育银鲫口服DIF后, 药时数据使用DAS 3.0软件进行动力学模型拟合和参数计算, 主要参数(表1)。结果显示: 感染组与对照组总药时数据均可使用开放性二室模型描述, 游离药时数据也能使用开放二室模型进行拟合。感染组体内DIF的T1/2α、AUC、Vd、T1/2β均大于对照组, 分别为6.34和2.09 h、303.65和229.13 μg·h/mL、2.59和0.87 /kg、107.92和71.75h; CL、Ka则均小于对照组,分别为0.07和0.09/(h·kg)、2.75和0.41 /h。感染组游离DIF的CL、Ka均大于对照组, 分别为0.28和0.19/(h·kg)、3.35和0.39 /h; AUC、Vd均小于对照组,分别为72.41和106.46 μg·h/mL、1.35和1.58 /kg。

表1 感染组与对照组异育银鲫单次口灌DIF后血浆药物动力学参数Tab. 1 The pharmacokinetic parameters of difloxacin in plasma of control group and infected Carassais auratus gibebio
2.3 血浆蛋白结合率与总药物浓度及游离游离药物浓度
药物血浆蛋白结合率与游离药时曲线的关系(图4)。图中可以看到感染组与对照组异育银鲫血浆蛋白结合率均不稳定, 感染组药物血浆蛋白结合率在各时间点均高于对照组, 且均会随着时间的变化而变化。感染组1h前游离药物浓度缓慢上升, 结合率缓慢下降, 1—6h保持较高的游离药物浓度时, 结合率保持稳定; 之后游离药物浓度降低而结合率升高。对照组在0.25h和3h两个吸收峰时结合率最低,游离药物浓度降低时结合率也升高。
对结合率与总药物浓度和游离药物的关系分析结果(图5), 由图可知血浆蛋白结合率的变化和药物浓度有一定的关系。感染组与对照组的血浆蛋白结合率随着总药物浓度的升高而降低, 并趋向于平稳。这表明DIF与异育银鲫血浆蛋白的结合率与药物浓度有关。浓度高, 结合率下降, 结合部位趋于饱和,游离药物浓度升高。分析结合率和总药物浓度的关系,发现存在一定的对数关系, 感染组: y=−9.01ln x+ 74.34, R2=0.927, 对照组: y=−4.81ln x+65.15, R2= 0.857。感染组与对照组血浆蛋白结合率与游离药物浓度也存在一个相互变化的过程, 也呈现出对数关系, 感染组: y = −6.36ln x + 64.91, R2= 0.983 ; 对照组: y = −4.36ln x+ 60.63, R2= 0.889。

图4 感染组与对照组异育银鲫血浆中游离DIF浓度与结合率(n=5, Mean±SD)Fig. 4 The free difloxacin concentration inplasma and protein binding rate in control group and infected Carassais auratus gibebio(n=5, Mean±SD)
3 讨论
3.1 血浆蛋白结合率与总药物浓度和游离药物浓度关系

图5 DIF血浆蛋白结合率与血浆药物浓度Fig. 5 The difloxacin protein binding rate and drug concentration in plasma
药物的药理作用取决于未结合的游离药物在作用部位的浓度和持续时间, 因此, 血液中游离药物浓度具有更大的临床意义。对于饱和结合的药物,虽然不能通过测定血药总浓度直接测量作用部位的游离药物浓度, 但可以用总药物浓度乘以药物的游离率获得药物的游离药物浓度[16,17], 药物的游离率由药物与血浆蛋白的亲和力以及结合蛋白位点数决定[18]。然而有些药物蛋白结合率具有浓度依赖性,结合率会随着药物浓度而变化, 血浆药物蛋白结合率的差异影响药物临床效果[19—21]。此外, 药物血浆蛋白结合率大于90%为高蛋白结合率, 小于20%为低蛋白结合率[22]。在实验中感染组与对照组的药物血浆蛋白结合率均在90%和20%之间, 属于中度结合, 结合率与总药物浓度和游离药物浓度之间具有一定的相关性, 因此监测药物的游离浓度具有较大的临床意义。在实验中感染组与对照组的药物血浆蛋白结合率随着总药物浓度和游离药物浓度的升降分别降低和升高, 而且与总药物浓度和游离药物浓度成一定的对数关系; Steven M, et al.[23]同样发现氟甲喹在斑点叉尾?体内的血浆蛋白结合率随着药物浓度的升高而降低; 余建鑫等[24]和Ismail[25]在各自的研究中发现血啉甲醚血浆蛋白结合率和DIF骆驼血浆蛋白结合率均随着药物浓度升高而降低。这表明DIF与异育银鲫血浆蛋白的结合率与药物浓度有关。浓度高, 结合率下降, 结合部位趋于饱和, 游离药物浓度升高。
药物血浆蛋白结合率由药物理化性质和动物生理决定, 在不同生理条件下药物血浆蛋白结合率不一样[22], 在实验中感染组DIF血浆蛋白结合率在各个时间点均明显地高于对照组。Uno[11]同样发现土霉素在健康香鱼体内血浆蛋白结合率低于感染弧菌香鱼体内的结合率, 许敏[12]发现肝损伤小鼠体内芍药苷和芍药内酯的血浆蛋白结合率大于健康小鼠体内。对于感染组药物血浆蛋白结合率高于对照组的原因目前还不是很清楚, 但Curt认为电解质和体液失调会影响药物的分布容积, 改变药物的蛋白结合[26]; 同样有文献报道感染嗜水气单胞菌后水产动物体内总蛋白和球蛋白含量增加, 白蛋白无显著变化, 电解质和体液失调[21,22,27]; 但其是否与药物血浆蛋白结合率的变化有关还有待进一步的确定。
综上所述表明DIF血浆蛋白结合具有一定的药物浓度依赖性, 能够影响体内药物的总浓度和游离浓度。此外, 感染嗜水气单胞菌引起异育银鲫生理变化而导致DIF血浆蛋白结合率的变化, 具体机制还不是很清楚。
3.2 感染嗜水气单胞菌对异育银鲫体内DIF药代动力学的影响
DIF的药时曲线受到动物生理、给药方式及温度等的影响, Ding F K, et al.[28]发现 DIF在鲫体内的代谢房室模型与温度有关, 李海迪等[15]、丁焕中等[29]发现 DIF房室代谢模型为二室模型。在实验中DIF在感染组和对照组体内药时曲线合游离药时曲线均能使用开放的二室模型进行拟合, 但其药代参数具有较大的差异; 同样有达氟沙星和芍药苷在感染模型和健康模型体内的代谢房室模型没有发生改变的报道[8,12]。
患病动物机体的生理变化影响着药物的体内处置过程[30], 当急性或慢性疾病影响肝脏时, 均可明显影响某些药物在肝脏中的代谢, 药代动力学特征表现为药物清除率降低, 半衰期延长。在实验中对照组对于DIF的吸收快于感染组, 且达峰浓度大于感染组; 但消除半衰期明显长于对照组, 药时曲线下面积也大于对照组; 表观分布容积大于对照组。文献报道感染嗜水气单胞菌的鱼肝肾功能会发生相应的变化, 导致肝肾功能下降和紊乱[31,32]。感染嗜水气单胞菌后肾小球的滤过与重吸收功能失调, 肾小球过滤受损或减退容易使体液和血液中过多的含氮物质在体内积蓄, 而使药物消除减慢、 半衰期延长[33]。刘彦等比较感染鳗弧菌牙鲆与健康牙鲆药物代谢动力学时发现感染鳗弧菌的牙鲆对于达氟沙星的吸收慢于健康的牙鲆, 曲线下面积大于健康鱼,而消除半衰期延长[8]; 应翔宇在研究恩诺沙星在健康及巴氏杆菌感染鸡体内的药物代谢动力学时也得到类似的结果[34]。这表明DIF在感染嗜组与对照组间的药代动力学差异是由于感染嗜水气单胞菌引起的起肝肾等功能的变化而产生。Uno 也认为细菌感染影响机体的正常功能导致机体对药物的吸收能力下降[11]。综上所述, 嗜水气单胞菌感染没有改变DIF体内分布的房室模型, 但能够显著的降低DIF的体内吸收速率和达峰时间, 延长其体内消除。
3.3 DIF血浆蛋白结合率对其体内处置的影响
在实验中感染组总药物和游离药物浓度前6h均低于对照组, 但血浆蛋白结合率高于对照组, 感染组药时曲线下面积、表观分布容积均大于对照组,消除半衰期长于对照组; 但感染组游离药物药时曲线下面积、表观分布容积均小于对照组, 消除半衰期短于对照组。药物血浆蛋白结合率的高低直接影响药物体内的分布和处置[18], 表观分布容积为药物在动物体内分布的广窄的参数, 由血浆分布容积和组织分布容积组成, 分布容积与组织结合成正相关、与血浆蛋白结合成反相关, 即血浆蛋白结合率低导致血管外分布增大[35,36]。血浆蛋白结合影响药物的游离分布容积和组织分布容积, 结合率的升高降低药物游离分布容积, 使得药物组织分布受限而血浆分布容积升高[18]; 结合率低的药物易通过血脑屏障, 结合率高的药物则不易通过血脑屏障, 如磺胺噻唑与血浆蛋白结合率高, 很难进入到脑脊液;磺胺甲嘧啶与血浆蛋白结合率低, 则进入脑脊液的药物较多[22]。此外, 影响药物从肾小球滤过的主要因素是药物与血浆蛋白的结合程度以及肾小球的滤过率[22], 当肾脏发生疾病时对于某些几乎完全从肾脏排泄的药物, 比如氨基糖苷类, 在动物体内容易积蓄, 甚至由于积蓄产生毒性[26]。综上所述, 由于嗜水气单胞菌感染, 导致异育银鲫对于DIF的吸收受限而使得6h前的血浆药物浓度均低于对照组; 感染组药物血浆蛋白结合率高于对照组, 导致药物体内组织分布受限和降低肾脏对于药物的排泄能力; DIF在感染组体内停留的时间更长, 以结合药物形式大量储存于血液中, 阻碍了药物的体内分布。Uno[37]认为土霉素在南美白对虾体内具有较大的组织分布容积是由于土霉素与南美白对虾血液淋巴具有较小的结合率, Uno[13]噁
也认为喹酸在竹节虾体内的血浆分布容积大于土霉素是由于噁喹酸血浆蛋白结合率大于土霉素; 白芍药总苷中芍药苷和芍药内酯在急性CCL4肝损伤大鼠内的血浆蛋白结合率大于健康白鼠, 其半衰期也相应地延长[12]。
[1] Yuan Z H, Liao X Q, Yin Y H, et al. The development of Streptococcosis suum as a model for the pharmacokinettc study in swine [J]. Acta Veterinaria et Zootechnica Sinica, 1994, 25(5): 430—435 [袁宗辉, 廖小群, 尹烨华, 等. 药物代谢动力学猪链球菌病模型的研制. 畜牧兽医学报, 1994, 25(5): 430—435 ]
[2] Masaki OTAGIRI A. Molecular functional study on the interactions of drugs with plasma proteins [J]. Drug metabolism Pharmacokinet, 2005, 20(50): 309—323
[3] Reidenberg M M, Erill S. Drug-protein Binding [M]. New York: Praeger Publishers. 1986, 75—87
[4] Meyer M C, Guttman D E.The binding of drugs by plasma proteins [J]. Journal of Pharmaceutical Sciences, 1968, 57: 895—918
[5] Intorre L, Cecchini S, Bertini S, et al. Pharmacokinetics of enrofloxacin in the seabass (Decentrar chus labrax) [J]. Aquaculture, 2000, 182(12): 49—59
[6] Vick A M, Hayton W L. Methyltestosterone pharmacokinetics and oral bioavailability in rainbow trout (Oncorhync husmykiss) [J]. Aquaculture Toxicology, 2001, 52(34): 177—188
[7] Wei M J, Zhao M. Pharmacokinetic Research and Evaluation on New Drugs [M]. Beijing: Beijing University Medical Press. 2008, 52—53 [魏敏吉, 赵明. 创新药物药代动力学研究与评价. 北京: 北京大学医学出版社, 2008, 52—53]
[8] Liu Y, Li J, Wang Q, et al. Establishment of a pharmacokinetic model for Paralichthy solivaceus infected with Vibrio anguillarum [J]. Marine Fisheries Research, 2007, 28(2): 76—83 [刘彦, 李健, 王群, 等. 鳗弧菌感染牙鲆药物代谢动力学模型的初步建立. 海洋水产研究, 2007, 28(2): 76—83]
[9] Zeng Z L, Ding H Z, Huang X H, et al. Pharmacokinetics and bioavailability of difloxacin in pigs [J]. Scientia Agricultura Sinica, 2003, 36(7): 846—850 [曾振灵, 丁焕中, 黄显会, 等. 二氟沙星在猪体内的药物动力学及生物利用度研究. 中国农业科学, 2003, 36(7): 846—850]
[10] Garcia M A, Solans C, Aramayona J J, et al. Simultaneous determination of difloxacin and its primary metabolite sarafloxacin in rabbit plasma [J]. Chromatographia, 2000, 51: 487—490
[11] Uno K. Pharmacokinetic study of oxytetracycline in healthy and vibrios is infected ayu (Plecoglossus altivelis) [J]. Aquaculture, 1996, 143(1): 33—42
[12] Xie M. Studies on The pharmacokinetics of total glucosides of paeony on acute hepatic injury of rats induced by CCL4[D]. Hebei Medical University, Shijiazhuang. 2011 [谢敏.白芍药总苷在CCL4肝损伤大鼠体内的药代动力学研究.河北医科大学, 石家庄. 2011]
[13] Uno K. Pharmacokinetics of oxolinic acid and oxytetracycline in kuruma shrimp, Penaeus japonicus [J]. Aquaculture, 2004, 230(1): 1—11
[14] Liu K Y, Li Y L, Hu T X . A general summary on the applications and studies of difloxacin [J]. Chinese Journal of Veterinary Drug, 2004, 38(6): 27—31 [刘开永, 李英伦, 胡廷秀. 二氟沙星的研究概况. 中国兽药杂志, 2004, 38(6): 27—31]
[15] Li H D, Yang X L, Hu K, et al. Pharmacokinetics and the elimination regularity of Di floxacin and its metabolite sarafloxacin in Eriocheir sinensis [J]. Chinese Journal of Zoology, 2009, 44(2): 12—20 [李海迪, 杨先乐, 胡鲲, 等. 盐酸双氟沙星及其代谢产物在中华绒螯蟹体内药物代谢及残留消除规律. 动物学杂志, 2009, 44(2): 12—20]
[16] Revy R H, Moreland T A. Rarionale for monitoring free drug levels [J]. Clinical Pharmacology, 1984, 22(6): 1—9
[17] Greenblatt D J, Sellers E M, Koch-Weser J. Importance of oritein binding for the interpretation of serum or plasma drug concentrations [J]. The Journal of Clinical Pharmacology, 1982, 22: 59—63
[18] Guo B, Li C. Progress in research and evaluation on drug plasma protein binding in pharmacology [J]. Chinese Journal of Clinical Pharmacology, 2005, 10(3): 241—253 [郭斌, 李川. 药物与血浆蛋白结合的药理学基础及其研究进展. 中国临床药理学与治疗学, 2005, 10(3): 241—253]
[19] Li J H, Lu PAY. Role of Pharmacokinetic and metabolism in drug discovery and development [J]. Pharmacology Reviews, 1997, 49(7): 403—449
[20] Woo E, Greenblatt D J. Pharmacokinetic and clinical implications of quinidine protein binding [J]. Journal of Pharmaceut, 1979, 68(10): 466—470
[21] Li J H, Pan H, Wa Z P, et al. Determination of free digoxin in sera of 8 patients with chronic cardiac insufficiency [J]. Acta Pharmacology, 1995, 16(1): 47—50
[22] Li J. Clinical Pharmacology [M]. Beijing: People’s Medical Publishing House. 2008, 12 [李俊. 临床药理学. 北京: 人民卫生出版社. 2008, 12]
[23] Steven M P, Kathleen R E, Steven M M. Pharmacokinetics, tissue distribution, and metabolism of flumequine in channel catfish (Ictalurus punctatus) [J]. Aquaculture, 2000, 187: 1—14
[24] Yu J X, Chen W H, Xu D Y. The binding of hematoporphyrin monomethyl ether to plasma proteins [J]. Chinese Journal of Laser Medicine&Surgery, 1984, 3(3): 1—6 [余建鑫,陈文晖, 许德余. 血啉甲醚与血浆蛋白的结合. 中国激光医学杂志, 1984, 3(3): 1—6]
[25] Ismail. Disposition kinetics of difloxacin after intravenous intramuscular and subcutaneous administration in calves [J]. Veterinary Research Communications, 2007, 31: 467—476
[26] Curtis J R. Diseases of the Urinary System [M]. Druginduced Renal Disorders; Ⅱ. Br. Med. J. 1997, 375—377
[27] Zheng W W, Song T Y, Liu L H, et al. Studies on the outbreak of infectious diseases in soft-she ll turtles Ⅲ. The hemato-biochemical and histopathological changes of the infectious disease caused by Aeromonas hydrophila [J]. Fujian Journal of Agricultural Sciences, 1999, 14(4): 47—52 [郑伟文, 宋铁英, 刘利华, 等. 中华鳖暴发性传染病研究Ⅲ.嗜水气单胞菌感染症的血液生化和细胞病理. 福建农业学报, 1999, 14(4): 47—52]
[28] Ding F K, Cao J Y, Ma L B, et al. Pharmacokinetics and tissue residues of difloxacin in crucian carp (Carassius auratus) after oral administration [J]. Aquaculture, 2006, 256(1-4): 121—128
[29] Ding H Z, Zeng Z L, Yang G X, et al. Study on pharmacokinetics and bioavailability of difloxacin in chickens [J]. Chinese Journal of Veterinary Science and Technology, 2004, 34(6): 20—24 [丁焕中, 曾振灵, 杨贵香, 等. 二氟沙星在鸡体内的药物代谢动力学及生物利用度研究. 中国兽医科技, 2004, 34(6): 20—24]
[30] Baggot J D. Distribution of antimicrobial agents in normal and diseased animals [J]. Journal of the American Veterinary Medical Association (USA), 1980, 176(10): 1085—1090
[31] Guo S L, Guan R Z, Feng J J, et al. Inftuences of blood and biochemical parameters on American eels (Anguilla rostrata) challenged by Aeromonas hydrophi [J]. Journal of Jimei University (Natural Science) , 2009, 14(2): 14—17 [郭松林,关瑞章, 冯建军, 等. 嗜水气单胞菌感染对美洲鳗鲡血液和生化指标的影响. 集美大学学报(自然科学版), 2009, 14(2): 14—17]
[32] Li C Y, Jiang J F, Guo X, et al. Effects of Aeromonas hydrophila on hematological induces of Carassius auratus [J]. Hebei Fisheries, 2011, 8(1): 1—3 [李春艳, 姜巨峰, 郭鑫,等. 嗜水气单胞菌对金鲫血液学指标的影响. 河北渔业, 2011, 8(1): 1—3]
[33] Li J T. Clinical Pharmaco-Therapeusis [M]. Beijing: People’s Medical Publishing House. 2001, 105—167 [李家泰.临床药理学. 北京: 人民卫生出版社. 2001, 105—167]
[34] Ying X Y, Li D J, Tian H Y, et al. Pharmacokinetics of enrofloxacin in healthy and pasteurella multocida infected chicken [J]. Chinese Journal of Veterinary Drug, 2002, 36(1): 3—6 [应翔宇, 李冬郊, 田慧英, 等. 恩诺沙星与在健康及巴氏杆菌感染鸡体内的药物代谢动力学研究.中国兽药杂志, 2002, 36(1): 3—6]
[35] Yang X L, Liu Z Z, Yokoyama M. Pharmacokinetics of ciprofloxacinun in Chinese Mitten-Handed Crab, Eriocheir Sinensis [J]. Acta Hydrobiologica Sinica, 2003, 27(1): 18—22 [杨先乐, 刘至治, 横山雅仁. 盐酸环丙沙星在中华绒螯蟹体内药物代谢动力学研究. 水生生物学报. 2003, 27(1): 18—22]
[36] Fang W H, Zheng G X. Pharmacokinetics of norfloxacin in hemolymph from whitel egshrimp, Penaeus vannamei following intramuscl einjection and oral administration [J]. Acta Hydrobiologica Sinica, 2006, 30(5): 541—546 [房文红,郑国兴. 肌注和药饵给药下诺氟沙星在南美白对虾血淋巴中药代动力学. 水生生物学报, 2006, 30(5): 541—546]
[37] Uno K. Pharmacokinetics of oxolinic acid and oxytetracycline in kuruma shrimp, Penaeus japonicus [J]. Aquaculture, 2004, 232: 11—28
RESEARCHES OF PLASMA PROTEIN BINDING RATE OF DIFLOXACIN AND ITS PHARMACOKINETIC IN CARASSAIS AURATUS GIBEBIO
ZHANG Hai-Xin1,2, HU Kun1, RUAN Ji-Ming1, ZHENG Wei-Dong3, FU Gui-Hong4, YANG Xian-Le1, WANG Hui-Cong1and LIU Pan1
(1. National Pathogen Collection Center for Aquatic Animals, Shanghai 201306, China; 2. Jiangxi Fisheries Research Institute, Nanchang 330039, China; 3. Yangtze River Fisheries Research, Institute Chinese Academy of Fishery Scientific, Wuhan 430223, China; 4. Key and Open Laboratory of Marine and Estuarine Fisheries, Ministry of Agriculture, East China Sea Fisheries Research Institute, Chinese Academy of Fishery Science, Shanghai 200090, China)
To investigate the relationship between the diversities of plasma protein binding rate of Difloxacin (DIF) and its pharmacokinetic in Carassais auratus gibebio, ultrafilteration and high performance liquid chromatographic (HPLC) methods were applied to determine the plasma protein binding rate and pharmacokinetics of DIF in both infected by Aerominas hydrophila bacteria (infected group) and healthy Carassais auratus gibebio (healthy group), and the relationships between the diversities of plasma protein binding rate of DIF and its pharmacokinetic were analyzed in this paper. The results showed that the plasma protein binding rates of the drug in infected group was significantly higher than that of the healthy group at the corresponding time points. The plasma protein binding rates had logarithmic relationships with the total drug concentration and their equations were y=−9.01ln x+74.34(Infected group)and y=−4.81ln x+65.15(Healthy group), while the equations between the plasma protein binding rates and free concentration of the drug were y = −6.36ln x + 64.91(Infected group) and y = −4.36ln x+ 60.63(Healthy group) in these two groups. Meanwhile the concentration time curve of the two groups were all in accordance with the two-compartment open model. The absorptions and eliminations of DIF in infection group were slower while its apparent distribution volumes and the area under the concentration-time curves were greater than that of the healthy group. The results indicate that the values of the plasma protein binding rates of DIF could be increased by Aeromonas hydrophila in crucian carp, and this may be one of the reasons that leads to limit distribution of drugs, elimination of slowing down and a long stay in the blood in crucian carp which infected by Aeromonas hydrophila.
Difloxacin; Carassais auratus gibebio; Aerominas hydrophila; Plasma protein binding rate; Pharmacokinetic
S948
A
1000-3207(2013)01-0062-08
10.7541/2013.62
2011-12-04;
2012-11-01
国家863计划项目(2011AA10A216); 国家自然科学基金(31172430); 农业部行业专项(200803013)资助
章海鑫(1985—), 男, 江西宜春人; 硕士; 主要从事水产病害和药理学研究。E-mail: zhang73860@126.com *并列第一单位
杨先乐(1949—), 男, 教授, 博士生导师; E-mail: xlyang@shfu.edu.cn
