大麻哈鱼卵黄囊期仔鱼异速生长及其生态学意义
2013-04-19宋洪建刘伟王继隆唐富江
宋洪建刘 伟王继隆唐富江
(1.东北农业大学 动物科学技术学院, 哈尔滨 150030; 2.中国水产科学研究院黑龙江水产研究所, 哈尔滨 150070)
大麻哈鱼卵黄囊期仔鱼异速生长及其生态学意义
宋洪建1刘 伟2王继隆2唐富江2
(1.东北农业大学 动物科学技术学院, 哈尔滨 150030; 2.中国水产科学研究院黑龙江水产研究所, 哈尔滨 150070)
运用实验生态学的方法, 对大麻哈鱼(Oncorhynchus ketaWalbaum)卵黄囊期仔鱼的异速生长及器官优先发育在早期生存和环境适应上的生态学意义进行了研究。结果表明, 大麻哈鱼卵黄囊期仔鱼的感觉、摄食,呼吸和游泳等器官快速分化, 许多关键器官均存在异速生长现象。在身体各部分中, 头部和尾部为正异速生长, 躯干部为负异速生长, 体高有先增大后减小的趋势; 在头部器官中, 眼径、口宽、吻长和眼后头长均为正异速生长; 在游泳器官中, 胸鳍、腹鳍、背鳍、臀鳍、背鳍基、臀鳍基和尾鳍均为正异速生长, 脂鳍为负异速生长, 其中, 腹鳍在全长25.31 mm、12日龄出现生长拐点, 但拐点前后均为正异速生长。大麻哈鱼卵黄囊期仔鱼感觉、摄食, 呼吸和游泳等器官的快速发育, 使出膜后的仔鱼在最短的时间内获得了与早期生存密切相关的各种能力, 对适应复杂多变的外界环境具有重要的生态学意义。
大麻哈鱼; 卵黄囊期仔鱼; 异速生长; 生态学意义
大麻哈鱼(Oncorhynchus keta Walbaum)也称太平洋鲑, 属鲑形目(Salmoniformes), 鲑亚目(Salmonoidei), 鲑科(Salmonidae), 大麻哈鱼属(Oncorhynchus)[1,2]。生活在北纬35°以北的太平洋水域及其沿岸河流, 为溯河洄游性鱼类。在中国大麻哈鱼分布于黑龙江及其支流乌苏里江、绥芬河及图们江等河流[3]。因近年来对大麻哈鱼过度捕捞及环境污染, 其资源已严重衰竭, 故世界各鱼源国均对大麻哈鱼给予极大关注, 并从生态、遗传和气候变化等方面对大麻哈鱼进行了研究[4—8]。
异速生长是指生物体某一特征的相对生长速率不等于第二种特征的相对生长速率, 该现象广泛存在于动植物的生长模式中[9,10]。其中, 在鱼类早期发育过程中各器官的生长普遍表现出异速生长现象[11—14],即器官的发育存在不同生长阶段。这些器官在早期发育中具备比身体整体更快的生长速率, 直至器官发育完全或发育至某一阶段后, 生长明显减慢或与整体对比表现为等速生长[15,16], 以这种异速生长特征确保最重要的器官优先发育[17]。因此, 通过对仔鱼早期生长模型的研究, 可以了解器官发育的优先性, 掌握各器官在不同发育阶段所起的重要作用,解释其在生存环境中某些行为出现的原因, 具有重要的生态学意义。国内外已有学者对大麻哈鱼形态及消化系统的发生和发育进行了一些研究[18—21],但对大麻哈鱼仔鱼异速生长方面的研究尚未见报道。本文对大麻哈鱼卵黄囊期仔鱼异速发育进行了较为系统的研究, 探讨了其生长特征及其生态学意义, 以期丰富仔鱼发育期的基础研究。
1 材料与方法
1.1 实验材料与饲养条件
以2011年秋在乌苏里江抚远段捕获的近性成熟的大麻哈鱼生殖洄游群体为亲本, 在抚远大麻哈鱼放流站短期暂养后进行人工繁殖, 将同一批受精卵置于平列槽中, 并以经充分曝气的地下水为水源进行流水孵化, 孵化温度为10—12℃。当受精卵发育至发眼卵后期时, 取3000粒带水充氧运到黑龙江水产研究所实验站继续孵化。孵化用水亦为地下水,经充分曝气, 并用臭氧消毒处理。孵化容器为循环控温水槽(100 cm×50 cm×40 cm), 发眼卵放置于水槽中的塑料孵化筐里流水孵化, 孵化温度控制在(12± 0.2)℃, 每天观察鱼卵发育情况, 并及时挑除死卵。
选取在同一时期破膜的仔鱼用于实验。取破膜当日大麻哈鱼卵黄囊期仔鱼开始实验, 直至卵黄囊完全吸收(当可见卵黄消逝时则鉴定为卵黄囊完全吸收)实验结束, 实验周期为30d (在水温为12℃条件下大麻哈鱼卵黄囊期仔鱼阶段发育天数约为30d),测量样本为总样本的10%。实验期间水温控制在(12±0.2)℃, pH在7.2±0.1, 保持水中溶氧在8 mg/L以上。定时清污, 每周换水一次, 换水量为总容积的1/3。开口饵料为蛋黄, 后期饵料为直径0.2 mm的颗粒饲料, 在整个实验期间保证仔鱼营养良好。
1.2 研究方法
用Motic SML-168型体视显微镜观察和拍照。孵出仔鱼当日记为0日龄, 从第0日龄开始每天随机抽取10尾鱼苗作为观察材料, 用浓度为100 mg/L的MS-222麻醉后, 在体视显微镜下观察其外部各个器官的形态变化, 用Motic Images Advanced 3.2软件拍照并测量全长、头部长、眼径等(图1)各个指标, 精确到0.01 mm, 所有量度指标以平行或垂直于鱼体水平轴为基准。观察和拍照后用中性甲醛溶液固定全部样本以备查用。

图1 大麻哈鱼卵黄期仔鱼测量模式图Fig.1 Illustration of measurement of yolk-sac larvae of chum salmon
1.3 数据处理
全长与日龄的关系用Brody方程y =a (1 − be−kx)拟合[22], x为日龄, y为日龄x对应的全长, a为渐进全长, b为尺度常数, k为成熟指数。异速生长模型以幂函数方程即异速生长方程y = axb计算[23], 以卵黄囊期仔鱼全长为自变量x, y为与相对应的各种器官长度, a为y轴截距, b为异速生长指数。当b=1时, 为等速生长, 此时仔鱼器官的生长与全长等比例增长; b>1时, 为快速生长, 此时器官的生长要比全长生长快; b<1时为慢速生长, 此时器官的生长比全长生长慢。体高与全长的关系用二次方程y = ax2+ bx + c拟合, x为全长, y为体高, a、b和c为回归系数。
幂函数方程异速生长模型中若含有不同生长阶段, 以拐点分开, 不同生长阶段由不同的方程y=a1xb1, y=a2xb2表达。对b1、b2做t检测, 检测两个b值是否有差异显著; 对b1、b2是否等于1做t检测。用SPSS19.0统计软件进行非线性回归参数拟合, 以Levenberg-Marquardt方法拟合分段回归模型,以决定系数R2最大值与残差平方和最小值作为曲线拟合标准, 求得拐点值。用SPSS19.0统计软件进行显著性检测, P<0.05表示具有显著性差异; 用Origin8.0软件作图。
2 结果
2.1 全长与日龄的关系
大麻哈鱼卵黄囊期仔鱼全长与日龄的关系(图2), 仔鱼全长随日龄的变化曲线符合Brody方程y = a (1 − be−kx)。刚出膜仔鱼(0日龄)全长为19.68 mm,经过30日的生长全长达到30.46 mm。由图2可知,随着日龄的增加仔鱼全长的生长率逐渐减小, 至当卵黄囊完全吸收时(30日龄)仔鱼的渐进全长(35.47 mm)大于实际全长(30.46 mm)。
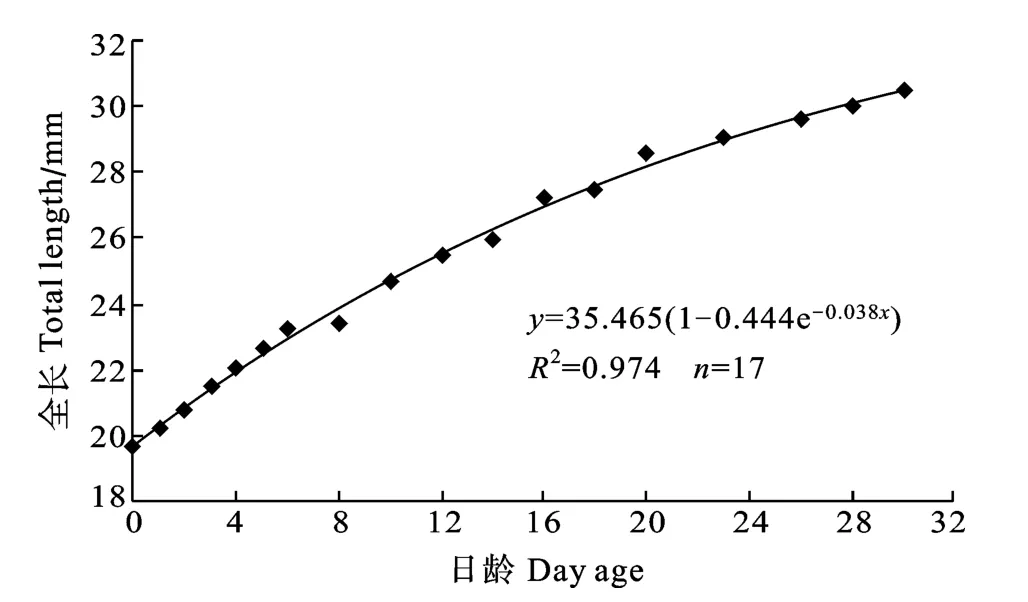
图2 大麻哈鱼卵黄囊期仔鱼日龄与全长的关系(仔鱼从0日龄到30日龄)Fig.2 Lorrelation between total length and day age of yolk-sac larvae of chum salmon (From hatching to Day 30)
2.2 身体各部的异速生长
大麻哈鱼卵黄囊期仔鱼的头部长(图3a)、躯干部长(图3b)和尾部长(图3c)均表现为异速生长, 但均没有出现生长拐点。它们的异速生长指数b分别为1.415、0.647、1.234, 3个异速生长指数与1之间均具有显著性差异(P<0.05), 其中头部长和尾部长为快速生长, 躯干部长为慢速生长。在10日龄全长23.20 mm之前, 初孵仔鱼的体高(图3d)随日龄的增长逐渐增加, 在10日龄全长23.20 mm之后, 随着全长的增加反而减小, 此时期的体高随全长的生长曲线用二元一次方程拟合比较适宜。
2.3 头部器官的异速生长
眼径(图4a)、口宽(图4b)、吻长(图4c)和眼后头长(图4d)的异速生长指数b分别为1.124、1.705、1.436和1.654, 4个异速生长指数与1之间均具有显著性差异(P<0.05), 其中眼径的异速生长指数稍大于1, 其他器官的生长指数均明显大于1, 说明在此时期这些器官均表现出明显的快速生长, 但均没有出现生长拐点。
2.4 游泳器官的异速生长
游泳相关器官主要是指各鳍和鳍基, 腹鳍(图5a-Ⅱ)在12日龄时出现生长拐点, 对应的全长为25.31 mm。腹鳍在生长拐点前的异速生长指数b1=2.415(P<0.05), 为快速生长; 拐点后的异速生长指数b2=4.223(P<0.05), 亦为快速生长, 但生长指数明显增大。此时期内胸鳍(图5a-Ⅰ)、尾鳍(图5b-Ⅰ)、脂鳍(图5b-Ⅱ)、背鳍基(图5c-Ⅰ)、背鳍(图5c-Ⅱ)、臀鳍基(图5d-Ⅰ)和臀鳍(图5d-Ⅱ)均不存在生长拐点, 生长指数b分别为2.142、2.314、0.545、1.194、3.415、1.515和3.430, 以上各生长指数与1之间均有显著性差异(P<0.05) , 即此时期内, 胸鳍、尾鳍、背鳍基、背鳍、臀鳍基和臀鳍均表现为明显的快速生长, 脂鳍表现为慢速生长。
3 讨论

图3 大麻哈鱼卵黄囊期仔鱼身体各部分的异速生长曲线及表达函数(仔鱼从0日龄到30日龄)Fig.3 Allometric growth curve and function of body parts of yolk-sac larvae of chum salmon (From hatching to 30-day age)
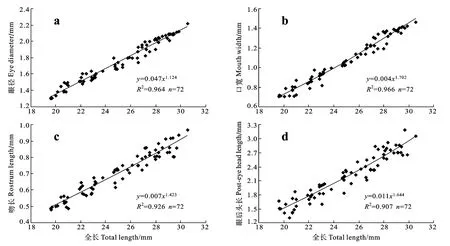
图4 大麻哈鱼卵黄囊期仔鱼头部各器官的异速生长曲线及表达函数(仔鱼从0日龄到30日龄)Fig.4 Allometric growth curve and function of head organs of yolk-sac larvae of chum salmon (From hatching to 30-day age)

图5 大麻哈鱼卵黄囊期仔鱼游泳器官异速生长曲线及表达函数(仔鱼从0日龄到30日龄)Fig.5 Allometric growth curve and function of swimming organs of yolk-sac larvae of chum salmon (From hatching to Day 30)
在自然水域中, 饥饿(或营养不良)和被捕食是影响鱼类仔、稚鱼死亡和资源补充量的主要因素[24—27]。因此, 仔、稚鱼能够成功躲避、逃离捕食者及获得足够的食物是提高其存活率的决定因素。为了维持种群持续繁衍, 鱼类在长期进化中形成了一种存活策略和个体发育机制, 即优先发育那些对存活起首要作用的器官[28], 并且这种生长的优先性会随着个体的发育而改变。大麻哈鱼仔鱼优先发育感觉、摄食、运动和呼吸等功能器官。另外, 其头部和尾部的正异速增长比躯干部更明显, 摄食和运动器官在早期发育过程中保持相互平衡, 这进一步表明了优先发育与摄食和逃避被捕食相关的器官是自然水域中其资源补充成功的重要保证。
在大麻哈鱼卵黄囊期仔鱼身体的各部分中, 头部和尾部均为快速生长。头部和尾部的优先发育,为头部的各器官和尾鳍的快速发育提供了生长空间[23]。头部快速生长是仔鱼形成有效的摄食器官所必需的, 是鱼类长期进化过程中自然选择的结果, 它可以确保仔鱼的最优摄食生态适应性并可能获得最大的净能效益。在实验阶段, 卵黄囊期仔鱼头部和尾部均比躯干部生长快, 这表明大麻哈鱼仔鱼的摄食和游泳行为之间的依赖性, 保持两者发育的相对平衡是仔鱼减少运动代价的一种适应, 这在其他硬骨鱼类如鲤(Cyprinus carpio Linnaeus)[11]和西伯利亚鲟(Acipenser baerii Brandt)[29]仔鱼研究中也有类似的发现。此时期尾部未出现明显的阶段差异, 均处于快速生长阶段, 大麻哈鱼早期发育的快速生长证明, 其尾部发育一直处于重要地位。躯干部的生长为慢速生长, 有效控制了鱼体全长, 减少了头部和尾部之间的距离, 使仔鱼的身体运动起来比较的协调, 这与仔鱼此时期游泳器官尚处于发育初期,运动及平衡能力差等特点相适应, 而从运动力学和能量消耗因素上考虑, 这有利于仔鱼调节身体的平衡, 减少了仔鱼捕食饵料生物时的消耗。
Ma, et al.[13]和Zhuang, et al.[14]的研究表明, 眼睛作为重要的感觉器官, 最早完成快速生长阶段,而另有研究认为眼睛在早期发育中并未表现出异速生长[30]。在本研究中大麻哈鱼卵黄囊期仔鱼眼径一直快于全长的生长速率, 以尽快提高觅食和躲避敌害的能力。但生长速率要小于口径和吻长, 表明在大麻哈鱼早期发育阶段眼睛的重要性低于口径和吻长, 这可能与其生长的环境有关。在头部器官中口宽、吻长和眼后头长均表现为明显的快速生长, 相比吻长, 口宽的生长指数比较大, 这或许与大麻哈鱼的肉食性相关, 即在吻长较小发展空间的前提下,通过口宽的生长来增加捕食能力。眼后头长的快速生长为呼吸器官鳃的生长提供了空间, 初孵仔鱼的鳃尚未形成, 其呼吸主要是通过体表和覆盖在卵黄囊后端的血管网来实现[31]。卵黄囊耗尽后, 仔鱼开始外源营养, 其体重也迅速增加, 耗氧率与体重呈正相关[32], 获得足够的溶解氧对仔鱼来说是非常重要的, 因此对其呼吸系统结构和功能要求迅速的发育和完善, 这也促使大麻哈鱼仔鱼眼后头长的正异速增长。类似的结果在对鲤[11]和非洲鲶(Clarias gariepinus Burchell)[15]的研究中也得到了证实。
初孵仔鱼主要有鳍褶和尾鳍, 尾鳍为主要的游泳器官, 游动主要依靠尾部不停的摆动, 进行垂直运动, 宽大的鳍褶对身体起到左右平衡的作用, 是其运动能力的基础。从初孵化到18日龄, 仔鱼基本没有主动游泳能力, 在水体底部头尾倒置呈垂直状聚集在一起, 这与此阶段仔鱼的鳍游泳能力不足及卵黄囊使得仔鱼重心主要集中在前半部分密切相关。18日龄部分仔鱼开口摄食并以巡游的游泳方式散布于水体中下部, 这种变化与仔鱼的胸鳍和尾鳍的发育、眼径开始功能化及卵黄囊的大量消耗有直接的关系。随着卵黄囊的减少及胸鳍和尾鳍的扩大,仔鱼的平衡性提高、游泳能力增强。背鳍、臀鳍和腹鳍的正异速生长指数都较其他游泳器官大, 仔鱼的游泳能力也有很大的提高, 躲避敌害、主动摄食的能力也随之加强[33]。我们认为背鳍和臀鳍对鱼体的左右平衡起着重要作用。鳍褶在鱼的早期发育阶段中, 呈现一个不断退化的过程, 最终完全消失。一般认为其主要的功能是保持早期仔鱼身体平衡。卵黄囊期仔鱼的肛门前鳍褶, 前面连接卵黄囊, 后面通过肛门与尾鳍相连, 平衡整个身体, 并把整个身体连成一体, 协调运动。在力学上肛门前鳍褶的连接作用是解决仔鱼身体拖动尾部摆动最节省能量的方法, 它的连接使尾鳍的摆动更加省力[15]。
脂鳍只有脂肪而没有鳍条支持, 因此并不能像其他鱼鳍一样帮助游泳, 又因为只见于一些比较古老的鱼类, 如: 鲑之类的鲑形目、鲶(Silurus)之类的鲶形目(Siluriformes)或是常见的观赏用脂鲤目(Characiformes)鱼类, 因此脂鳍一般被认定是属于退化性的组织, 并没有任何功用存在。不过有学者研究观察成年鲑的游泳行为时发现, 脂鳍可能有流体力学或感觉水流作用的功能, 可以帮助它们躲避伤害, 不过尚未确认作用的方式[34]。在本研究中仔鱼8日龄时才观察到脂鳍的出现, 生长速率明显低于全长, 异速生长指数为0.545, 远小于等速生长指数1, 推测在大麻哈鱼早期生命阶段脂鳍的功能不如其他各鳍重要, 故呈现负异速生长的特征。
通过对大麻哈鱼卵黄囊期仔鱼发育的研究可知,在早期发育过程中, 仔鱼的感觉、摄食、呼吸和游泳器官均具有异速生长特点。这些器官在仔鱼早期呈现快速发育, 使出膜后的仔鱼在最短的时间内获得与早期生存密切相关的各种能力, 这是鱼类在长期进化过程中保留下来的发育特征。早期快速完成以上器官的发育后, 仔鱼逃避敌害和主动摄食的能力迅速提高, 从而适应复杂多变的外界环境, 同时生存环境对鱼类早期优先生长又具有协同或刺激或胁迫等生态生理作用[35—37]。根据鱼类早期发育特点与环境适应性, 在人工增殖苗种培育生产中, 应按照早期发育阶段生长规律, 为其创造生理所需的环境条件, 投喂合适的开口饵料, 使其重要器官优先发育, 以有效地获得外源营养而渡过危险期, 避免早期的死亡; 在野生鱼类的自然繁育过程中, 可通过保护其产卵场, 创造良好的孵化和早期发育环境,具有重要的保护生态学意义。
[1] Wu X W.Chinese Journal of Economic Animal: Freshwater Fishes [M].Second Edition.Beijing: Science Press.1979, 24—25 [伍献文.中国经济动物志: 淡水鱼类.第二版.北京: 科学出版社.1979, 24—25]
[2] Ren M L.Heilongjiang River Fishes [M].Harbin: Heilongjiang People’s Publishing House.1981, 17—19 [任慕莲.黑龙江鱼类.哈尔滨: 黑龙江人民出版社.1981, 17—19]
[3] Han Y, Wang Y S, Fan Z T, et al.A survey on the resources of chum salmon (Oncorhynchus keta Walbaum) in Heilongjiang waters [J].Chinese Journal of Fisheries, 2002, 15(1): 24—34 [韩英, 王云山, 范兆廷, 等.黑龙江流域大麻哈鱼(Oncorhynchus keta Walbaum)资源现状研究.水产学杂志, 2002, 15(1): 24—34]
[4] Ruckelshaus M H, Levin P, Johnson J B, et al.The Pacific salmon wars: what science brings to the challenge of recovering species [J].Science, 2002, 33(1): 665—706
[5] Russell V J, Hold G L, Pryde S E, et al.Use of restriction fragment length polymorphism to distinguish between salmon species [J].Journal Agricultural Food Chemistry, 2000, 48(6): 2148— 2188
[6] Finney B P, Gregory-Eaves I, Sweetman J, et al.Impacts of climatic change and fishing on Pacifc salmon abundance over the past 300 year [J].Science, 2000, 290(5492): 795—799
[7] Schindler D E, Scheuerell M D, Moore J W, et al.Pacific salmon and the ecology of coastal ecosystems [J].Frontiers in Ecology and the Environment, 2003, 1(1): 31—37
[8] Kaeriyama M, Nakamura M, Edpalina R, et al.Change in feeding ecology and trophic dynamics of Pacific salmon (Oncorhynchus spp.) in the central Gulf of Alaska in relation to climate events [J].Fisheries Oceanography, 2004, 13(3): 197—207
[9] Peters R H.The Ecological Implications of Body Size [M].Second Edition.Cambridge: Cambridge University Press.1986, 184—215
[10] Niklas K J.Plant Allometry: the Scaling of Form and Process [M].Chicago: University of Chicago Press.1994, 274—290
[11] Osse J W M, van den Boogaart J G M, van Snik G M J.Priorities during early growth of fish larvae [J].Aquaculture, 1997, 155(1—4): 249—258
[12] Choo C K, Liew H C.Morphological development and allometric growth pattems in the juvenile seahorse Hippocampus kuda Bleeker [J].Journal of Fish Biology, 2006, 69(2): 426—445
[13] Ma J, Zhang L Z, Zhuang P, et al.Development and allometric grow patterns of larval Acipenser schrenckii [J].Chinese Journal of Applied Ecology, 2007, 18(12): 2875— 2882 [马境, 章龙珍, 庄平, 等.施氏鲟仔鱼发育及异速生长模型.应用生态学报, 2007, 18(12): 2875—2882]
[14] Zhuang P, Song C, Zhang L Z, et al.Allometric growth of artificial bred Siberian sturgeon Acipenser baeri larvae and juveniles [J].Chinese Journal of Ecology, 2009, 28(4): 681—687 [庄平, 宋超, 章龙珍, 等.全人工繁殖西伯利亚鲟仔稚鱼发育的异速生长.生态学杂志, 2009, 28(4): 681—687]
[15] Sink G M J, Boogaart J G M, Osse J W M.Larval growth patterns in Cyprinus carpio and Clarias gariepinus with attention to the fin fold [J].Journal of Fish Biology, 1997, 50(6): 1339—1352
[16] Herbing I H.Development of feeding structures in larval fish with different life histories: winter flounder and Atlantic cod [J].Journal of Fish Biology, 2001, 59(4): 767—782
[17] Rodriguez A, Gisbert E.Eye development and the role of vision during Siberian sturgeon early ontogeny [J].Journal of Applied Ichthyology, 2002, 18(4—6): 280—285
[18] Zhi B J, Liu W, Shi L Y.Study on growth and morphology of young chum salmon with artificial raising [J].Chinese Journal of Fisheries, 2009, 22(2): 49—52 [支兵杰, 刘伟, 石连玉.人工培育秋大麻哈幼鱼的生长与形态研究.水产学杂志, 2009, 22(2): 49—52]
[19] Liu W, Zhan P R, Zhao C G, et al.Study on morphological development of fall chum salmon (Oncorhynchus keta) otoliths in Heilongjiang River [J].Acta Hydrobiologica Sinica, 2010, 34(6): 1069—1076 [刘伟, 战培荣, 赵春刚, 等.黑龙江秋大麻哈鱼耳石形态发育研究.水生生物学报, 2010, 34(6): 1069—1076]
[20] Guan H H, Liu W, Zhao C G, et al.Ontogenetic development of digestive system in chum salmon Oncorhynchus keta before released [J].Journal of Dalian Ocean University, 2010, 25(4): 308—313 [关海红, 刘伟, 赵春刚, 等.放流前的大麻哈鱼消化系统发生发育的组织学研究.大连海洋大学学报, 2010, 25(4): 308—313]
[21] Ueda H.Physiological mechanism of homing migration in Pacific salmon from behavioral to molecular biological ap-proaches [J].General and Comparative Endocrinology, 2011, 170(2): 222—232
[22] Brody S, Lardy H A.Bioenergetics and Growth [J].Journal of Physical Chemistry, 1946, 50(2): 168—169
[23] Huxley J S.Problems of Relative Growth [M].New York: Lincoln Mac Veagh the Dial Press.1932, 241
[24] Houde E D.Fish early life dynamics and recruitment variability [J].American Fisheries Society Symposium, 1987, 2: 17—29
[25] Bailey K M, Houde E D.Predation on eggs and larvae of marine fishes and the recruitment problem [J].Advances in Marine Biology, 1989, 25: 1—83
[26] Kamler E.Early Life History of Fish: an Energetics Approach [M].London: Chapman and Hall.1992, 267
[27] Iguchi K, Mizuno N.Early starvation limits survival in amphidromous fishes [J].Journal of Fish Biology, 1999, 54(1): 705—712
[28] Osse J W M.Form changes in fish larvae in relation to changing demands of function [J].Netherlands Journal of Zoology, 1989, 40(1—2): 362—385
[29] Gisbert E.Early development and allometric growth patterns in Siberian sturgeon and their ecological significance [J].Journal of Fish Biology, 1999, 54(4): 852—862
[30] Peña R, Dumas S.Development and allometric growth Patterns during early larval stages of the spotted sand bass Paralabrax maculatofasciatus (Pereoidei: Serranidae) [J].Scientia Marina, 2009, 73(s1): 183—189
[31] Rombough P J.Respiratory gas exchange, aerobic metabolism, and effects of hypoxia during early life [A].In: Hoar W S, Randall D J (Eds.), Fish Physiology: The Physiology of Developing Fish [C].New York, London: Academic Press.1988, 59—161
[32] Yin M C.Fish Ecology [M].Beijing: Chinese Agriculture Publishing House.1993, 139 [殷名称.鱼类生态学.北京:中国农业出版社.1993, 139]
[33] Webb P W, Weihs D.Functional locomotor morphology of early life history stages of fishes [J].Transactions of the American Fisheries Society, 1986, 115(1): 115—127
[34] Reimchen T E, Temple N F.Hydrodynamic and phylogenetic aspects of the adipose fin in fishes [J].Canada Journal of Zoology, 2004, 82(6): 910—916
[35] Ellis T, Howell B R, Hayes J.Morphological differences between wild and hatchery-reared turbot [J].Journal of Fish Biological, 1997, 50(5): 1124—1128
[36] Koumoundouros G, Divanach P, Kentouri M.Ontogeny and allometric plasticity of Dentex dentex (Osteichthyes: Sparidae) in rearing conditions [J].Marine Biology, 1999, 135(3): 561—572
[37] Sloman K A, Taylor A C, Metcalfe N B, et al.Effects of an environmental perturbation on the social behaviour and physiological function of brown trout [J].Animal Behaviour, 2001, 61(2): 325—333
ALLOMETRIC GROWTH DURING YOLK-SAC LARVAE OF CHUM SALMON (ONCORHYNCHUS KETA WALBAUM) AND CONSEQUENT ECOLOGICAL SIGNIFICANCE
SONG Hong-Jian1, LIU Wei2, WANG Ji-Long2and TANG Fu-Jiang2
(1.College of Animal Science and Technology, Northeast Agricultural University, Harbin 150030, China;
2.Heilongjiang River Fisheries Research Institute, Chinese Academy of Fisheries Sciences, Harbin 150070, China)
Ecological experiment was conducted to study the allometric growth of chum salmon (Oncorhynchus keta Walbaum) yolk-sac larvae and its significance in adaptation in early life stage.The results indicated during the yolk-sac larvae stage organs associated to feeling, breathing, feeding and swimming developed and differentiated rapidly, and exhibited allometric patterns.Head and tail length exhibited positive allometric growth, and trunk exhibited negative allometric growth, body height have increased positively at first, then negatively.As for dimensions of organs in head, eye diameter, mouth width, rostrum length and post-eye head length, exhibited positive allometric increase.As for swimming organs, pectoral fin, pelvic fin, dorsal fin, anal fin, base of dorsal fin, base of anal fin and caudal fin, exhibited positive allometric growth; but adipose fin exhibited negative allometric growth.In addition, pelvic fin exhibited positive allometric growth both before and after the growth inflexion point, 25.31 mm in full length and 12 days after hatching.The fast development of feeling, feeding, breathing, swimming and other organs in yolk-sac larvae of chum salmon, increases larval survival ability at the early stage in the shortest possible time, and has important ecological significance to adapt the complex external environment.
Chum salmon (Oncorhynchus keta Walbaum); Yolk-sac larvae; Allometric growth; Ecological significance
Q959.4
A
1000-3207(2013)02-0329-07
10.7541/2013.23
2012-05-03;
2012-12-17
农业部财政专项物种资源保护项目(2011); 中央级公益性科研院所基本科研业务费专项(201107)资助
宋洪建(1982—), 男, 山东菏泽人; 硕士研究生; 主要从事水产动物营养与生理生态学研究。E-mail: songhongjian2006 @163.com
刘伟, 研究员; E-mail: liuwei_1020@yahoo.com.cn
