微拟球藻属对盐度的耐受及其产油特性分析
2013-04-19黄伟超胡晗华
黄伟超胡晗华
(1.中国科学院水生生物研究所, 武汉 430072; 2.中国科学院大学, 北京 100049)
微拟球藻属对盐度的耐受及其产油特性分析
黄伟超1,2胡晗华1
(1.中国科学院水生生物研究所, 武汉 430072; 2.中国科学院大学, 北京 100049)
微拟球藻(Nannochloropsis)是一类属于真眼点藻纲(Eustigmatophyceae)、球形或近似球形的单细胞真核生物,其细胞小(通常2—4 μm), 形态简单, 仅凭形态学和超微结构的特点很难确定其分类地位。然而, 与其他真核微藻显著不同的是, 该属的种类除叶绿素a外, 并不含有其他类型的叶绿素[1]。自Hibberd[2]首先描述微拟球藻属以来,该属大约有6个已定种, 分别是: 加的斯微拟球藻(N.gaditana)、颗粒微拟球藻(N.granulata)、湖泊微拟球藻(N.limnetica)、海洋微拟球藻(N.oceanica)、眼点微拟球藻(N.oculata)和盐生微拟球藻(N.salina)。该属的种类多为海生或盐生[3], 但也常见于淡水环境中[4]。由于微拟球藻属的种类含有高的多不饱和脂肪酸, 特别是二十碳五烯酸(EPA),而被认为是工业化生产EPA的最佳原料[5]。此外, 微拟球藻还能作为鱼类幼体和轮虫的饵料甚至是人类的食品。
自20世纪末以来, 由于全球性能源短缺以及CO2排放引起的温室效应使得对于可再生能源的开发和利用受到了广泛的关注。在多种可再生能源中, 按能源当量, 生物质能源仅次于煤炭、石油和天然气列第四位, 是国际公认缓解能源危机的有效途径之一。生物柴油是生物质能的一种, 它是以生物体油脂为原料, 经转酯作用而形成的单烷基脂肪酸酯, 是一种优质清洁柴油。发展生物柴油,原料是关键。微藻被认为是最具潜力、能实现可持续供给的油脂生物质资源之一, 利用微藻生产生物柴油具有多种优势。在众多的产油微藻中, 微拟球藻由于具有高的光合作用效率、生物量、油脂含量以及具有成熟的大规模封闭式光生物反应器和开放池的户外培养体系, 而被认为是最有潜力的工业产油的模式研究藻种[6]。其中盐生微拟球藻、眼点微拟球藻和加的斯微拟球藻由于具有相对较高的总脂含量而被研究得较为详尽[7—9]。特别是, 加的斯微拟球藻因表现出较广的盐度(10%—120%的海水盐度)和pH(7—10)耐受性, 在光自养条件下有高的生物量(>10 g/L)、对数期也能合成甘油三酯, 而被作为研究微藻产油的最佳模式生物, 目前其遗传转化体系已经建立, 全基因组序列已公布[10]。本研究以6种7株微拟球藻为对象,分析其对盐度的耐受性, 比较中性脂的组成和含量, 然后,从中选取两个油含量较高、目前应用较广的两株微拟球藻, 进一步研究批量培养条件下藻细胞油脂的积累规律和脂肪酸组成, 为利用微拟球藻作为生产生物柴油的原料提供理论依据。
1 材料与方法
1.1 藻株和培养
两株海洋微拟球藻(Nannochloropsis oceanica) MBIC10090和PP983分别来自日本生物资源中心(NBRC)和国家海洋局第一海洋研究所李瑞香实验室, 颗粒微拟球藻(N.granulataMBIC10054)和盐生微拟球藻(N.salinaMBIC10063)购自日本生物资源中心, 眼点微拟球藻(N.oculataCCAP 849/1)和加的斯微拟球藻(N.gaditanaCCAP 849/5)购自英国藻类和原生动物培养中心(CCAP),湖泊微拟球藻(N.limneticaKR 1998/3)由德国Lothar Krienitz教授提供。除属于淡水的湖泊微拟球藻用BG11培养基培养外, 其他的海洋种类均用f/2AW培养基培养。
1.2 藻株在海水和淡水中生长的比较
为便于比较, 先将属于海洋的6个藻株接种于BG11培养基中培养至少两代至对数生长期, 然后, 再分别将生长在BG11或f/2AW培养基中的藻细胞离心收集, 对应接种至含6 mL BG11或f/2AW培养基的15 mL培养试管中; 对于淡水种类而言, 由于预实验显示其不能生长在海水中, 因而比较时直接利用生长于BG11培养基中的藻细胞接种, 接种起始A730=0.1。静置培养在20℃、光强为60 μmol photons/(m2·s)的连续光照下进行, 每天至少摇动试管2—3次, 7d后测定A730值及叶绿素a的含量。叶绿素a的含量按照Parsons和Strickland[11]的方法(在90% 的丙酮中)用公式计算: Chl.a (mg/L)=11.41×A664。
1.3 藻株中性脂含量分析
6株海洋的微拟球藻和1株淡水的微拟球藻分别生长在含400 mL f/2AW和BG11培养基(将氮浓度减少到882 μmol/L NaNO3, 与f/2培养基中的氮浓度一致)的500 mL三角瓶中, 在22℃、100 μmol photons/(m2·s)的连续光照条件下静置培养20d至稳定期, 收获藻细胞提取总脂利用薄层层析法比较中性脂的组成及含量。
藻细胞的总脂按照Bligh和Dyer[12]的方法提取。经6000 r/min离心收集的藻细胞加入一定体积的氯仿∶甲醇(1∶1), 在旋涡振荡器上以最大速度振荡1—2 min, 然后加入3/10体积的1 mol/L氯化钾的0.2 mol/L磷酸溶液, 稍振荡后12000 r/min离心5min, 吸取下层氯仿相至新的EP管中, 置于通风厨中吹干, −20℃保存备用。薄层层析参照文献[13]进行。薄层层析板的型号是Silica gel 60 F254 (Merk KgaA Darmstadt, Germany), 展层剂体系为正己烷∶乙醚∶乙酸(70∶30∶1,v∶v∶v)。展层完毕从展层缸中取出层析板, 置于通风橱内吹干展层剂, 然后放置到含有一定量颗粒碘的烧杯中于37℃ 下显色5—10 min[14]。标准品甘油一硬脂酸酯(Monostearin)、甘油二硬脂酸酯(Distearin)和三油酸甘油酯(Glyceryl trioleate)购自Sigma公司。
1.4 藻株油脂积累分析
将处于对数生长期的眼点微拟球藻和加的斯微拟球藻接种到含400 mL f/2AW培养基(将氮浓度减少到500 μmol/L NaNO3)的500 mL三角瓶中, 在22℃、光强为60 μmol photons/(m2·s)的条件下通空气培养, 每天取样通过尼罗红染色[15]后, 用荧光分光光度计测定荧光强度, 以反映藻细胞中性脂含量的变化情况, 分析前以A730值为基准调整取样的体积。同时, 测定培养液的A730值和利用分光光度法(A220)检测NO3−的浓度[16]。培养10d后的藻细胞收集用于测定总脂含量及其脂肪酸组成。
1.5 总脂含量的测定及脂肪酸组成分析
6000 r/min离心收集藻细胞, 用灭菌ddH2O洗涤3次, 将收集的藻细胞液氮速冻后, 冷冻干燥备用。总脂的提取及定量参照文献[12]。称取100 mg干藻粉加入一定体积的氯仿∶甲醇 (1∶2) 溶剂萃取充分, 然后加入一定比例的灭菌ddH2O促使分层, 离心收集下层的氯仿层,转入已称重的称量瓶中, N2吹干有机溶剂, 然后用分析天平称重, 计算总脂的含量。
总脂甲酯化按如下步骤进行: 将一定量的总脂转移到1.5 mL Aglient 玻璃瓶中, 加入1 mL 1 mol/L的硫酸甲醇溶液, 充N2后密封, 于100℃反应1h。冷却后, 加入200 μL 蒸馏水, 混匀后, 以200 μL正己烷萃取3次, 合并有机相, N2吹干后定容至100 μL, 取1 μL 用Ultra Trace 气相色谱分析仪 (Thermo Scientific, United States)进行脂肪酸组成分析。
2 结果与讨论
对于户外培养, 特别是开放池培养而言, 培养基水分的蒸发导致培养液的盐度变化很大。因而, 在筛选具有应用前景的藻株时, 盐度的耐受性是必须考虑的重要因素之一。尽管微拟球藻属的种类多为海生, 但近年来的研究显示在淡水中也有广泛的分布[4], 而有些分离自河口的种类也能在淡水中生长。眼点微拟球藻尽管是海生类型,但在低盐度(4‰)下仍然生长良好[17], 我们的实验进一步显示, 尽管在淡水中该藻细胞的生长和叶绿素a含量要低于海水(P<0.01,t-test), 但仍然能够维持生长(图1)。本研究结果表明, 所有6株海生微拟球藻均能在淡水中生长, 从藻细胞叶绿素a含量看, 淡水培养的海生微拟球藻叶绿素的合成并没有受到明显抑制, 相反, 对于海洋微拟球藻PP983和加的斯微拟球藻而言, 淡水培养的藻细胞叶绿素相对含量超过(P<0.01,t-test)或接近(P>0.05,t-test)海水培养的藻细胞, 说明这两种微拟球藻即使在淡水中也能维持最适的生长状态。与此不同的是, 作为淡水的湖泊微拟球藻并不能够在海水中生长。
除在低盐度下生长良好外, 多数海生的微拟球藻还能耐受较高的海水盐度, 如眼点微拟球藻、加的斯微拟球藻和海洋微拟球藻PP983可耐受的最高盐度分别为: 54‰、42‰和54‰[10,17,18]。Lubián[19]的研究也显示加的斯微拟球藻、盐生微拟球藻和眼点微拟球藻具有较广的盐度耐受范围。由此可见, 除湖泊微拟球藻外, 微拟球藻属的海生种类对盐度变化均有较高的耐受性, 适于在户外进行开放式的培养, 特别是加的斯微拟球藻由于在淡水和海水均能维持较适的生长, 显示出较大的表型可塑性,因而, 具有良好的应用前景。

图 1 七株微拟球藻在f/2AW和BG11中培养7d后的A730值(A)及藻细胞相对叶绿素a含量(B)Fig.1 Growth (A730) and relative amount chlorophyll a of seven Nannochloropsis strains cultured for 7 day in f/2AW and BG11 medium
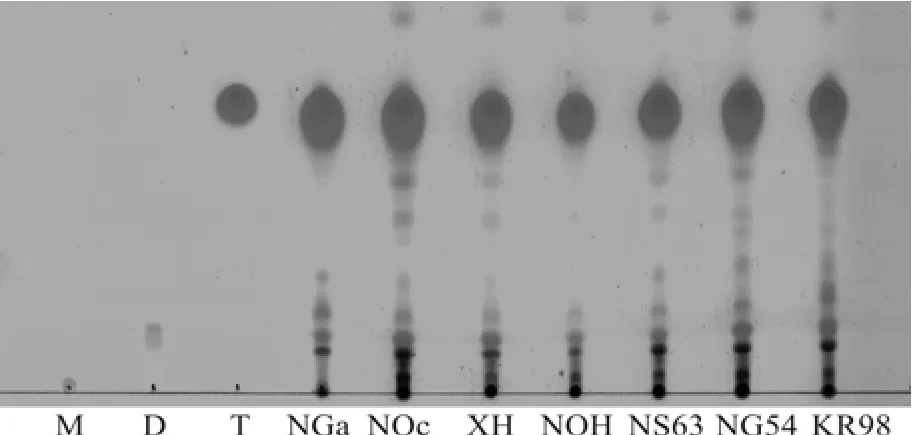
图2 七株微拟球藻总脂的硅胶板薄层层析图Fig.2 Comparison of lipid composition and content in Nannochloropsis species by thin layer chromatography
将7株微拟球藻在氮浓度相同的培养基中培养至稳定期(氮源被消耗完后约3d), 收集藻细胞后提取总脂进行薄层层析分析, 比较它们的中性脂含量及组成(图2)。薄层层析结果显示, 所有藻株均含有不同量的一酯、二酯和三酯, 其中甘油三酯的量最大。除海洋微拟球藻MBIC10090的甘油三酯量略低外, 其他6株微拟球藻细胞中含有的甘油三酯量相当。可见从油脂含量上看, 这些微拟球藻均可作为生产生物柴油的原料。与我们的研究不同, 李秀波等[20]在淡水微拟球藻中仅检测到了很低的甘油三酯含量, 这与他们所使用的BG11培养基具有较高的氮浓度有关, 因为同时收获低(882 μmol/L)和高(17.6 mmol/L)两种氮浓度下培养的海水和淡水微拟球藻会导致淡水微拟球藻的生长仍然处于氮丰富条件。
为了解批量培养条件下微拟球藻油脂积累的规律,我们以加的斯微拟球藻和眼点微拟球藻为对象, 通过尼罗红染色荧光分光光度法测定了藻细胞中的中性脂含量随培养时间的变化及其与培养基中氮浓度的关系(图3)。结果显示, 在培养的第6天, 培养液中的NO3−基本被消耗殆尽, 而藻细胞中的中性脂则在培养的第7天开始增加, 加的斯微拟球藻在缺氮后2d, 细胞的中性脂有明显增加的趋势, 且增加的幅度明显高于眼点微拟球藻。从生长上看, 2个藻株的比生长速率相当, 但加的斯微拟球藻的生物量要大于眼点微拟球藻。
许多研究表明, 对数生长后期藻细胞可开始积累油脂, 至稳定期积累的油脂可达到最大值[7,21]。尽管加的斯微拟球藻细胞中与甘油三酯合成相关的基因具有组成型表达的特性[10], 但我们的结果显示, 缺氮仍然可以显著促进藻细胞中性脂的积累, 这可能是氮缺乏导致其他代谢路径的改变, 从而促进了细胞脂质的合成。
将培养10d的加的斯微拟球藻和眼点微拟球藻收获用于分析藻细胞的总脂含量及其脂肪酸组成。表1显示两种微拟球藻的总脂含量均超过50%, 其脂肪酸组成以C16:0和C16:1为主, 两者之和占总脂肪酸的70%左右。此外, C14:0和C18:1两种脂肪酸约占15%—17%; 微拟球藻属中最主要的多不饱和脂肪酸EPA在两种藻中的含量约为8%—10%, 较低的EPA含量与培养基中的氮浓度和收获期有关, 氮限制或稳定期收获均导致多不饱和脂肪酸含量下降[22]。我们的结果显示, 尽管微拟球藻具有较高的多不饱和脂肪酸, 但在培养液缺氮数天后收获藻细胞,最终使得加的斯微拟球藻多不饱和脂肪酸含量不超过12%, 符合作为生物柴油原料的欧洲标准。
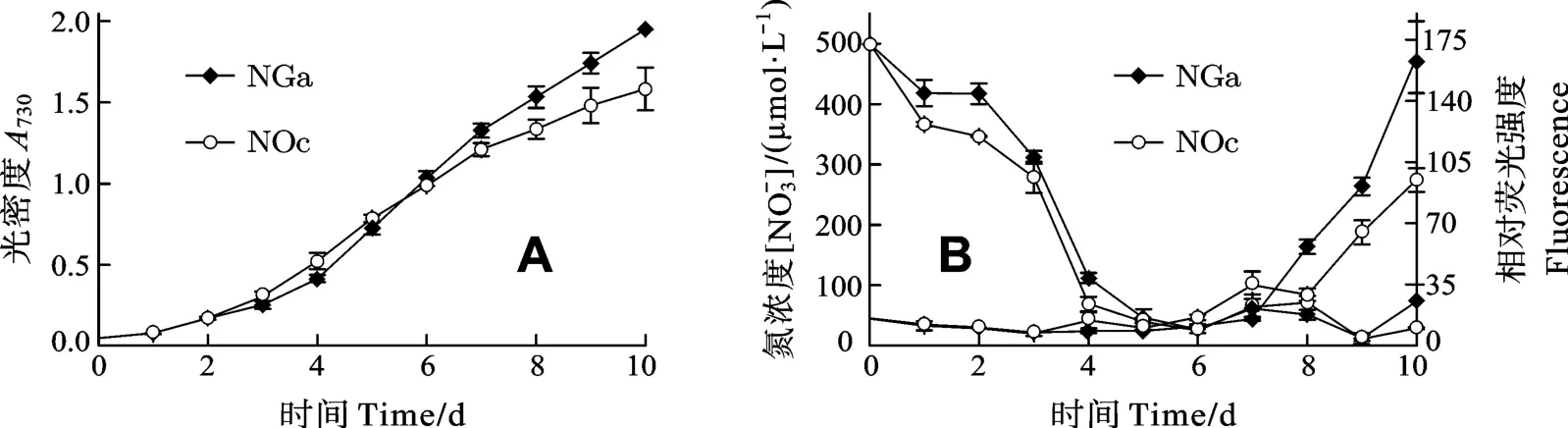
图 3 不同生长时期所对应的两种微拟球藻的细胞密度(A)、培养液NO3−浓度与尼罗红染色荧光强度(B)Fig.3 Cell density (A), NO3−concentrations in medium and oil content (B) of Nannochloropsis sp.cultured at different growth phase NOc.N.oculata; NGa.N.gaditana
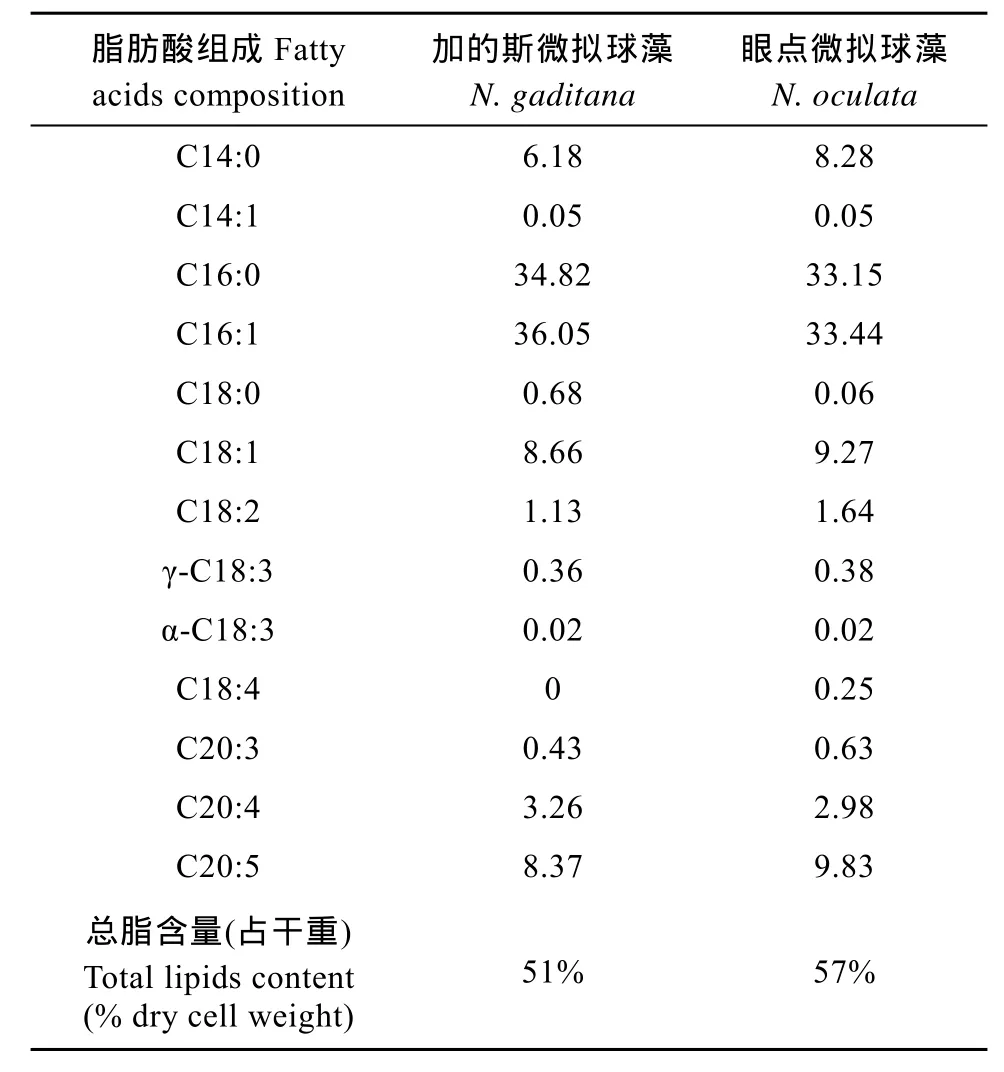
表1 加的斯微拟球藻和眼点微拟球藻的脂肪酸组成及其总脂含量(占藻细胞干重)Tab.1 Fatty acid composition (mol %) and total lipid content (% dry cell weight) of Nannochloropsis gaditana and N.oculata
本研究通过比较产油的7株微拟球藻对盐度的耐受及其油脂积累的规律, 综合多方面的特性, 发现加的斯微拟球藻具有较广的盐度耐受范围、高的生物量、高的中性脂含量、缺氮后油脂快速积累的能力及合适的脂肪酸组成, 因而, 是一种有应用前景的产油微藻, 在户外进行开放式培养, 可望成为低廉的微藻生物柴油原料。
[1] Hu H H.Method for determining phytoplankton pigments by high-performance liquid chromatography and diode array detector [J].Plant Physiology Communications, 2003, 39(6): 658—660 [胡晗华.测定浮游植物中色素的高效液相色谱与二极管阵列分光光度计联用的方法.植物生理学通讯, 2003, 39(6): 658—660]
[2] Hibberd D J.Notes on the taxonomy and nomenclature of the algal classes Eustigmatophyceae and Tribophyceae (synonym Xanthophyceae) [J].Botanical Journal of the Linnean Society, 1981, 82(2): 93—119
[3] Andersen R A, Brett R W, Potter D, et al.Phylogeny of the Eustigmatophyceae based upon 18S rDNA, with emphasis on Nannochloropsis [J].Protist, 1998, 149(1): 61—74
[4] Fawley K P, Fawley M W.Observations on the diversity and ecology of freshwater Nannochloropsis (Eustigmatophyceae), with descriptions of new taxa [J].Protist, 2007, 158(3): 325—336
[5] Sukenik A.Production of eicosapentaenoic acid by the marine eustigmatophyte Nannochloropsis [A].In: Cohen Z (Eds.), Chemicals from Microalgae [C].London: Taylor & Francis Press.1999, 41—56
[6] Rodolfi L, Chini Zittelli G, Bassi N, et al.Microalgae for oil: strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor [J].Biotechnology and Bioengineering, 2009, 102(1): 100—112
[7] Boussiba S, Vonshak A, Cohen Z, et al.Lipid and biomass production by the halotolerant microalga Nannochloropsis salina [J].Biomass, 1987, 12(1): 37—47
[8] Converti A, Casazza A A, Ortiz E Y, et al.Effect of temperature and nitrogen concentration on the growth and lipid content of Nannochloropsis oculata and Chlorella vulgaris for biodiesel production [J].Chemical Engineering and Processing, 2009, 48(6): 1146—1151
[9] Simionato D, Sforza E, Carpinelli E C, et al.Acclimation of Nannochloropsis gaditana to different illumination regimes: effects on lipids accumulation [J].Bioresource Technology, 2011, 102(10): 6026—6032
[10] Radakovits R, Jinkerson R E, Fuerstenberg S I, et al.Draft genome sequence and genetic transformation of the oleaginous alga Nannochloropsis gaditana [J].Nature Communications, 2012, 3: 686
[11] Parsons T R, Strickland J D H.Discussion of spectrophotometric determination of marine-plant pigments, with revised equations for ascertaining chlorophylls and carotenoids [J].Journal of Marine Research, 1963, 21(3): 155—163
[12] Bligh E G, Dyer W J.A rapid method of lipid extraction and purification [J].Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911—917
[13] Reiser S, Somerville C.Isolation of mutants of Acinetobacter calcoaceticus deficient in wax ester synthesis and complementation of one mutation with a gene encoding a fatty acyl-coenzyme A reductase [J].Journal of Bacteriology, 1997, 179(9): 2969—2975
[14] Yu E T, Zendejas F J, Lane D P, et al.Triacylglycerol accumulation and profiling in the model diatoms Thalassiosira pseudonana and Phaeodactylum tricornutum (Baccilariophyceae) during starvation [J].Journal of Applied Phycology, 2009, 21(6): 669—681
[15] Elsey D, Jameson D, Raleigh B, et al.Fluorescent measurement of microalgal neutral lipids [J].Journal of Microbiological Methods, 2007, 68(3): 639—642
[16] Collos Y, Mornet F, Sciandra A, et al.An optical method forthe rapid measurement of micromolar concentrations of nitrate in marine phytoplankton cultures [J].Journal of Applied Phycology, 1999, 11(2): 179—184
[17] Droop M R.Some new supra-littoral protista [J].Journal of the Marine Biological Association of the United Kingdom, 1955, 34(2): 233—245
[18] Hu H H.Studies on the characteristics of food microalgae and their relationships with varied CO2concentrations [D].Doctoral Dissertation of Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan.2008 [胡晗华.饵料微藻的特性及其与CO2浓度变化的关系研究.博士学位论文, 中国科学院水生生物研究所, 武汉.2001]
[19] Lubián L M.Nannochloropsis gaditana sp.nov., una nueva Eustigmatophyceae marina [J].Lazaroa, 1982, 4: 287—293
[20] Li X B, Xu X D, Kong R Q.Studies on the production of oil and polyunsaturated fatty acids in five species of Nannochloropsis [J].Acta Hydrobiologica Sinica, 2010, 34(5): 893—897 [李秀波, 徐旭东, 孔任秋.五种微绿球藻产油和产多不饱和脂肪酸的研究.水生生物学报, 2010, 34(5): 893—897]
[21] Bigogno C, Khozin G I, Boussiba S, et al.Lipid and fatty acid composition of the green oleaginous alga Parietochloris incisa, the richest plant source of arachidonic acid [J].Phytochemistry, 2002, 60(5): 497—503
[22] Hu H H and Gao K S.Response of growth and fatty acid compositions of Nannochloropsis sp.to environmental factors under elevated CO2concentration [J].Biotechnology Letters, 2006, 28(13): 987—992
STUDY ON THE SALINITY TOLERANCE AND OIL ACCUMULATION IN NANNOCHLOROPSIS
HUANG Wei-Chao1,2and HU Han-Hua1
(1.Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2.University of Chinese Academy of Sciences, Beijing 100049, China)
微拟球藻; 三酰基甘油; 生物柴油; 盐度耐受
Nannochloropsis; Triacylglycerols; Biodiesel; Salinity Tolerance
Q949.2
A
1000-3207(2013)02-0383-05
10.7541/2013.31
2012-03-21;
2012-12-07
国家重点基础研究发展计划项目(2011CB200901)资助
黄伟超(1986—), 女, 河北石家庄人; 硕士研究生; 主要从事藻类生物技术研究。E-mail: huangweichao88@126.com
胡晗华, E-mail: hanhuahu@ihb.ac.cn
