RNAi沉默Fascin基因表达对HEp2细胞株生物学特性的影响
2013-04-19孔静萍顾栋桦
孔静萍 顾栋桦
RNAi沉默Fascin基因表达对HEp2细胞株生物学特性的影响
孔静萍 顾栋桦
目的 通过RNA干扰HEp2细胞,研究Fascin基因表达对鳞癌细胞生物学特性的影响。方法用脂质体转染法把特异针对HEp2基因的双链小RNA干扰片段导入HEp2细胞中,Fascin mRNA及蛋白水平分别用RT-PCR和免疫印迹法检测,细胞增殖活性采用MTT法检测,细胞周期和凋亡水平采用流式细胞仪检测,肿瘤细胞的侵袭能力采用Matrigel体外细胞侵袭实验进行检测。结果RNA干扰能显著抑制Fascin mRNA及蛋白表达水平;RNA干扰Fascin基因的表达能使HEp2细胞增殖活性明显减低,更多的HEp2细胞处于G0/G1静止期,细胞凋亡明显增加,同时抑制了肿瘤细胞的侵袭能力。结论Fascin基因沉默能抑制HEp2细胞的生长和侵袭能力,并诱导细胞凋亡。
鳞癌 Fascin基因 RNA干扰

【 Abstract】 ObjectiveTo investigate the effect of Fascin gene on biological behavior of human laryngeal cancer cell line HEp2 by RNA interfering technique.MethodsFascin-targeted small interfering double-stranded RNAs(SiRNA)were transfected into HEp2 cells by lipofectamine.Fascin mRNA and protein levels were determined by reverse transcription-polymerase chain reaction(RT-PCR)and Western blot;cell proliferation viability was tested by MTT assay;cell cycle and apoptosis were examined by flow cytometry(FACS),tumor cell invasion ability was tested by matrigel invasion assay.ResultsRNA interference markedly inhibited the expression of Fascin mRNA and protein.Compared the parental HEp2 cells,the RNA interfered(RNAi)cells exhibited a slower rate of growth.FACS analysis revealed that cell cycle was arrested in the G0/G1phase and the apoptotic cell fraction was increased;the tumor cell invasion ability was inhibited significantly.ConclusionsFascin gene silencing suppresses the growth and invasion ability of HEp2 cells,and induces apoptosis.
Fascin是一种细胞骨架蛋白,能促进细胞膜的突起并增加细胞的运动能力。其在间叶及神经组织中表达较高,在成熟的上皮组织中表达低水平或缺失。在很多癌组织中,Fascin表达上调,且与肿瘤的侵袭、转移能力相关[1]。本实验通过小RNA干扰鳞癌细胞株HEp2 Fascin基因的表达,以此观察其对肿瘤细胞生物学特性的影响,探讨Fascin基因在肿瘤中的作用。
1 材料与方法
1.1 细胞与培养条件 HEp2细胞株(购于中科院细胞所)在37℃、5%CO2、饱和湿度的条件下用含10%胎牛血清的RPMI 1640培养基培养。
1.2 RT-PCR检测 Trizol试剂(上海生工公司)提取细胞总RNA,cDNA合成按M-MLV逆转录酶(美国Invitrogen公司)操作说明书进行,PCR扩增Fascin mRNA,并以3-磷酸甘油醛脱氢酶(GAPDH)作为内参照,引物由primer5.0软件设计,上海生工公司合成,Fascin引物:上游5′-AGG CGG CCA ACG AGA GGA AC-3′,下游5′-ACG ATG ATG GGG CGG TTG AT-3′,产物长度364bp;GAPDH引物:上游5′-AAC GGA TTT GG TCG TAT TG-3′,下游5′-GGA AGA TGG TGA TGG GAT T -3′,产物长度208bp;反应条件:95℃10min变性;再95℃ 30s,54℃ 1min,72℃ 1min,26个循环,72℃延伸10min。Taq酶为美国Promega公司产品,PCR产物经1.5%的琼脂糖电泳分离后,溴乙锭染色,紫外灯下观察。1.3 免疫印迹法 细胞生长至接近汇合,收集细胞,经PBS清洗后,加入细胞裂解缓冲液,提取总蛋白,蛋白定量按BCA试剂盒(美国Pierce公司)说明书进行。根据蛋白相对分子量选用合适浓度的胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)变性电泳。电泳完毕,将蛋白转移至聚偏二氟乙烯(PVDF)膜上,加入相应的一抗,37℃孵育1h,洗涤后加入过氧化物酶标记的二抗,37℃孵育1h,最后用ECL法试剂盒(美国Pierce公司)按产品说明书步骤显色。条带用Pro Analyzer4.0软件进行积分吸光度(IA)分析,以β-actin作为内参。一抗:小鼠抗人Fascin单克隆抗体(丹麦Dako公司)工作浓度1:500,鼠抗人β-actin单克隆抗体(美国Sigma公司),工作浓度1∶1 000;过氧化物酶标记的二抗购于上海鼎国公司,工作浓度1∶2 000。所有实验重复3次。
1.4 流式细胞仪检测(FACS) 收集对数生长期细胞,用冷柠檬酸缓冲液固定30 min,溴化丙啶染色后流式细胞仪检测细胞周期和凋亡情况,增殖指数(PI)=(S+G2/ M)/(G0/G1+S+G2/M)。实验重复3次。
1.5 MTT法检测细胞体外增殖 细胞消化后,按1 000个/孔密度接种于96孔板中,到待测时间点时按培养液量的10%加入5mg/ml的四甲偶氮唑蓝(MTT)溶液,继续培养4h后,用DMSO(上海生工公司)溶解并在酶联免疫检测仪(美国Molecular Devices公司)上读取吸光值(A),测定波长490nm,每个样本做4个复孔取平均值,实验重复3次。
1.6 RNAi沉默 Fascin mRNA的表达 特异针对Fascin基因(美国Santa cruz公司,商品号sc-35359)及非特异性阴性对照双链小RNA(SiRNA,美国Santa cruz公司)的转染方法按试剂说明书进行,简单描述如下:细胞生长于6孔板至60%~70%汇合,用无血清培液静止24h,5μl的SiRNA于5μl RNA干扰转染试剂(美国Santa cruz公司)混合于190μl的无血清的RPMI-1640培液,静置30min后滴加到培养皿中,孵育6h后,添加10%胎牛血清的培液继续孵育24h,用于实验;实验分组如下:转染了特异针对Fascin基因小RNA的HEp2细胞为RNA干扰组,转染了非特异性阴性对照双链小RNA的HEp2细胞为干扰对照组,由未添加任何RNA的RNA干扰转染试剂处理的HEp2细胞为未转染组。
1.7 Matrigel体外细胞侵袭实验 (1)取生长旺盛的HEp2细胞,用0.25%胰酶消化,经吹打、收集、离心,用含10%小牛血清的培养液配成1×105/ml的细胞悬液。按每室0.3ml接种于Matrigel侵袭腔的上层;在其下层加入含10%小牛血清的RPMI-1640培养液0.8ml。(2)37℃,5%CO2条件下培养24h,使细胞贴壁。(3)轻轻吸去上层培养液,加入含不同浓度去甲斑蝥素的培养液0.3ml,每一浓度复设3室,对照组加入等量不含药物的培养液,37℃,5%CO2继续培养72h。(4)取出滤膜,德克萨斯红染色,随机观察5个视野(×100),细胞计数,计算每个视野平均数。
1.8 统计学处理 采用SPSS11.5统计软件,计量资料采用表示,组间比较采用t检验。
2 结果
2.1 RNA干扰Fascin基因的效率鉴定 用特异针对Fascin基因的干扰序列能有效沉默Fascin基因的表达,Fascin干扰组中用PCR方法未检测出明显的Fascin mRNA的表达,而干扰对照组与未转染组均可见明显的PCR产物条带(图1);Fascin干扰组Fascin蛋白水平为未转染组的26.48%(P<0.01),Fascin干扰对照组与未转染组相比未见明显差异(P>0.05)(图2)。
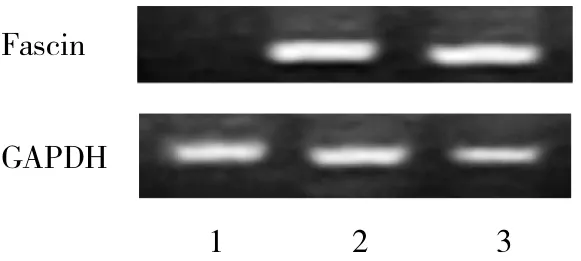
图1 RT-PCR电泳图(1:RNA干扰组,2:干扰对照组,3:未转染组,下同)
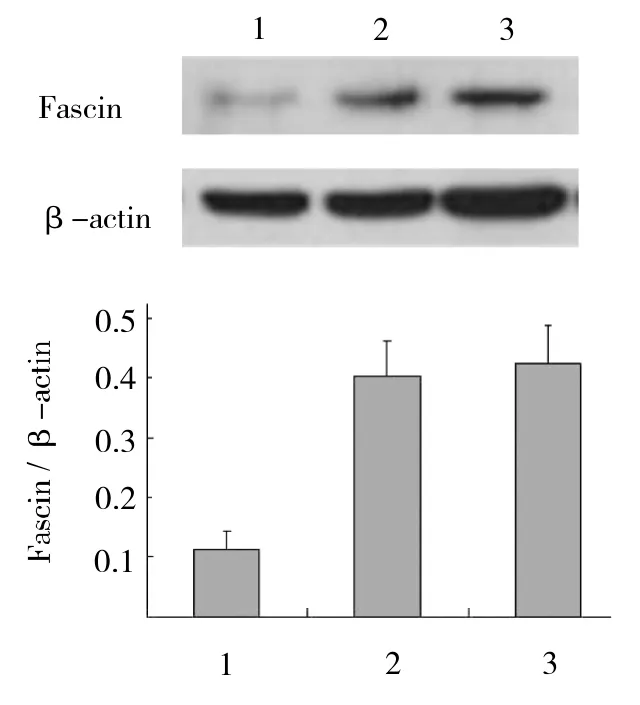
图2 Westernblot检测的柱状图
2.2 RNAi对HEp2细胞体外增殖能力的影响 通过双链小RNA靶向沉默Fascin基因的表达后,未转染组细胞生长到4d进入生长平台期,干扰对照组与未转染组之间未见明显差异,干扰组HEp2细胞体外增殖能力明显减弱,干扰组生长第2天开始,其吸光值(A)明显低于干扰对照组和未转染组(均P<0.01)(图3)。
2.3 RNAi对HEp2细胞的细胞周期和凋亡的影响 流式细胞仪检测结果显示(表1),RNA干扰Fascin基因的表达能使更多的HEp2细胞处于G0/G1静止期,增殖指数为0.35,明显低于未转染组和干扰对照组(均P<0.01),未转染组与干扰对照组未见明显差别(P>0.05)。而且RNA干扰组的细胞凋亡明显增加,高于未转染组和干扰对照组(均P<0.01),未转染组与干扰对照组未见明显差别(P>0.05)。
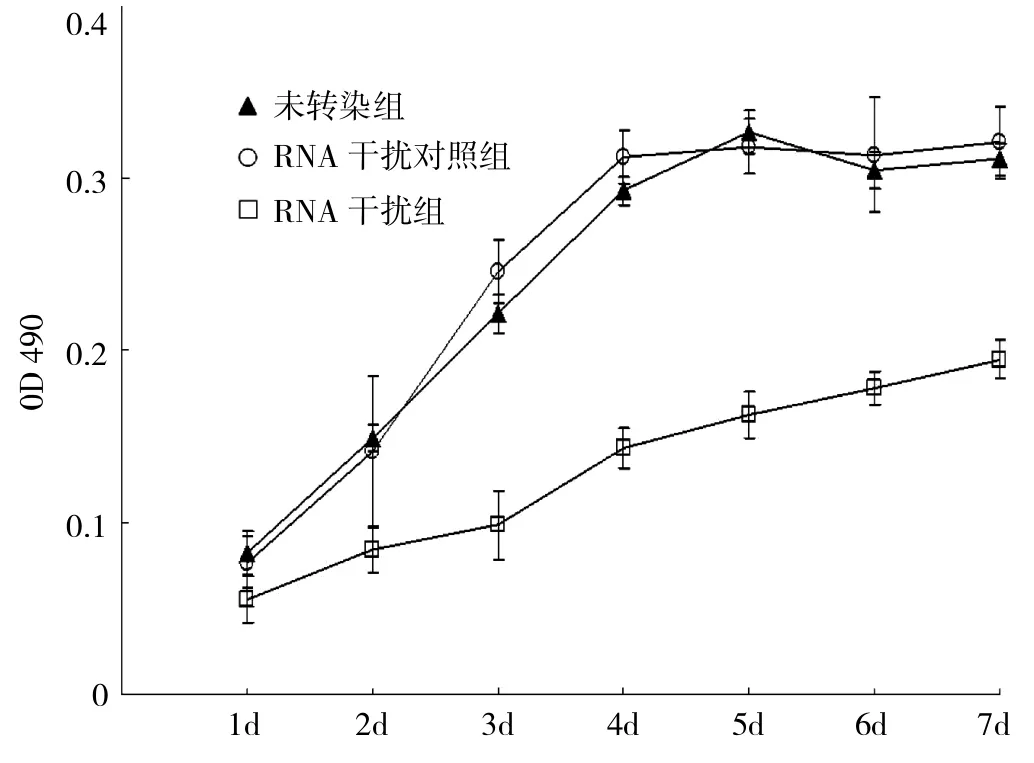
图3 MTT法检测细胞生长的折线图

表1 RNAi对HEp2细胞的细胞周期和凋亡的影响
2.4 RNAi对HEp2细胞体外侵袭能力的影响 细胞侵袭试验显示(图4),3组细胞均能够穿过铺有人工基质Matrigel的滤膜,RNA干扰Fascin基因的表达能够显著抑制HEp2细胞的侵袭能力,穿过滤膜的细胞数为(37.13±11.24),明显低于未转染组(133.02±21.87)和干扰对照组(142.15±23.16),差异有统计学意义(均P<0.01),未转染组与干扰对照组未见明显差别(P>0.05)。
3 讨论
肿瘤的发生、发展是一个多因素参与的、多步骤的复杂过程,目前已知许多基因在肿瘤的发生、发展过程中发挥重要作用,深入了解肿瘤发生机制是推动肿瘤预防和治疗发展的关键。Fascin蛋白是一种结构独特、进化保守的细胞骨架蛋白,可与F-肌动蛋白结合,定位于细胞质张力纤维和细胞膜皱褶边缘的丝状伪足、微棘的核心肌动蛋白束中,其可能在细胞迁移、粘附及信息传递中发挥重要作用[1]。
近年来的研究表明,Fascin在多种上皮源性的肿瘤细胞株中表达上调[1],而且在许多肿瘤组织中的表达明显增加,例如口腔鳞癌、肝癌、乳腺癌、卵巢癌等[2-5],说明其在上皮性肿瘤中的表达上调具有普遍性,并且临床研究显示其高表达与肿瘤的浸润程度、淋巴结转移、TMN分期及临床预后等因素相关,表明Fascin基因在肿瘤发生、发展过程中发挥重要的作用。
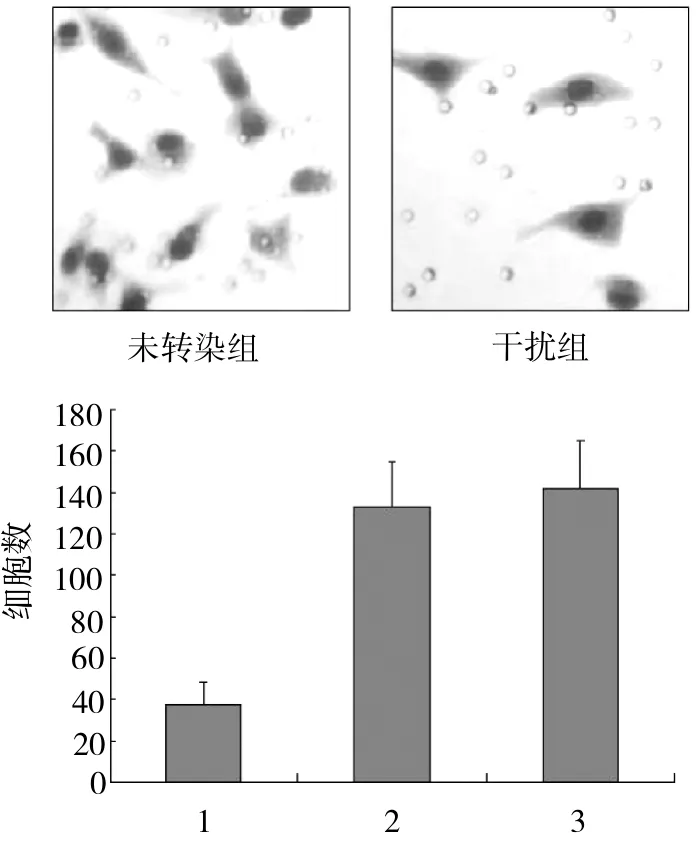
图4 Matrigel体外细胞侵袭实验的柱状图
本实验用小RNA干扰的方法来沉默Fascin基因的表达,来探讨其对鳞癌细胞株HEp2的细胞生物学特性的影响。用双链小RNA能够成功靶向沉默HEp2细胞株中Fascin基因的表达,RNA干扰后,肿瘤细胞的体外生长能力能够被明显抑制。流式细胞仪的检测结果显示,RNA干扰能使更多的肿瘤细胞停滞于G0/G1静止期,而且细胞凋亡也相应增加,说明这种对生长的抑制作用可能既与细胞周期的调控相关,也与促进细胞的凋亡有关。细胞侵袭实验显示沉默Fascin的表达,同样也可以抑制肿瘤细胞的侵袭能力,说明RNA干扰Fascin基因在一定程度上能够抑制鳞癌在体外的恶性表型,但其中具体的机制目前还不是非常明了。
许多研究报道Fascin作为一个细胞骨架蛋白同时还参与了细胞信号通路的调节,例如Fascin可以通过细胞黏附的改变而影响细胞的信号通路,影响肿瘤细胞的迁移和侵袭[6]。Alam等[7]的研究显示使口腔鳞癌细胞的Fascin基因过表达可以增强肿瘤细胞体内和体外的生长能力,并且这种促肿瘤的机制与MAPK和Akt信号通路的激活相关。乳腺癌的研究发现,Fascin可以下调乳腺癌转移抑制因子BRMS1的表达和向核内转位,从而增强肿瘤的侵袭转移能力[8]。因此,Fascin基因影响鳞癌细胞生物学特性的机制也可能与Fascin基因表达改变后,细胞内相关的复杂生物信号通路活性变化有关,但还需进一步深入研究。
本实验研究结果提示,运用RNA干扰的方法能有效下调Fascin基因表达,抑制肿瘤细胞体外生长能力和侵袭能力,这为将来鳞癌的分子生物治疗发展提供一定的借鉴。
[1] Machesky L M,Li A.Fascin:Invasive filopodia promoting metastasis[J].Commun Integr Biol,2010,3(3):263-270.
[2] 王德明,赵尔飏,吴衍昌,等.Fascin在口腔鳞癌中的表达及临床意义[J].口腔颌面外科杂志,2008,18(1):11-14.
[3] Huang X,Ji J,Xue H,et al.Fascin and cortactin expression is correlated with a poor prognosis in hepatocellular carcinoma[J].Eur J Gastroenterol Hepatol,2012,24(6):633-639.
[4] Xing P,Li J G,Jin F,et al.Fascin,an actin-bundling protein, promotesbreastcancerprogressioninvitro[J].CellBiochemFunct, 2011,29(4):303-310.
[5] Daponte A,Kostopoulou E,Papandreou C N,et al.Prognostic significance of Fascin expression in advanced poorly differentiated serous ovarian cancer[J].Anticancer Res,2008,28(3B): 1905-1910.
[6] Buda A,Pignatelli M.E-cadherin and the cytoskeletal network in colorectal cancer development and metastasis[J].Cell Commun Adhes,2011,18(6):133-143.
[7] Alam H,Bhate A V,Gangadaran P,et al.Fascin overexpression promotes neoplastic progression in oral squamous cell carcinoma[J].BMC Cancer,2012,12:32.Published online.
[8] Al-Alwan M,Olabi S,Ghebeh H,et al.Fascin is a key regulator of breast cancer invasion that acts via the modification of metastasis-associated molecules[J].PLoS One,2011,6(11):e27339.
Effect of FASCIN gene silencing on biologic behavior of HEp2 cells
Laryngeal neoplasm Fascin RNA interference
2012-11-20)
(本文编辑:杨丽)
315031 宁波市临床病理诊断中心(孔静萍);湖州市中心医院病理科(顾栋桦)
顾栋桦,E-mail:donghuagu@live.com
