不同手术时间对骨折愈合过程中VEGF表达的影响
2013-04-19董黎强尹航王维佳王昌兴胡伟锋
董黎强 尹航 王维佳 王昌兴 胡伟锋
不同手术时间对骨折愈合过程中VEGF表达的影响
董黎强 尹航 王维佳 王昌兴 胡伟锋
目的观察不同手术时间对实验大鼠骨折愈合过程中血管内皮细胞生长因子(VEGF)表达的影响。方法对192只大鼠股骨进行闭合骨折造模,在造模后第1、3、5、7、11、14天分别对骨折采取切开复位内固定手术,并在骨折后第1、3、5、7、11、14、21、35、49天对大鼠骨折端进行VEGF免疫组化染色观察,对其表达结果进行统计分析。结果手术操作干预了实验大鼠骨折愈合不同阶段VEGF的表达强度及表达时间。第7、11天手术组能较好地促进骨折端VEGF表达,且能持续更长时间,第14天手术组次之。第5天手术组仅在表达强度上高于未手术组,当天手术组与未手术组则无明显差别。而第3天手术组在骨折愈合的各阶段均处于较低水平,且低于未手术组。结论手术操作时机能影响实验大鼠骨折端VEGF的表达,可能导致二次损伤加速现象,但最佳手术时机在第1~2周时段,骨折后几天内即进行手术操作可能不利于骨折的愈合。
骨折愈合 血管内皮细胞生长因子 手术时间

【 Abstract】 ObjectiveTo observe the effect of time interval of operation on the expression of vascular endothelial growth factor(VEGF)in bone during fracture healing in rats.MethodsClosed femoral fracture was induced in 192 Wistar rats.The fracture was treated with open reduction and internal fixation operation at 1,3,5,7,11 and 14d after fracture.The expression of VEGF in fracture end at different time points(d1,3,5,7,11,14,21,35 and 49)were detected with immunohistochemical staining.ResultsThe expression of VEGF was strongest and last longer in rats operated at d7 or d11 after fracture,followed by those operated at d14.The expression intensity was higher in rats operated d5 after fracture than those without operation.There was no difference in VEGF expression between rats operated at d1 and non-operated rats;while rats operated at d3 presented low VEGF expression at all time points of fracture healing,which even lower than that in rats without operation.ConclusionThe results suggest that the optimal timing of surgery may be within the 1~2 weeks after fracture.
目前,随着接骨学的发展,骨折的治疗与手术切开复位内固定之间存在着密不可分的关系。调查表明,手术治疗的患者发生骨不连的概率比保守治疗的患者高出4倍[1]。通常人们会笼统的认为手术切开会过多地剥离骨膜损伤局部血供,对于骨折愈合是一个不利因素,但很少有人从手术的时机上加以考虑。我们在临床工作中发现一些过早手术的患者骨折端出现了骨愈合不良或骨不连接,而适当延迟手术的患者反而愈合得更好。由此我们认为手术治疗的效果不仅仅与局部的血运有关,而且还与手术时机有着密切的关联。因此,我们进行了本项实验,期望对骨折二次损伤加速现象的分子生物学基础作一初步的研究,并对骨折最佳手术时间作进一步探索。
1 材料和方法
1.1 实验动物 选用Wistar大鼠192只,体重220g左右,由浙江中医药大学动物实验中心提供。饲养条件一致,室温(24±2)℃,标准饲料(由南京安立默科技有限公司生产),自由摄食、饮水。全部动物经适应性喂养1周以上无异常后开始正式实验。
1.2 主要实验仪器 改良的Einhorn造模支架;LEICA RM2035型切片机;全自动脱水机;Olympus BX50荧光显微镜;IPP计算机真彩图像分析系统;即用型SABC试剂盒(武汉博士德生物工程有限公司产品)。
1.3 方法
1.3.1 制作闭合骨折模型 将192只大鼠用10%戊巴比妥钠腹腔内按40mg/kg注射,麻醉后取右下肢髌骨内侧切口纵行切开,将髌骨牵向外侧使之脱位,暴露股骨髁间凹。逆行插入克氏针(直径1mm),从大转子及皮肤穿出,克氏针远端埋于股骨髁间骨皮质下,近端紧贴大转子将尾部折弯,多余部分剪除后逐层闭合切口。将动物右下肢外展内旋位固定于闭合骨折模型打击器的铁砧凹槽上(铁砧凹槽间距为15mm),造模支架中柱下端的骨刀压于大腿中部,助手提起500g的砝码至20cm处,让其自由落体撞击中央钢板[2],致股骨中段骨折。术后立即在麻醉状态下拔出克氏针,用拇指和示指按摸骨折端,了解骨折类型,要求骨折类型为股骨中段横行及短斜形骨折。造模不合格的大鼠予以剔除,并及时补充。1.3.2 动物分组及闭合骨折开放复位内固定操作 将符合条件的192只已制作闭合骨折模型的大鼠采用完全随机法分为以下7组:未手术组A,36只;骨折后第1天(当天)手术组B,36只;骨折后第3天手术组C,32只;骨折后第5天手术组D,28只;骨折后第7天手术组E,24只;骨折后第11天手术组F,20只;骨折后第14天手术组G,16只。
1.3.3 各组不同处理 造模后A组在骨折后8h、第3、5、7、11、14、21、35、49天各时间点以断颈法处死4只大鼠并观察。
B组在骨折后即行骨折端切开复位内固定术。具体操作如下:用10%戊巴比妥钠腹腔内按40mg/kg注射麻醉,起效后俯卧位,备右后肢皮肤。常规消毒铺巾,行右股骨后外侧切口,分离皮下组织和右后侧肌间隙,显露股骨中段骨折端,保护骨膜,骨折端复位。切开膝关节关节囊,暴露股骨内外侧髁,于髁间倒置入直径l.5mm的克氏针,固定骨折断端。缝合切口,纱布包扎。术后3d青霉素注射防止感染。在术后8h、第3、5、7、11、14、21、35、49天各时间点以断颈法处死4只大鼠并观察。
C组在骨折后第3天行骨折端切开复位内固定术。具体操作同B组。在术后8h、第3、5、9、12、19、33、47天(即骨折后第3、5、7、11、14、21、35、49天)各时间点以断颈法处死4只大鼠并观察。
D组在骨折后第5天行骨折端切开复位内固定术。具体操作同B组。在术后8h、第3、7、10、17、31、45天(即骨折后第5、7、11、14、21、35、49天)各时间点以断颈法处死4只大鼠并观察。
E组在骨折后第7天行骨折端切开复位内固定术。具体操作同B组。在术后8h、第5、8、15、29、43天(即骨折后第7、11、14、21、35、49天)各时间点以断颈法处死4只大鼠并观察。
F组在骨折后第11天行骨折端切开复位内固定术。具体操作同B组。在术后8h、第4、11、25、39天(即骨折后第11、14、21、35、49天)各时间点以断颈法处死4只大鼠并观察。
G组在骨折后第14天行骨折端切开复位内固定术。具体操作同B组。在术后8h、第8、22、36天(即骨折后第14、21、35、49天)各时间点以断颈法处死4只大鼠并观察。
1.4 观察指标
1.4.1 取材 各组大鼠处死后,以骨折端为中心,取下长度为1cm完整保留外骨膜以及骨痂的骨组织。
1.4.2 血管内皮细胞生长因子(VEGF)免疫组化染色观察 立即将骨组织经10%的中性福尔马林液固定,蒸馏水冲洗后,置入5%乙二胺四乙酸(EDTA)液中脱钙10~15d。脱钙成功后取材,冲水24h,脱水,石蜡包埋,5μm厚连续切片。切片进行VEGF免疫组化染色,二氨基联苯胺(DAB)方法显色,阳性为棕色。用计算机彩色图像分析系统测定骨痂中VEGF含量。显微镜下放大400倍,每个标本随机取5个视野,作阳性表达计数,以5个视野计数均值作为各标本VEGF表达的计量指标,结果进行统计学处理。
1.5 统计学处理 采用SPSS 13.0统计软件,计量资料采用表示,组间比较采用t检验。
2 结果
2.1 各组大鼠VEGF表达的数值曲线 见图1。

图1 各组大鼠骨折端VEGF阳性染色细胞数量变化曲线图
由图1可见,A、B、C、D组VEGF表达的数值曲线在骨折后第14天达峰值,之后逐渐下降,E、F、G各组VEGF表达的数值曲线在骨折后第14、21天时进一步上扬,在第21天时达峰值,之后逐渐下降。在第35天时各组仍有一定的VEGF表达,E、F、G组较为明显。2.2 各组大鼠骨折端VEGF阳性免疫组化染色细胞计数比较 见表1。
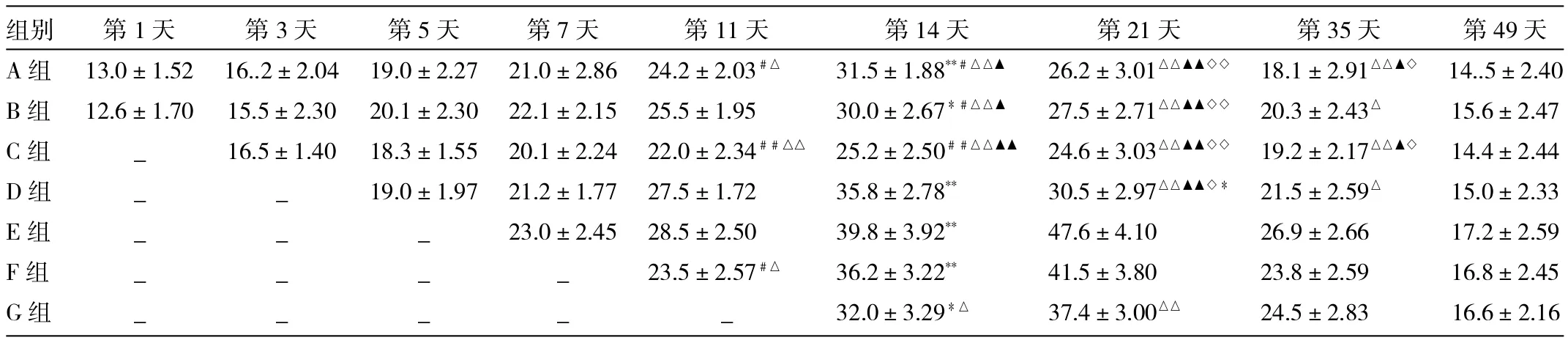
表1 各组大鼠骨折端免疫组化VEGF阳性染色细胞计数比较
由表1可见,在第14天时,D、E、F组VEGF表达>A、B、G组>C组,差异均有统计学意义(P<0.05或0.01));在第21天时,E、F、G组VEGF表达>D>A、B、C组,差异均有统计学意义(P<0.05或0.01);在第35天时,E组VEGF表达>F、G>A、B、C、D组,差异均有统计学意义(P<0.05或0.01);第49天时,随着骨折渐趋愈合,各组仅有少量VEGF表达,组间比较差异无统计学意义。
3 讨论
骨折修复是一个极其复杂的过程。血管形成,恢复骨折端供血是骨折修复的前提。VEGF是功能最强大的血管生成调节因子,通过与血管内皮细胞膜上的受体结合,特异性的促血管内皮细胞增生和血管生成[3]。血管生成对骨折段供氧、提供营养物质、运输代谢废物起到举足轻重的作用,为局部骨再生及代谢提供了有利的微环境。Spector等[4]发现VEGF对体外培养的成骨细胞无增殖的作用,但能引发成骨细胞的迁移及分化,且引起成骨细胞迁移及分化所需的浓度比BMP-2还低100倍。另有研究表明在软骨内化骨,特别是在骨形成偶合软骨吸收的过程中,VEGF对原始成骨细胞有趋化迁移作用,对骨的形成和重建有功能性的作用[5]。Connoly[6]指出:骨折愈合完全依靠血管再形成过程,评价骨折愈合过程完全依靠血管再形成过程。因此,我们选用VEGF指标进行检测,对于了解不同手术时间对骨折愈合过程的影响具有重要意义。
本实验结果提示表明,E、F、G组的VEGF表达明显强于A、B、C、D各组,且持续时间更长,其中E>F>G组,D组虽差于E、F、G组,但略优于A、B组,C组表现则最差。因此,各组骨折愈合过程中VEGF表达程度粗略排名显示为:E>F>G>D>B=A>C组。由此我们可以得出结论:手术操作干预了实验大鼠骨折愈合不同阶段VEGF的表达强度及表达时间。但并不是在任何时间点采取手术操作均是有益的,我们认为第7天手术组最能促进骨折端VEGF表达,且能持续更长时间。第11天手术组也能较好地促进骨折端VEGF表达,并能持续较长时间,第14天手术组次之。而第5天手术组仅在表达强度上高于自然愈合的未手术组,当天手术组与未手术组则无明显差别,未表现出明显促进骨折端VEGF表达的作用。而第3天手术组在骨折愈合的各阶段均处于较低水平,且低于未手术组。
研究表明,骨折后1周内,骨折局部因创伤导致血流中断,VEGF表达量较弱,随着骨折的修复,肉芽组织的增长加快,血供相对减少,氧分压降低,低氧状态强烈诱导VEGF的表达。大约在骨折后2~3周,VEGFm-RNA表达量达到高峰,而此时恰为软骨细胞合成期。VEGF在软骨内成骨过程中协调着软骨细胞向骨细胞的转化[7-9]。我们推测在术后几天内即对骨折端进行手术操作可能加重创伤,破坏骨膜的血管,导致血流中断加剧,从而进一步减少VEGF的表达。在1~2周时段,骨折端肉芽生长明显,骨膜增厚,尽管手术操作时适当地切开了骨膜,但对骨折端血流破坏较少,而且延长了炎症期,促进了局部毛细血管的生成,使局部的血运得以进一步加强,从而有利于骨折的愈合,而这一切的发生与VEGF的分泌是紧密相关的。
综上所述,我们认为骨折后采取手术操作能影响实验大鼠骨折端VEGF的表达,可能导致二次损伤加速现象,但最佳手术时机在1~2周时段,骨折后几天内即进行手术操作可能不利于骨折的愈合。
[1] Joseph A B,Thomas A E,Sheldon R S,主编.骨科基础科学[M].2版,北京:人民卫生出版社,2001:321-360.
[2] 周晓中,董启榕,张健.大鼠股骨闭合骨折模型的制作[J].东南大学学报(医学版),2007,26(1):60-62.
[3] Millauer B,Wizigmann Voos S,Schnurch H,et al.High affinityVEGF binding and developmental expression suggest Flk21 as a major regulator of vasculogenesis and angiogenesis[J].Cell, 1993,72:835.
[4] Spector J A,Mehrara B J,Greenwald J A,et al.Osteoblast expression of vascular endothelial growth factor is modulated by the extra cellular microenvironment[J].Am J Physiol Cell Physiol, 2001,280(1):C72.
[5] Mayr2Wohlfart U,Waltenberger J,Hausser H,et al.Vascular endothelial growth factor stimulates chemotactic migration of primary human osteoblasts[J].Bone,2002,30(3):472.
[6] Connolly J F.Injectable bone marrow preparations to stimulate osteo-genic repair[J].Clin Orthop Relat Res,1995,313(4):8-18.
[7] Kaspar D,Neidlinger-Wilke C,Holbein O,et al.Mitogens are increased in the systemic circulation during bone callus healing [J].J Orthop Res,2003,21:320-325.
[8] Park S H,O'Connor K M,McKellop H A.Interaction between active motion and exogenous transforming growth factor Beta during tibial fracture repair[J].J Orthop Trauma,2003,17:2-10.
[9] Szczesny G.Molecular aspects of bone healing and remodeling [J].Pol J Pathol,2002,53:145-153.
Time interval of operation on VEGF expression in bone during fracture healing
Fracture healing Vascular endothelial growth factor Operative time
2012-10-23)
(本文编辑:田云鹏)
浙江省教育厅科研项目(20050869)
工作单位:310005 杭州,浙江中医药大学附属第二医院骨一科(董黎强、尹航、王昌兴、胡伟锋);浙江中医药大学骨伤教研室(王维佳)
董黎强,E-mail:dlq58@126.com
