具有抗肿瘤活性的几类中药结构修饰研究进展*
2013-04-18吕东峰王国成
吕东峰,王国成,汤 宇,杨 慧
(1. 内蒙古医科大学药学院,呼和浩特 010110; 2.天津天士力化学药物研究所,天津 300402)
一些中药对肿瘤具有直接或间接的杀伤作用,如诱导肿瘤细胞凋亡、抑制肿瘤血管的生长等,并且具有作用时间持久、多靶点、多途径、毒副作用低等优点,对于提高肿瘤患者的治疗成功率及改善肿瘤病人的生存质量、延长生命等方面都有显著效果。国内外对中药抗肿瘤作用的研究也越来越多,如萘醌类化合物、生物碱类化合物、五环三萜类化合物等。但是一些中药在肿瘤治疗中还存在溶解性差,毒副作用大,抗肿瘤活性低等缺点。针对中药的这些不足,利用现代科学技术对已知中药有效成分进行化学修饰,得到溶解性好,生物活性高的衍生物,以供研制新型的抗肿瘤药物。本文主要对目前研究热点的中药抗肿瘤活性进行总结,并对部分药物再修饰做一介绍。
1 具有抗肿瘤活性的中药以及结构改造
1.1天然来源萘醌类化合物天然来源萘醌类化合物主要分布在高等和低等植物中,少量经过天然产物修饰得到。萘醌类化合物具有抗肿瘤活性,并且具有天然、高效、低毒等特点,受到研究者的关注。其抗肿瘤作用主要体现以下几个方面:抑制DNA拓扑异构酶的活性[1]、诱导肿瘤细胞凋亡[2]、抑制蛋白酪氨酸激酶[3]、影响肿瘤分裂细胞周期和增殖[4]、直接的细胞毒作用[5]和抑制肿瘤细胞的黏附转移增殖等[6]。
白花丹素化学名称为5-羟基-2-甲基-1,4-萘醌,具有显著药理活性,其药理活性主要表现在抗癌、抗菌、抗氧化等,其来源主要从白花丹植物中分离得到,并由此而命名,其化学结构如图1。
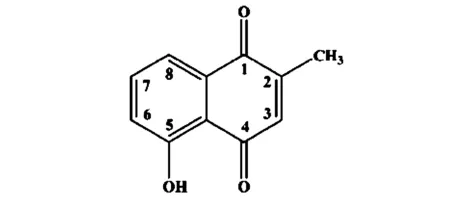
图1 白花丹素结构式
中国台湾研究者lin等[7]对白花丹素进行了体外抗肿瘤活性研究,结果显示,其对Hela、Wish、Raii和Calu-1等4种肿瘤细胞株的生长抑制作用较好,IC50(半数抑制浓度)均在25.0 nm/ml以下。另有研究发现,白花丹素可抑制P 388淋巴白血病癌细胞的生长,可诱导子宫癌细胞ME-180的凋亡,可能原因是其刺激了ME1-80细胞内活性氧的产生,损伤了线粒体,使膜电位下降,从而引起该细胞的凋亡[8]。
白花丹素具有上述显著的药理活性,但是其毒性大、水溶性差,制约了其作为抗肿瘤药物的发展。梁宏等[9]以白花丹素为活性母核,通过糖基化反应,合成白花丹素-5-0葡萄糖,其水溶性较白花丹素显著提高,有效解决了白花丹素作为潜在抗肿瘤药物的水溶性欠佳的问题。其化学结构式见图2。在研究中可以寻找一些活性较好的集团,对白花丹素结构进行修饰,以期得到良好活性的先导化合物,进一步应用于药品研发中。
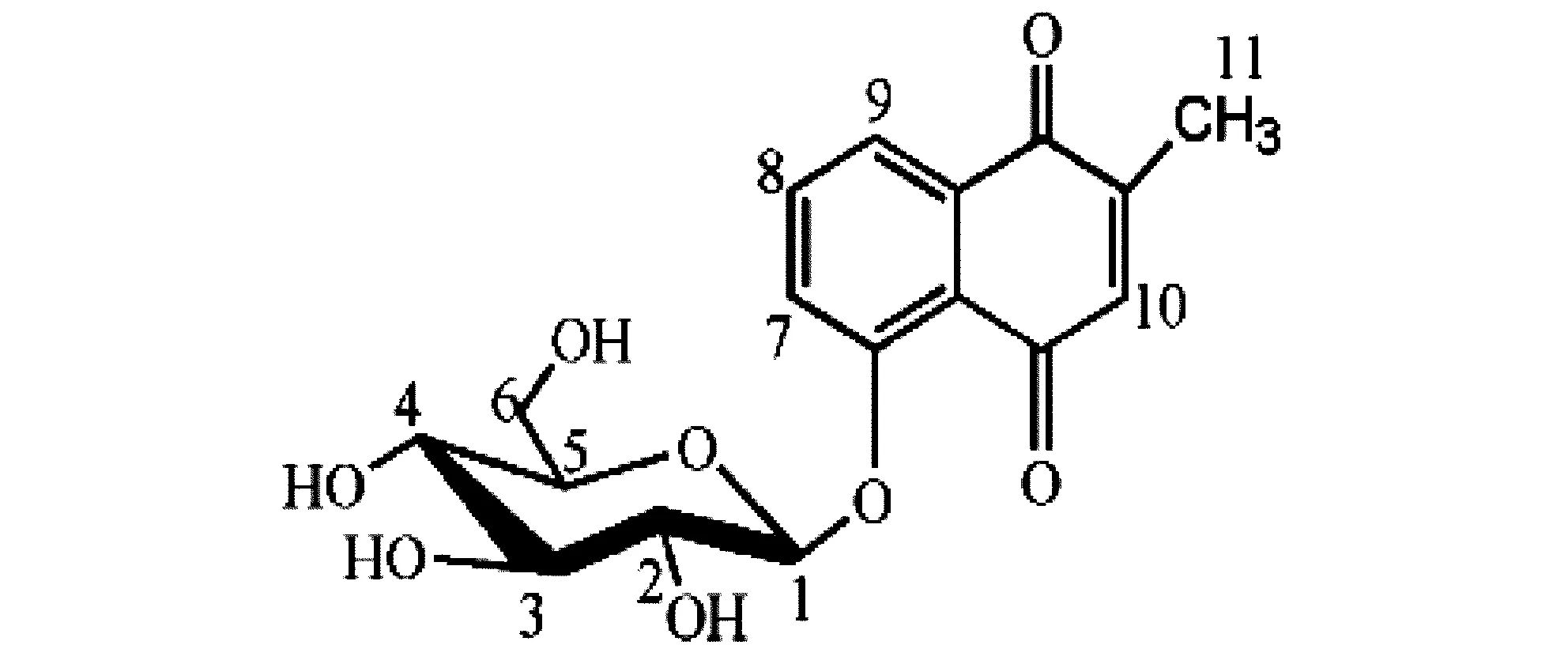
图2 白花丹素-5-0葡萄糖结构式
1.2生物碱类化合物生物碱是中草药、生物及海洋生物中抗肿瘤的主要活性成分。其植物中常与有机酸结合成盐而存在,还有少数以糖苷、有机酸酯和酰胺的形式存在[10]。许多天然生物碱成分均显示出良好的抗肿瘤活性,如紫杉醇类生物碱、长春碱类、苦参类生物碱、喜树碱类等。其主要作用机制有以下两个方面:抗微管解聚[11]、抗微管聚合和抑制拓扑酶Ⅰ[12]。生物碱类是一类非常有开发前景的药物,目前已经成功开发了几种药物。但有关该类药物的疗效还存在不足,可以通过结构修饰得到更优秀的衍生物以便应用于以后的药品研发中。
喜树碱(camptothecin)和羟基喜树碱(hydroxylcamptothecin)是从中国特有的珙桐科植物喜树(campotheca acuminate)中提取出来的生物碱,其由中氮茚并[1,2-b]喹啉碎片与六元-羟基内酯稠合组成的五环刚性结构,带有-羟基的20位碳为非对称,其赋予分子旋光特性。喜树碱通过选择性作用DNA拓扑异构酶I(Top I)[13],阻止癌细胞复制而发挥抗癌作用。但因溶解性差、毒副作用大而使其应用受到限制。从其分离出以后的近40年中,全世界先后合成了上百种新的喜树碱衍生物和类似物,从中筛选出多种药效好、毒副作用小和溶解性能好的喜树碱类抗癌新药。其中伊立替康(irinotecan)、拓扑替康(topotecan)已被批准用于实体癌的治疗,其他衍生物如9-硝基喜树碱、9-氨基喜树碱等多种处于临床试验的新药有可能在今后几年内陆续上市[14]。喜树碱结构见图3。
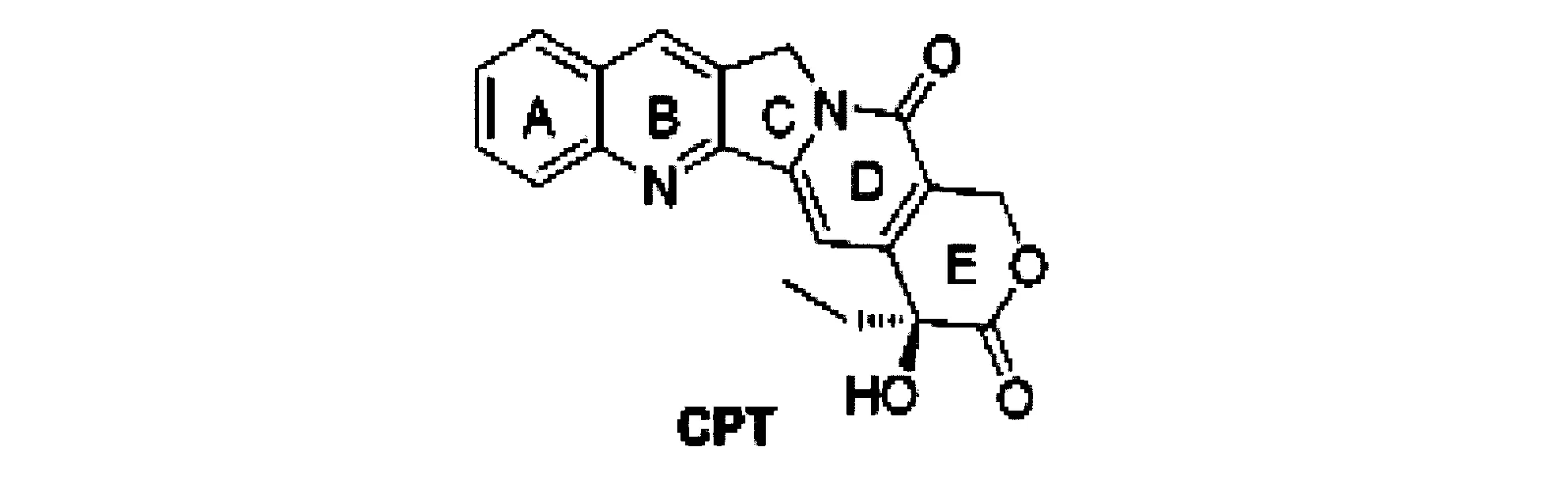
图3 喜树碱结构式
虽然大量研究表明喜树碱类化合物具有高效、广谱、选择性好等众多优点,然而喜树碱仍然有体内代谢不稳定、水溶性低、毒性作用、种属差异等缺点。为提高喜树碱类化合物在体内的稳定性,以增强活性,研究者[15]将20-位羟基酯化成前药,这样就可以有效地阻止20位羟基与相邻的羰基分子内氢键的形成而抑制内酯环水解,合成喜树碱E环类似物。E环类喜树碱类似物相比于喜树碱来说,体内代谢稳定性大大提高,但是部分化合物在临床研究中发现了不同程度的毒副作用,以致影响了该类药物的进一步开发。如对喜树碱关键E环进行进一步的结构修饰改造,可能会发现活性更优、代谢稳定性好、毒副作用更小的喜树碱类抗肿瘤候选药物。有研究者[14]发现新的化合物10-羟基喜树碱衍生物,能够提高喜树碱类化合物的脂溶性,通过抗肿瘤生物活性体外筛选试验,表明该化合物具有对肿瘤细胞株生长活性抑制作用,其结构见图4,其中X、Y为取代基团。
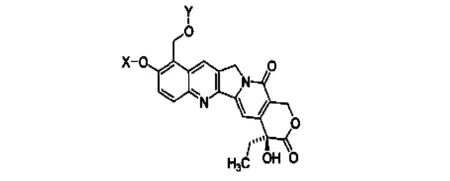
图4 10-羟基喜树碱衍生物结构式
喜树碱类衍生物在抗肿瘤治疗中已得到广泛应用,虽常伴随有不良反应的发生[16],相信随着对其构效关系及作用机制的不断研究,将有更多更有效的喜树碱类衍生物会成为抗癌的一线药物。
1.3五环三萜类化合物五环三萜类化合物(pentacyclic triterpenoids)是一类广泛存在于自然界中菌类、蕨类、单子叶、双子叶植物和动物及海洋生物中,是植物内产生的次级代谢产物,具有较强的生物活性,包括抗肿瘤、抗炎、抗菌、抗病毒、护肝、抗心律失常、免疫调节、调节血糖和降血压等方面的功效[17]。其中抗肿瘤活性的研究是个热点。五环三萜类化合物类型较多,主要有齐墩果烷(oleanane)型﹑乌苏烷(ursane)型、羽扇豆烷(lupane)型和木栓烷(friede-lane)型。齐墩果烷型的代表物为甘草酸(glycyrrhizic acid,GA)。
甘草次酸又名甘草亭酸,化学名为3β-羟基-11-氧代-齐墩果型-12-烯-30-酸,分子式为C30H46O4,白色晶体,熔点289~291℃。GA是甘草酸的苷元,其广泛分布于植物界,以游离形式或多与糖结合形成苷的形式存在。研究表明,GA具有抗病毒、抗肿瘤、抗溃疡、抗炎、抗肝毒素以及调节免疫功能等生理活性,同时还抑制肿瘤细胞的增殖、侵袭,能诱导细胞凋亡[18],对肿瘤细胞表现出较强的细胞毒活性,甘草次酸对胃癌、肝癌、乳腺癌、黑色素癌等多种恶性肿瘤均有抑制作用[19,20]。甘草次酸化学结构式见图5。
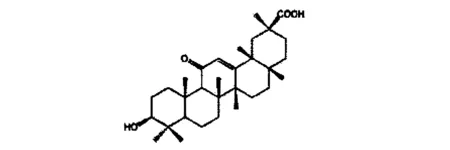
图5 甘草次酸结构式
甘草次酸成本低廉,来源丰富,其对于正常体细胞呈现较低毒性,深入研究甘草次酸抗肿瘤作用机理将为研发高效低毒的抗肿瘤药物提供新的思路。有研究者[21]对甘草次酸进行结构修饰得到新型甘草次酸修饰物,其中一类结构式见图6,其中R1、R2、R3是各种取代基团。此甘草次酸修饰物具有抗肿瘤活性,对人体宫颈癌Hela细胞、人肝癌HepG2细胞和人胃癌BGC-823细胞具有一定的抑制作用。五环三萜类化合物存在很大的潜质,进一步开发成高效而低毒的抗肿瘤药物,可以通过对现有的五环三萜化合物进行必要的结构修饰,将其修饰成符合癌症治疗的高效、低毒的目标的抗癌药物。
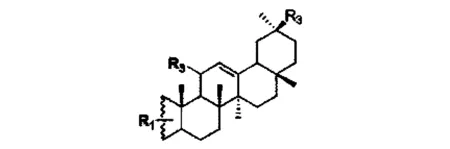
图6 甘草次酸修饰物结构式
恶性肿瘤是威胁人类健康的重大疾病之一,目前临床上治疗恶性肿瘤主要有三种方式:药物化疗、放射治疗、外科切除。运用中药治疗恶性肿瘤是当今研究的热点,虽然中药的成分复杂,有效成分不明确,作用机制复杂,但是把中药与现代科学技术有机的结合起来,通过化学结构的再修饰,改变中药的水溶性差、毒副作用强、抗肿瘤活性低等缺点,以便应用于抗肿瘤新药的开发。
1罗志国, 冯奉仪.新型抗肿瘤药物拓扑异构酶抑制剂沙尔威辛的临床前研究[J].中国新药杂志, 2005, 14 (2) : 762
2崔越宏, 刘天舒, 董武, 等.紫草素抑制胃癌细胞增殖、黏附及诱导凋亡[J].中国临床药学杂志, 2006, 15 (6) : 353
3Lam son D M , P laza S M .The anticancer effects of vitam in K[J].Altern Med Res, 2003, 8 (3) : 303
4Hsu Y L , Cho C Y, Kuo P L ,etal.Plumbagin(5-hydroxy-2-methyl-1,4-naph thoquinone ) induces apop to sis and cellcycle arrest in A 549 cells th rough p53 accumulation via c-JunNH2-term inal k inase-mediated phosphory-lationat serine 15in vitro and in vivo [J].Pharmacol ExpTher, 2006, 318(2) : 484
5Kundakovic T, Fok ialakis N , Dobric S,etal.Evaluation of the antiinflammato ry and cyto toxic activities of naphthazarine derivatives from Onosm a lep tantha [J].Phytom edicine,2006, 13 (4) : 290
6王艳红, 刘银坤, 叶胜龙,等.维生素K2对人肝癌细胞的抗黏附和抗侵袭作用[J].中华肿瘤杂志, 2004, 26 (12) : 220
7Lin L C,Yang L L,Chou C J.Cytotoxic naphihoquinones and plumbagic acid glucosides form Plumbago zeylanica[J].Phytochemistry,2003,62:619
8Srinivas P,Gopinath G,Baneqi A.Plumbagin induces reactive oxygen species which mediate apoptosis in human cervical cancer cell[J].Molecular carcinogennesis,2004,40:201
9广西师范大学.白花丹素-5-0-葡萄糖及其合成方法和应用[P].中国:201210108732.32,2012-08-01
10Cheng L, Zhou X J. Review on anticancer mechanism of some plant alkaloid[J]. Chinese Herbal Medicines,2004,35(2):216
11汪洪武, 汤敏燕, 孙凌峰.具有抗肿瘤活性的生物碱类化合物[J]. 江西师范大学学报( 自然科学版) , 1996, (3) :232
12张彦,陈燕忠.生物碱类抗肿瘤药物及其新剂型的研究进展[J].药品评价,2006,3(4):264
13赵斌,葛金芳,李俊.喜树碱抗肿瘤作用机制研究进展[J].安徽医药,2006,10(1):1
14复旦大学.10-羟基喜树碱衍生物及其制备方法和用途[P].中国:201010567836.1,2012-05-30
15中国人民解放军第二军医大学.喜树碱E环类似物及其作为药物的用途[P].中国:201210030331.0,2012-07-25
16代鲁平,宋春霞,邵先祥,等.抗癌药物喜树碱类衍生物的研究进展[J].中国药学杂志,2010,45(23):1813
17程晓华,熊玉卿.五环三萜皂苷的药理作用研究进展[J].中草药,2007,38(5):792
18高振北,康潇,许传莲.甘草次酸抗肿瘤作用机制的研究进展[J].中国中药杂志,2011,36(22):3213
19Yamaguchi H,Noshita T,Yu T,etal.Novel effects of glycyrrhetinic acid on the central nervous system tumorigenic progenitor cells::induction of actin disruption and tumor cell-selective toxicity[J].Eur J Med Chem,2010,45(7):2943
20Yu T,Yamaguchi H,Noshita T,etal.Selective cytotoxicity of glycyrrhetinic acid against tumorigenic r /m HM-SFME-1 cells:potential involvement of H-Ras downregulation[J].Toxicol Lett,2010,192(3):425
21沈阳化工大学.一种具有抗肿瘤活性的甘草次酸修饰物及其制备方法[P].中国:201110354326,2012-06-27
