硒对肾间质纤维化大鼠肾组织结缔组织生长因子表达及肾小管上皮细胞表型转化的影响
2013-04-18徐刚邹循亮傅珍春鄢巨振尹洪萍亢晓冬刘茂林黄妙珍项捷高云洁
徐刚 邹循亮 傅珍春 鄢巨振 尹洪萍 亢晓冬 刘茂林 黄妙珍 项捷高云洁
●论 著
硒对肾间质纤维化大鼠肾组织结缔组织生长因子表达及肾小管上皮细胞表型转化的影响
徐刚 邹循亮 傅珍春 鄢巨振 尹洪萍 亢晓冬 刘茂林 黄妙珍 项捷高云洁
目的 探讨硒对肾间质纤维化大鼠肾组织结缔组织生长因子(CTGF)表达及肾小管上皮细胞表型转化的影响。方法以单侧输尿管结扎致肾间质纤维化大鼠模型。将54只SD大鼠随机分为假手术组(A组)、单侧输尿管梗阻(UUO)组(B组)、UUO+硒组(C组),每组18只。C组给予亚硒酸钠0.2mg/(kg·d)灌胃。A、B组给予同等剂量0.9%氯化钠溶液灌胃。术后第7、14、21天各组随机处死6只大鼠,肾组织行HE、Masson染色评定肾间质纤维化程度,免疫组织化学半定量法检测CTGF和α-平滑肌肌动蛋白(α-SMA)的表达。Western印迹法检测肾组织CTGF蛋白表达。化学比色法检测肾组织氧化指标谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、丙二醛(MDA)的表达水平。结果术后各时点C组肾间质纤维化程度较B组明显减轻(P<0.05),肾组织CTGF和α-SMA的表达强度明显低于B组(P<0.05或0.01)、GSH-Px和SOD水平明显高于B组(P<0.05),MDA含量明显低于B组(P<0.05)。B组肾组织中CTGF、a-SMA表达量之间呈正相关(P<0.05),CTGF和a-SMA表达量与肾间质纤维化病变程度呈正相关(P<0.05)。结论硒可以减轻UUO模型大鼠肾间质纤维化程度,其机制可能与硒的抗氧化作用、下调肾组织CTGF的表达、抑制肾小管上皮细胞-肌成纤维细胞转分化有关。
硒 单侧输尿管梗阻 氧化应激 结缔组织生长因子 α-平滑肌肌动蛋白 肾间质纤维化
Effect of selenium on expression of connective tissue growth factor and transdifferentiation of renal tubular epithelial cells in unilateralureteral obstruction rats


【 Abstract】 ObjectiveTo investigate the effect of selenium on expression of connective tissue growth factor(CTGF)and transdifferentiation of renal tubular epithelial cells in rat model of unilateral ureteral obstruction(UUO).MethodsFifty four male SD rats were randomly divided into 3 groups:sham-operation group (group A),UUO group (group B),UUO+sodium selenite group (group C)with 18 animals in each group.The unilateral ureteral obstruction was induced by ligation of unilateral ureter in groups B and C.Rats in group C received sodium selenite 0.2mg/(kg-1·d-1)by gastric lavage 1d before operation;same volume of normal saline was administrated in groups A and B.At d7,14 and 21 after the treatment,6 rats from each group were randomly sacrificed.The extent of renal interstitial fibrosis was evaluated by HE and Masson staining of the renal tissue sections.Immunohistochemical method and Western blot were used to examine the expression of CTGF and α-smooth muscle actin(α-SMA). Superoxide dismutase(SOD),malondialdehyde(MDA)and glutathione peroxidase(GSH-px)levels in renal cortex were measured by colorimetric assay.ResultsThe extent of renal interstitial fibrosis and the expression of CTGF and α-SMA in renal cortex were significantly lower in group C at d7,14 and 21 after the operation,compared to those in group B(P<0.05 or P<0.01).The contents of SOD and GSH-px in renal cortex of group C were significantly higher than those in group B at d7,14 and 21,respectively(P<0.05),while the MDA level in renal cortex was significantly decreased(P<0.05).The expression of CTGF and α-SMA in renal cortex was positively correlated to the extent of renal interstitial fibrosis in group B(r=0.817,P<0.05;r=0.829,P<0.05,respectively);and CTGF and α-SMA was positively correlated with each other(r=0.803,P<0.05).Conclusion Selenium may re-duce the extent of renal fibrosis in rat UUO model,which may be related to anti-oxidant and down-regulation of CTGF and α-SMA expression in renal tissue and inhibition of transdifferentiation of renal tubular epithelial cells.
【 Key words】Selenium Unilateral ureteral obstruction Oxidative stress Connective tissue growth factor(CTGF) α-smooth muscle actin(α-SMA) Renal interstitial fibrosis
肾间质纤维化是肾脏疾病的共同终点,而肾小管上皮细胞转分化(TEMT)在肾间质纤维化的发生与发展中起关键作用[1]。研究表明,TGF-β1是诱导TEMT的重要因素[2],结缔组织生长因子(CTGF)基因转染也能诱导TEMT[3]。CTGF是介导TGF-β1诱导肾纤维化的下游分子,与肾脏纤维化关系密切,可作为肾纤维化疾病干预治疗的靶目标。氧化应激过程中产生的过量活性氧(ROS)可通过诱导TGF-β1和CTGF的过度表达,在肾间质纤维化的发生与发展起重要作用[4-6]。因此,抗氧化、抑制肾组织CTGF过表达,抑制TEMT,对防止肾间质纤维化,延缓慢性肾脏病的病程进展具有十分重要的意义。微量元素硒是若干抗氧化酶类自由基清除剂如谷胱甘肽过氧化物酶(GSH-Px)、磷脂氢GSH-Px(PHGPx)和硒蛋白-P(Se-P)的必需组分,具有肯定的抗氧化作用。其能否通过抗氧化抑制肾组织CTGF过表达,抑制TEMT,进而减轻肾间质纤维化,国内外鲜见报道。本研究通过建立单侧输尿管梗阻(UUO)肾间质纤维化模型后进行补硒干预,观察补硒前后肾间质病变、氧化应激指标以及CTGF、α-平滑肌肌动蛋白(α-SMA)表达的变化,旨在探讨硒对肾间质纤维化的作用及可能机制。
1 材料和方法
1.1 材料 实验动物:选择6周龄雄性清洁级SD大鼠54只,体重180~200g,由杭州师范大学医学实验动物中心提供[合格证号:syxk(浙2011-0157)]。药品、试剂及仪器:亚硒酸钠片[0.2mg/片(按硒计91.3μg),规格:30片/盒]购于上海天赐福生物工程有限公司;兔抗大鼠CTGF、α-SMA多克隆抗体(1:100,美国Abcam);二抗为EnVision是标记有辣根过氧化物酶及山羊抗小鼠(或兔)免疫球蛋白的多聚体分子(基因科技上海有限公司)。α-actin单克隆抗体(英国Abcam),BCA蛋白测定试剂盒(美国 Pierce),ECL放光试剂(美国Pierce),Western印迹用PVDF膜(美国Bio-Rad),GSH-px、超氧化物歧化酶(SOD)、丙二醛(MDA)测定试剂盒(南京建成生物工程公司)。BioTeK ELX800酶标仪(美国BioTek),Mini-PROTEAN系统及Mini Trans-Blot(美国Bio-Rad),CMIAS系列多功能真彩图像分析仪(北京航空航天大学)。
1.2 方法
1.2.1 UUO模型制作 54只SD大鼠实验期间自由饮水、进食,适应性饲养7d无异常后用于制备动物模型。以10%水合氯醛(30mg/kg)腹腔内注射麻醉,备皮、消毒,在无菌条件下行左侧耻骨上切口,逐层打开腹膜后,沿左肾下极寻找并游离左侧输尿管,在距输尿管中上1/ 3处用0号丝线结扎输尿管,在其远端0.5cm处再次结扎输尿管,然后从中剪断输尿管以防逆行性感染。逐层缝合肌层与皮肤关闭腹腔。假手术组同样开腹,游离输尿管后即关腹。
1.2.2 实验设计与分组 按数字随机表法将54只雄性SD大鼠随机分为假手术组(A组)、UUO组(B组)和UUO+硒组(C组),每组18只。C组从术前1d至处死当天,每天给予亚硒酸钠0.2mg/kg(浓度0.01mg/ml)灌胃。A组和B组给予0.9%氯化钠溶液(10ml/kg)灌胃。分别于术后第7、14、21天以10%水合氯醛(30mg/kg)腹腔内注射麻醉后处死大鼠(各组每个时间点随机处死6只),取术侧(左侧)肾皮质组织(在冰台操作),分成两部分,一部分用锡箔纸包裹并标记后迅速置于液氮罐中并保存于-80℃冰箱,用于肾组织匀浆氧化指标(GSH-Px、SOD、MDA)含量分析及蛋白印迹测试;另一部分经10%中性福尔马林固定后用于HE、Masson染色及免疫组化分析。
1.2.3 肾组织形态学分析 10%中性福尔马林固定的肾组织,经脱水、透化后石蜡包埋,3μm切片。按常规方法进行HE、Masson染色后光镜观察。在Masson染色组织切片上进行肾间质纤维化指数评分。在CMIAS系列多功能真彩图像分析仪下计算肾小管间质纤维化指数。每张切片在高倍镜(×200)下随机选取10个不重叠视野测定小管间质纤维化面积与同视野小管间质总面积的百分比,进行半定量评分[7]。间质纤维化指数评分标准如下:0分,肾小管结构正常,间质无纤维化;1分,间质轻度纤维化(以灶性为主,范围<25%),肾小管基本正常;2分,间质中度纤维化(病灶范围25%~50%,伴有肾小管萎缩、肾小管基底膜增厚;3分,间质弥漫性纤维化(病灶范围>50%),伴大量肾小管萎缩、肾小管基底膜增厚。每张切片取10个视野的平均积分,再在各组取平均值。
1.2.4 免疫组化分析 CTGF、α-SMA均采用EnVision二步法。4μm石蜡切片常规脱蜡水化,用含3%的H2O2封闭内源性过氧化物酶。用1g/L的胰蛋白酶37℃修复抗原30min。分别加入CTGF(工作浓度为1∶50)、α-SMA(工作浓度为1∶100),4℃冰箱过夜。PBS洗涤后加En-Vision兔二抗,37℃30min,PBS洗涤后用DAB显色2~10min,用dd H2O终止显色,苏木素复染1~2min,兰化,常规脱水、透明、封片。同时用PBS代替一抗作阴性对照。双盲法应用CMIAS系列多功能真彩图像分析仪,分别对各组免疫组化结果进行分析,先在低倍镜下观察(每只动物的切片随机取40个视野,将视野分为上、下、左、右、中),之后取视野的中央在高倍镜下(×200倍)计算每个视野下阳性染色区域占总视野面积的百分比,之后取40个视野百分比的均值[8]。
1.2.5 肾组织CTGF蛋白检测 取适量大鼠肾皮质组织,经液氮研磨后用含蛋白酶抑制剂的RIPA裂解液提取组织蛋白并采用BCA法对其进行定量。每个标本取40μg蛋白,按1∶4加入5×loading buffer,煮沸5min后进行聚丙烯酰胺凝胶电泳。电泳结束后采用PVDF膜进行湿法转膜,300mA 2h,之后用5%脱脂奶粉室温封闭1.5h。分别采用以下一抗4℃孵育过夜:抗CTGF(工作浓度1∶400)以及内参抗-actin(工作浓度1∶800Abcam)。1× TBST液漂洗3遍后室温孵育二抗(羊抗兔IgG,1∶4 000,Epitomics)1h。漂洗后用ECL试剂(Pierce)显色并用医用胶片显影。
1.2.6 肾组织氧化损伤指标检测 采用比色法检测肾组织匀浆中氧化指标GSH-Px、SOD、MDA的含量。
1.3 统计学处理 采用SPSS17.0统计软件,计量数据以表示,组间比较采用单因素方差分析,相关性采用Spearman相关分析。
2 结果
2.1 各组大鼠肾间质纤维化程度的比较 见图1-2。
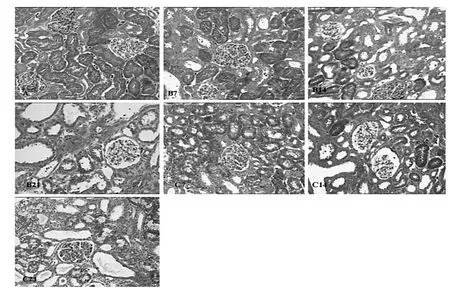
图1 各组大鼠肾间质纤维化染色情况(Masson染色,×200)
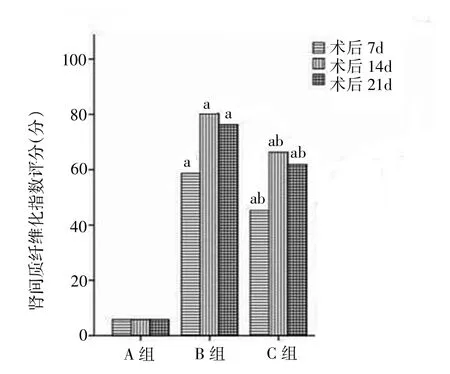
图2 各组大鼠肾间质纤维化评分比较
由图1-2可见,随梗阻时间延长肾间质逐步增宽,肾小管上皮细胞弥漫性空泡变性,肾小管管腔扩大、萎缩,肾间质炎性细胞浸润、水肿和纤维化改变逐步加重。B、C组各时点肾间质纤维化指数均明显高于A组(均P<0.01),C组肾间质纤维化指数明显低于B组(P<0.05)。
2.2 免疫组化方法检测肾组织CTGF和α-SMA的表达 见图3-6。
由图3-6可见,B、C组各时间点肾组织CTGF和α-SMA的阳性细胞面积百分比均显著高于A组(均P<0.01);C组各时间点肾组织CTGF和α-SMA的阳性细胞面积百分比明显低于B组(P<0.05或0.01)。
2.3 Western印迹方法检测肾组织CTGF的表达 见图7-8。
由图7-8可见,B、C组各时间点肾组织CTGF蛋白表达均显著高于A组(均P<0.01);术后第14、21天时C组各时间点肾组织CTGF蛋白表达明显低于B组(P<0.01)。
2.4 各组大鼠肾组织GSH-Px、SOD、MDA变化的比较 见表1。
由表1可见,B组各时间点肾组织GSH-Px及SOD水平均显著低于A组(均P<0.01)、MDA水平显著高于A组(均P<0.01);C组各时点肾组织GSH-Px及SOD水平低于A组、MDA水平高于A组,但差异无统计学意义(均P>0.05);C组各时点肾组织GSH-Px及SOD水平均明显高于B组(均P<0.05)、MDA水平明显低于B组(P<0.05)。
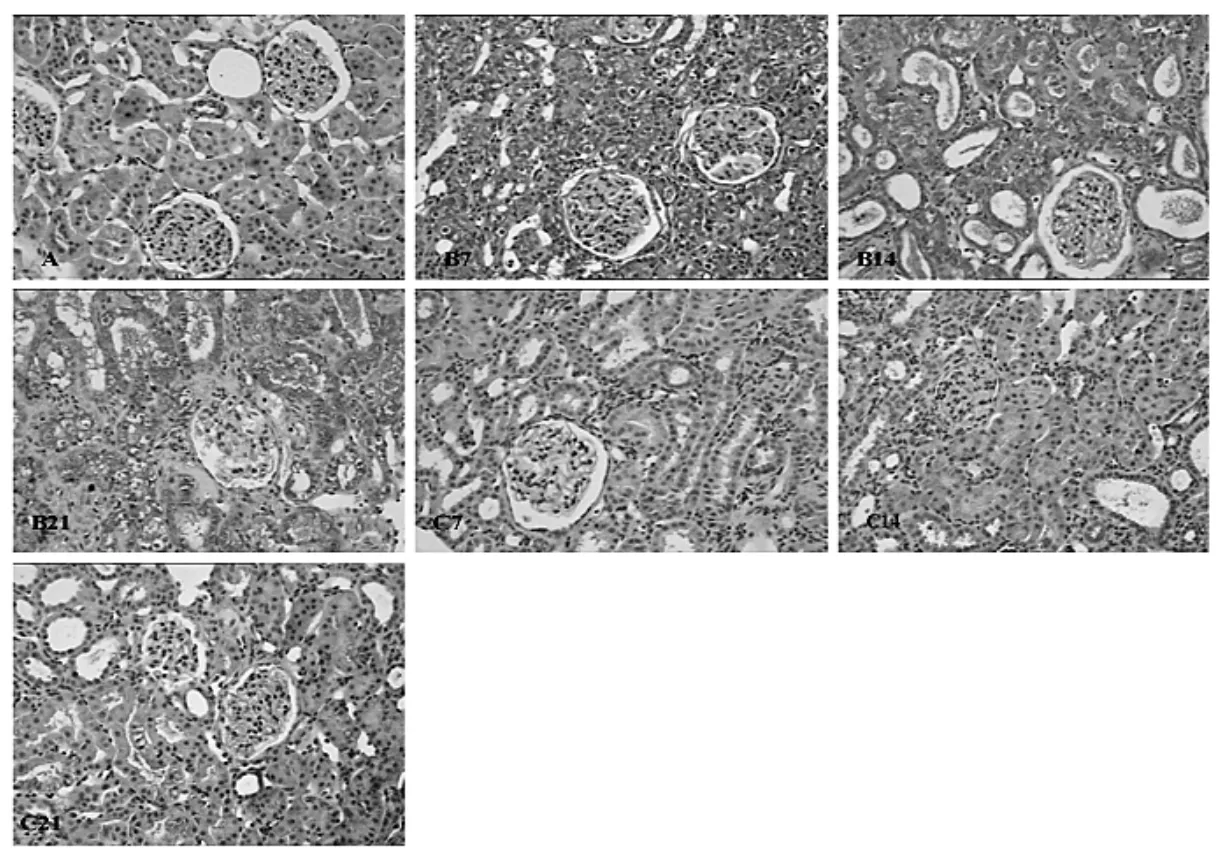
图3 各组大鼠肾组织CTGF表达情况(免疫组化,×200)

图4 各组大鼠肾组织CTGF阳性面积百分比的比较
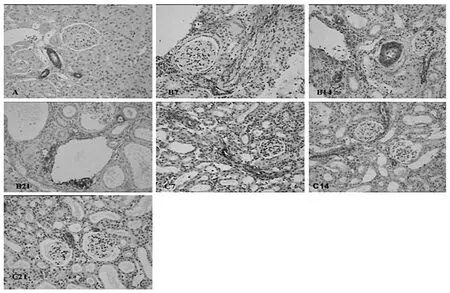
图5 各组大鼠肾组织α-SMA表达情况(免疫组化,×200)

图6 各组大鼠肾组织α-SMA阳性面积百分比的比较

图7 各组大鼠肾组织CTGF蛋白Western印迹检测情况
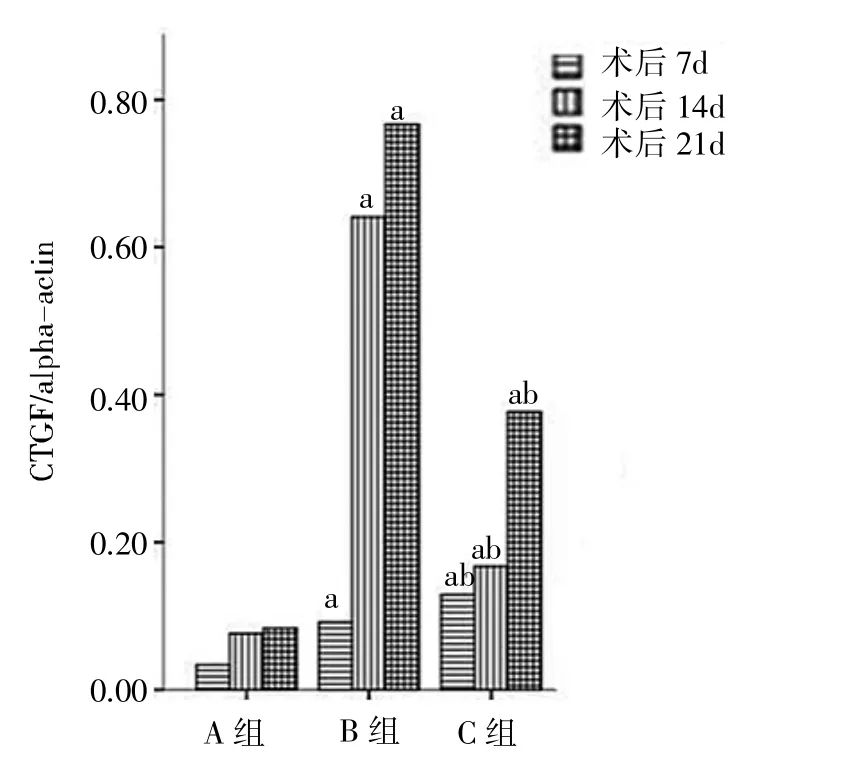
图8 各组大鼠肾组织CTG蛋白表达的比较

表1 各组大鼠肾组织GSH-Px、SOD、MDA变化的比较
2.5 相关性分析 B组大鼠肾组织CTGF与α-SMA的表达呈正相关(r=0.803,P<0.05),CTGF及α-SMA的表达与肾间质纤维化病变程度呈正相关(r=0.817、0.829,均P<0.05)。
3 讨论
肾间质纤维化是所有肾脏疾病进展到终末期肾病的共同途径和主要病理基础,在人类肾脏疾病的转归中起着决定性作用。肌成纤维细胞(MF)是合成细胞外基质(ECM)的重要细胞,特异性地表达α-SMA,与组织纤维化的形成密切相关。
研究表明,在肾间质纤维化的动物模型中,肾组织中部分MF是由肾小管上皮细胞转化而来,这一过程称为TEMT[9],TEMT是肾间质纤维化的重要发病机制之一[1]。CTGF是TGF-β介导肾间质纤维化的重要下游效应因子,可在TGF-β诱导下,参与间质成纤维细胞或肾小管上皮细胞ECM的过量合成,导致肾间质纤维化的发生。有学者应用RT-PCR检测到TGF-β1可使肾小管上皮细胞CTGF基因表达上调,而降低CTGF表达可明显抑制由TGF-β1介导的肾小管上皮细胞向纤维母细胞转化[10]。这提示CTGF过度表达可以诱导肾小管上皮细胞转化为MF,促进ECM合成,导致肾脏纤维化。
肾间质纤维化的组织学特征是肾小管的萎缩和ECM过多沉积,目前认为ECM主要由α-SMA阳性的MF产生。越来越多的研究表明,肾小管上皮细胞可转分化为能产生和分泌ECM的MF,而在肾间质纤维化的发生中起重要作用[11-12];CTGF表达阳性的间质细胞可同时表达α-SMA[13]。TGF-β1能上调CTGF基因的表达,继而上调α-SMA基因的表达,用CTGF反义核苷酸干扰能抑制TGF-β1诱导的α-SMA的表达。这些研究结果表明,CTGF可在TGF-β1的下游发挥作用,促使肾小管上皮细胞转分化为MF。提示抑制CTGF的促生长和转分化作用可能是一种抗肾间质纤维化的新治疗靶点。近期的研究表明,作为细胞信号因子的氧自由基可以介导和放大UUO所致的炎症损伤、刺激成纤维细胞的增生,导致肾间质纤维化[14]。外源性H2O2在诱导TEMT、基质重塑及肾小管间质纤维化过程中起重要作用[15]。抗氧化应激治疗能有效减轻肾间质纤维化[16];应用CTGF反义寡核苷酸治疗可阻断体外培养的肾间质成纤维细胞CTGF表达,抑制TGF-β1介导的纤连蛋白(FN)和Ⅰ型胶原的合成,并显著减轻鼠肾间质纤维化的发生[17]。
本研究结果显示,与A组比较,B组大鼠肾间质纤维化程度显著,肾组织CTGF、α-SMA表达显著增加,CTGF与α-SMA的表达呈正相关,CTGF和α-SMA表达与肾间质纤维化病变程度呈正相关;肾组织中GSH-Px、SOD水平降低,MDA水平增高;而C组肾间质纤维化指数、肾组织CTGF、α-SMA的表达强度和肾组织MDA水平均明显低于B组,GSH-Px、SOD水平均明显高于B组。证实氧化损伤和CTGF、α-SMA表达增强与肾间质纤维化关系密切,而补硒干预后大鼠肾组织氧化应激反应减轻,CTGF和α-SMA表达减少,肾间质纤维化程度减轻。提示过强的氧化应激反应可能通过上调肾组织CTGF、α-SMA的表达,引起或加重肾间质纤维化;而补硒治疗则可能通过其抗氧化作用下调肾组织CTGF、α-SMA的表达,减轻肾间质纤维化。Takeda等[18]研究发现,血管紧张素转换酶抑制剂盐酸咪达普利联合Rho激酶抑制剂法舒地尔治疗可通过抑制肾组织氧化应激反应、TGF-β/collagen表达、单核/巨噬细胞浸润、细胞分化及炎症反应,减轻肾间质纤维化。
总之,氧化应激和氧化应激过程中产生的过量ROS是肾间质纤维化的一个重要促进因素。硒是GSH-Px和PHGPx、Se-P和SOD等抗氧化酶类自由基清除剂的必需组分,具有保护细胞结构和功能不受过氧化物损害和干扰的作用,并能直接清除多种形式的ROS,防止氧化损伤的积累,抑制氧化应激反应。由此可见,通过补充微量元素硒抑制氧化应激反应、减少肾组织CTGF的过表达,抑制TEMT,减少ECM的合成可能是延缓或阻止肾间质纤维化的另一新的治疗靶点,提示补硒治疗在防治肾间质纤维化中具有潜在的临床应用价值,但其确切作用机制尚待进一步研究。
[1] Liu F,Gou R,Huang J,et al.Effect of anaphylatoxin C3a,C5a on the tubular epithelial-myofibroblast transdifferentiation in vitro[J]. Chin Med J(Engl),2011,124(23):4039-4045.
[2]Malmstrom J,Lindberg H,Lindberg C,et al.Transforming growth factor beta1 specifically induce proteins involved in the myofibroblast contractile apparatus[J].Mol Cell Proteomics,2004,3(5): 466-477.
[3] Zhang C,Meng X,Zhu Z,et al.Connective tissue growth factor regulates the keyevents in tubular epithelial to myofibroblast transition in vitro[J].Cell Biol Int,2004,28(12):863-873.
[4] Kim J,Jung K J,Park K M.Reactive oxygen species differently regulate renal tubular epithelial and interstitial cell proliferation after ischemia and reperfusion injury[J].Am J Physiol Renal Physiol, 2010,298(5):F1118-1129.
[5] Leask A,Holmes A,Black C M,et al.Connective tissue growth factor gene regulation.Requirements for its induction by transforminggrowthfactorbeta1infibroblasts[J].JBiolChem,2003,278 (15):13008-13015.
[6] QI W,Twigg S,Chen X,et al.Integrated actions of transforming growth factor beta1 and connective tissue growth factor in renal fibrosis[J].Am J Physiol Renal Physiol,2005,288(4):800-809.
[7] Mezzano S A,Droguett M A,Burgos M E,et al.Overexpression of chemokines,fibrogenetic cytokines,and myofibroblasts in human membranous nephropathy[J].Kidney Int,2000,57:147-158.
[8] 赵班,吴华,郑法雷.红细胞生成素对单侧输尿管梗阻大鼠肾间质纤维化的作用及对MCP-1和TGF-β1表达的影响[J].中国血液净化杂志,2010,9(9):477-481.
[9] Liu Y.Epitheial to mesenchymal transition in renal fibrogenesis: pathologic sighificance,molecular mechanism,and therapeutic intervention[J].J Am Soc Nephrol,2004,15(1):1-12.
[10] Zhang C,Zhu Z H,Liu J S,et al.Role of connective tissure growth factor in human renal tubular epithelial cell transdifferentiation in vitro[J].Zhonghua Yi Xue Za Zhi,2005,85(42):2920-2925.
[11]Burns W C,Kantharidis P,Thomas M C.The role of tubular epithelialmesenchymal transition in progressive kidney disease[J].Cell Tissues Organs,2007,185(1-3):222-231.
[12]Manucha W.Biochemical-molecular markers in unilateral ureteral obstruction[J].Biocell,2007,31(1):1-12.
[13]Yokoi H,Mukoyama M,Sugawara A,et al.Role of connective tissue growth factor in fibronectin expression and tubulointerstitial fibrosis[J].Am J Physiol Renal Physiol,2002,282(5):F933-942.
[14] Klahr S,Jeremiab M.Obst ructive nephtopat hy and renal fibrosis [J].Kidney International,2004,56(6):295-303.
[15]Stanton R C.Oxidative stress and diabetic kidney disease[J].Curr Diab Rep,2011,11(4):330-336.
[16] Moriyama T,Kawada N,Nagatoya K.Fluvastatin suppresses oxidative stress and fibrosis in the interstitium of mouse kidneys with unilateral ureteral obstruction[J].Kidney International,2001, 59(6):2095-2103.
[17] 刘伏友.蛋白尿致肾小管间质纤维化的机制及防治[J].中华肾脏病杂志,2006,22(5):258-260.
[18] Takeda Y,Nishikimi T,Akimoto K.Beneficial effects of a combination of Rho-kinase inhibitor and ACE inhibitor on tubulointerstitial fibrosis induced by unilateral ureteral obstruction[J].Hypertens Res,2010,33(9):965-973.
2013-02-28)
(本文编辑:欧阳卿)
杭州市科技计划发展项目(20080333B19)
310015 杭州师范大学附属医院肾内科、杭州师范大学肾脏病研究所(徐刚、邹循亮、傅珍春、鄢巨振、刘茂林、黄妙珍、项捷、高云洁);杭州师范大学医学实验动物中心(尹洪萍、亢晓冬)
徐刚,E-mail:xugang58@Aliyun.com
