2型糖尿病大鼠肺组织凋亡相关因子Caspase表达及罗格列酮的干预作用研究
2013-04-17刘旭阳苏胜偶赵春芳
刘旭阳 ,王 绵,苏胜偶,赵春芳
(1.中国人民解放军第二五二医院内分泌科,河北 保定 071000; 2.河北医科大学第二医院内分泌科,河北石家庄 050000; 3.河北医科大学组胚教研室,河北 石家庄 050017)
近年来,随着对糖尿病并发症研究的深入,糖尿病肺部损害已经越来越受到关注。1型、2型糖尿病患者肺脏存在不同程度的限制性、阻塞性或混合性通气及弥散障碍,但发病机制尚不清楚。本研究中通过检测2型糖尿病大鼠肺组织细胞凋亡相关因子Caspase表达的变化,观察罗格列酮的干预作用,为治疗糖尿病肺病提供试验依据。现报道如下。
1 材料与试药
罗格列酮(葛兰素史克公司,批号为0308002);链脲佐菌素(Sigma公司,批号为S-130);盐酸氯胺酮(江苏恒瑞医药公司,批号为 KH20045);TUNEL检测试剂盒(北京中山生物工程有限公司,批号为 10490800);兔抗鼠 Caspase-3、Caspase-9 多克隆抗体(Santa Cruz公司,批号为 F00037626)。2周龄大鼠(体重180~250 g,河北省实验动物中心提供);全自动生化分析仪(德国拜耳);血糖仪(美国强生)。
2 方法与结果
2.1 试验分组
随机选取10只大鼠作为对照组,给予普通饲料喂养;选取30只大鼠,高热量饮食后给予腹腔注射小剂量链脲佐菌素(STZ,30 mg /kg),血糖不小于 7.8 mmol/L 者为模型组,从 12 周起每日给予同罗格列酮干预组等体积的高压消毒水灌胃;选取模型组中大鼠作为干预组,给予罗格列酮灌胃治疗[1.42 mg/(kg·d)],至24周时进行标本收集及生化指标测定。
2.2 标本收集及生化指标测定
24周时对照组、模型组大鼠禁食12~14 h,测定血糖后,盐酸氯胺酮100 mg/kg腹腔注射麻醉,股静脉取血测定胰岛素和血脂。打开胸腔,迅速取出肺脏,冰盐水冲洗,剪除胸膜及血管,取部分肺组织置10%中性甲醛固定,脱水,石蜡包埋,常规切片留做HE染色;用TUNEL试剂盒检测肺组织细胞凋亡,棕黄色或黄色为阳性反应;下一步分别加一抗[兔抗 Caspase-3(1∶100),兔抗Caspase-9(1 ∶100)],用 PBS 清洗后,滴加生物素标记的二抗工作液(兔抗羊),滴加辣根过氧化物酶标记链霉卵白素工作液(三抗),阴性对照用PBS替代一抗,观察细胞浆和/或细胞核内表达,棕黄或黄色颗粒为阳性反应。
2.3 统计学处理
采用 SPSS 10.0软件进行统计学处理,组间比较采用 t检验,多组间比较采用单因素方差分析,两两比较采用 q检验,所有计量资料以(X±s)表示,P<0.05为差异有统计学意义。
2.4 结果
生化指标改变:见表1。24周时糖尿病模型组大鼠的空腹血糖、胰岛素、甘油三酯、胆固醇较同期对照组均显著升高(P<0.05)。罗格列酮干预组大鼠甘油三酯、胆固醇下降,但无统计学意义,胰岛素明显下降,与糖尿病模型组大鼠相比,胰岛素水平有显著差异(P <0.05)。

表1 干预的不同阶段生化和胰岛素水平比较(X±s)
肺组织形态学变化:HE染色可见,对照组大鼠肺泡分布均匀,结构完整,由单层肺泡上皮和基膜组成,相邻肺泡之间有少量结缔组织。糖尿病模型组大鼠肺组织结构紊乱,支气管壁、肺泡壁增厚,肺泡上皮细胞显示不清,肺泡萎缩、塌陷。肺间质和血管周围细胞外基质大量增多,成纤维细胞增多,并有大量炎症细胞浸润。罗格列酮治疗组大鼠肺组织病变较糖尿病模型组明显减轻,肺间质胶原沉积较少,支气管、肺泡上皮细胞壁增厚减轻,介于对照组和糖尿病模型组之间(P<0.01)。糖尿病模型组大鼠肺组织结构紊乱,支气管壁、肺泡壁增厚,肺泡上皮细胞显示不清,肺泡萎缩、塌陷。并有大量炎症细胞浸润。罗格列酮干预组大鼠肺组织病变较糖尿病模型组明显减轻,肺间质胶原沉积较少,支气管、肺泡上皮细胞壁增厚减轻,介于对照组和糖尿病模型组之间(P<0.05)。见图1。
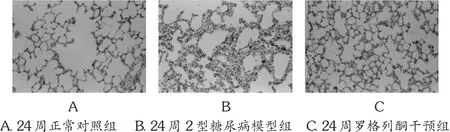
图1 大鼠肺组织HE染色(SP×200)
Caspase-3免疫组化结果:对照组大鼠的支气管上皮细胞、肺泡上皮细胞、少数血管内皮细胞胞核可见少量阳性表达。24周糖尿病模型组大鼠阳性表达明显增加,见于支气管细胞、肺泡上皮细胞、肺巨噬细胞及炎性细胞,胞膜及胞浆表达,阳性染色光密度值为 0.141 2 ±0.001 2,明显高于同期对照组的 0.073 8 ±0.006 5(P <0.01);罗格列酮干预组阳性染色光密度值为 0.129 3 ±0.004 6,大于对照组,少于24周糖尿病模型大鼠组,组间均有明显差异(P <0.01)。肺组织凋亡指数对照组为 0.079 5±0.016 2,罗格列酮干预组为 0.170 9±0.014 0,糖尿病模型大鼠组为0.244 7 ±0.0123,组间比较差异有统计学意义(P <0.01)。见图 2。
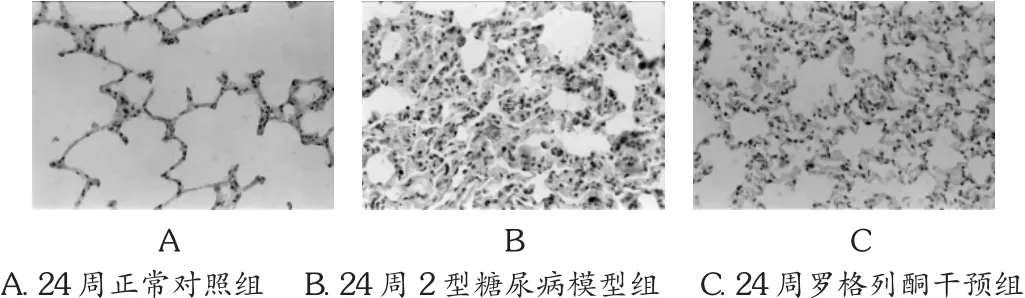
图2 不同分组大鼠肺组织Caspase-3表达(SP×400)
Caspase-9免疫组化结果:对照组大鼠的支气管上皮细胞、肺泡上皮细胞胞浆中可见少量阳性反应。24周糖尿病模型组大鼠阳性表达明显增加,见于支气管细胞、肺泡上皮细胞、肺巨噬细胞及炎性细胞,胞膜及胞浆表达,阳性染色光密度值为0.255 2±0.009 6,明显高于同期对照组大鼠的光密度值 0.083 2±0.019 2(P<0.01)。罗格列酮治疗组阳性染色光密度值为 0.226 1±0.011 8,大于对照组,少于24周糖尿病模型组,组间均有明显差异(P <0.01)。见图 3。

图3 不同分组大鼠肺组织Caspase-9表达(SP×400)
3 讨论
噻唑烷二酮类降糖药物(TZDs)是一类过氧化物酶体增殖物活化受体 γ(PPAR-γ)激动剂。过氧化物酶体增殖物激活受体γ(PPAR-γ)是核激素受体蛋白超家族成员。它通过连接到目标基因增强子序列上的过氧化物体增殖反应元件,调节目标基因的转录活性。罗格列酮是噻唑烷二酮类降糖药,它通过与过氧化物酶体增殖物活化受体γ结合,增加肝脏、骨骼肌及脂肪组织对胰岛素的敏感性,从而降低血糖。此外,罗格列酮还具有抗氧化、改善血管内皮功能等作用[1-2]。笔者选用罗格列酮来观察其对糖尿病肺组织凋亡的作用。
试验采用高脂高糖饮食加小剂量STZ模拟人类2型糖尿病的发病过程,建成2型糖尿病大鼠模型,分别观察不同试验组肺组织病理改变及凋亡细胞的变化。结果发现,罗格列酮治疗组大鼠空腹血糖未降低,但甘油三酯、胰岛素及胆固醇水平明显低于糖尿病大鼠组;糖尿病大鼠肺组织的病理改变明显减轻,光镜下支气管、肺泡、血管基底膜增厚减轻,肺组织结构好转。同时,罗格列酮治疗组凋亡细胞数低于糖尿病模型组,表明罗格列酮抑制了糖尿病大鼠肺组织中的细胞凋亡。
PPAR-γ在肺中分布较广,Ⅱ型肺泡上皮细胞只表达亚型PPAR - γ1,肺组织中主要表达 PPAR - γ1[3-4]。国外研究显示,PPAR-γ的激活可抑制视网膜、血管平滑肌及多种肿瘤细胞的凋亡[5]。也有研究表明,罗格列酮对糖基化终产物诱导的心肌成纤维细胞凋亡有抑制作用[6]。对于糖尿病大鼠肺组织细胞凋亡是否有抑制作用,目前国内未见报道。本研究结果显示,罗格列酮抑制了肺组织细胞凋亡,其机制尚不明确,需进一步试验研究。
[1]郭啸华,刘志华,李 恒.高糖高脂饮食诱导的2型糖尿病大鼠模型及其肾并特点[J].中国糖尿病杂志,2002,10 (5):290-294.
[2]Pistrosch F,Passauer J,Fischer S,et al.In type 2 diabetes,rosiglitazone therapy for insulin resistance ameliorates endothelial dysfunction independent of glucose control[J].Diabetes Care,2004,27(2):484-490.
[3]Hsueh WA,Bruemmer D.Peroxisome Proliferator-activated receptor gamma:implications for cardiovascular disease[J].Hypertension,2007,43(19): 297-305.
[4]李惠萍,李 霞,何国钅匀,等.地塞米松对博莱霉素致肺间质纤维化大鼠肺内炎性细胞的影响[J].复旦学报:医学版,2004,31(4):378-382.
[5]张静萍,万建华,刘国良.核因子在糖尿病大赎肺组织活性的变化[J].中国老年病学杂志,2005,7(25):820-822.
[6]吴 亮,朱忠华,易 烨,等.褪黑素对高糖诱导的大鼠系膜细胞凋亡的影响[J].中国中西医结合肾病杂志,2007,9(8):514-516.
