西瓜枯萎病生防菌XG-1的筛选、鉴定及其抑菌作用
2013-04-11孙正祥
孙正祥,王 丰,黄 玲,周 燚
(长江大学 农学院,湖北 荆州 434025)
西瓜枯萎病是一种由尖孢镰刀菌西瓜专化型(Fusarium oxysporum f.sp niveum FON)引起的维管束土传病害,是西瓜产业中最普遍、危害最严重的病害之一,一般发病率为10% ~30%,严重的达80% ~90%,重茬地甚至造成绝产[1]。病原菌从土壤根系侵入,引起维管束变褐坏死,导致瓜秧枯死,其厚垣孢子在土壤中可存活十年之久,严重影响西瓜的种植[2]。目前,对该病害尚无有效的防治方法,传统的轮作虽在一定程度上能减轻病害发生,但随着市场对西瓜需求量的增长,西瓜种植面积逐年扩大,轮作防病措施难以实施[3]。研究表明,在植物体内存在大量的益生菌,已在多种植物体内分离筛选到防病效果明显的内生细菌[4]。有些内生细菌还具有促生、固氮等生物功能,是植物病害防治的重要资源,尤其对化学药剂难以控制的土传病害、维管束病害及系统性病害发挥其独特的优势[5]。笔者从湖北荆州西瓜枯萎病病区采集的健康西瓜样品,通过平板对峙及抑菌圈双重法筛选到一株对西瓜枯萎病菌有强拮抗作用的内生细菌XG-1,研究其抑菌范围及对西瓜枯萎病菌菌丝及孢子萌发的抑制作用,根据形态特征和16S rDNA序列对其鉴定,旨在为西瓜枯萎病的防治提供重要参考。
1 材料与方法
1.1 供试材料
西瓜枯萎病菌(Fusarium oxysporum f.sp.niveum),棉花枯萎病菌(Fusarium oxysporum f.sp.vasinfectum)、棉花黄萎病菌(Verticillium dahliae Kleb.)、棉花立枯病菌(Rhizoctonia solani Kühn)、油菜菌核病菌(Sclerotinia sclerotiorum)、小麦赤霉病菌(Fusarium graminearum Schw.),均由长江大学植物病理学研究室提供。
NA培养基:依次准确地称取牛肉浸膏3 g,蛋白胨10 g,NaCl 5 g放入少量水搅拌加热使之熔化,定容至1000mL,加入琼脂粉20 g,继续搅拌加热使之熔化。使用1 mol/L NaOH和1 mol/L HCl调节pH至 7.0 -7.2,分装,灭菌。
PDA培养基:称取200 g马铃薯,洗净去皮切成条状,加适量水煮沸20min,纱布过滤,滤液中加入20 g葡萄糖和18 g琼脂,定容至1000mL,煮沸后分装,灭菌。
Waksman培养基:依次准确地称取蛋白胨5 g,葡萄糖10 g,牛肉浸膏3 g,NaCl 5 g,放入少量水搅拌加热使之熔化,定容至1000mL,加入琼脂粉20 g,继续搅拌加热使之熔化。使用1 mol/L NaOH和1 mol/L HCl调节 pH至6.8,分装,灭菌。
1.2 内生细菌的分离
运用组织研磨法[6],采集病区健康的西瓜植株样品,用蒸馏水将表面冲洗干净,用灭菌滤纸吸干水分。用无菌刀将植株根的表皮切去,切成1.0~2.0 cm小段,在体积分数75%乙醇消毒液中浸泡30 s,1 g/L升汞液中消毒3min,无菌蒸馏水漂洗4次,最后一次洗涤液涂布平板做空白对照。将样品置于灭菌的研钵中研磨,加适量无菌水研磨至匀浆状。取1mL液体梯度稀释成10-1-10-7,分别取10-5、10-6、10-7梯度下的50μL稀释液涂布于NA平板,重复3次,置于28℃恒温箱中培养。2 d后,挑取形态、大小和颜色等特征不同的菌落重新于NA平板上划线纯化,最后移入斜面试管于4℃冰箱中保存,备用。若对照处理的平板上无菌落出现,表明植株材料表面消毒彻底,分离到的为内生细菌。
1.3 拮抗细菌的筛选
1.3.1 初筛 采用平板对峙法[7],将PDA平板上活化的西瓜枯萎病菌用打孔器打成直径为6mm的菌饼,置于Waksman平板中央,在距其2 cm处呈三点对称接入内生细菌,以只接入枯萎病菌的处理为对照。置于28℃培养,待对照长满全皿时,测量抑菌带大小。挑取对靶标病原菌有明显抑制作用的菌株,纯化后保存,备用。
1.3.2 复筛 (1)西瓜枯萎病菌孢子悬浮液的制备。将西瓜枯萎病菌接种于PDA平板,25℃倒置培养5 d。挑取经平板活化的病原菌菌丝块于PDA培养液,25℃,160 r/min振荡培养一周,备用,显微镜下观察产孢情况。
(2)供试菌株无菌滤液的制备。用接种环蘸取初筛的菌株接入盛有100mL NA培养液的250mL三角瓶中,28℃,160 r/min培养2 d,得到拮抗菌悬浮液。取适量菌悬浮液,8000 r/min离心10min,上清液经微孔滤膜(Ф=0.22 μm)过滤,即为无菌滤液。
采用抑菌圈法[8],在灭菌的培养皿中倒入10mL PDA培养基,待冷却后将牛津杯左右对称置于平板上,再将混有病原菌孢子悬浮液的Waksman培养基缓缓倒入培养基中,冷却。在左侧牛津杯中滴加200μL拮抗菌无菌滤液,右侧牛津杯中滴加NA培养液,28℃培养,待菌丝长满全皿时,测量抑菌圈大小。
1.4 拮抗菌株XG-1的抑菌谱测定
同样采用平板对峙法,测定拮抗菌株对棉花枯萎病菌、棉花黄萎病菌、棉花立枯病菌、油菜菌核病菌、小麦赤霉病菌的抑菌活性。
1.5 拮抗菌株XG-1的鉴定
1.5.1 形态特征 参照《常见细菌系统鉴定手册》[9],按照常规细菌学方法进行鉴定。
1.5.216 S rDNA序列分析 模板:菌株XG-1基因组DNA。引物为通用引物:16(+):5'-AGAGTT TGA TCA TGG CTC AG -3';16(-):5'-TAG GGT TAC CTT ACG ACT T -3'。PCR 扩增体系(20μL):模板DNA 1.5μL,引物(0.05 mol/L)各1μL,TaqTM1.5μL,Mg2+(25mmol/L)2μL,10 ×Buffer 2μL,dNTP(10mmol/μL)0.5μL。PCR反应条件:94℃预变性10min;94℃ 变性1min,55℃退火1min,72℃延伸1.5min,30个循环;72℃延伸10min。PCR产物采用TIANGEN的DNA凝胶回收试剂盒回收DNA片段,测序由上海博亚生物技术有限公司完成。应用BLAST软件进行序列分析,并与GenBank中已知的16S rDNA进行同源性分析。
1.6 拮抗菌XG-1对病原菌菌丝生长的影响
进行平板对峙培养的培养皿中,在西瓜枯萎病菌菌落和拮抗菌菌落之间放置灭菌的盖玻片,培养5 d,待菌丝爬上后,取出盖玻片置于光学显微镜下观察菌丝形态变化。
1.7 拮抗菌XG-1对病原孢子萌发的影响
以凹玻片法进行测定[10],用无菌水配制浓度约为1.0×105个/mL的西瓜枯萎病菌孢子悬浮液,吸取20μL加入凹玻片中,分别按体积比1∶1混入100%、60%、40%和20%的菌株XG-1无菌滤液,使得无菌滤液终浓度为50%、30%、20%和10%,置于保湿培养皿内,25℃下培养,12 h后光学显微镜下镜检其孢子萌发情况,以芽管长度超过孢子直径一半作为萌发标准,每处理检测100个孢子,设3次重复。以NA液体培养基代替无菌滤液为对照,计算孢子萌发率和萌发抑制率,公式如下。

2 结果与分析
2.1 内生细菌的分离与筛选
从湖北荆州地区采集的西瓜样品分离得到细菌97株,初筛得到具有拮抗效果的细菌6株(表1)。其中菌株XG-1抑菌带最大,达26.2mm(图1),能有效抑制西瓜枯萎病菌的生长。对菌株HL-2等6株菌株复筛结果表明,菌株XG-1的抑菌圈直径(21.4mm)仍为最大(图2)。
2.2 拮抗菌XG-1的抑菌谱测定
平板对峙培养结果表明,菌株XG-1具有较为宽广的抑菌谱,与所有供试的病原真菌对峙培养7 d后,均能产生明显的抑菌带,如表2所示。其中,对棉花枯萎病菌的抑制作用最强,抑菌带宽达23.1mm。
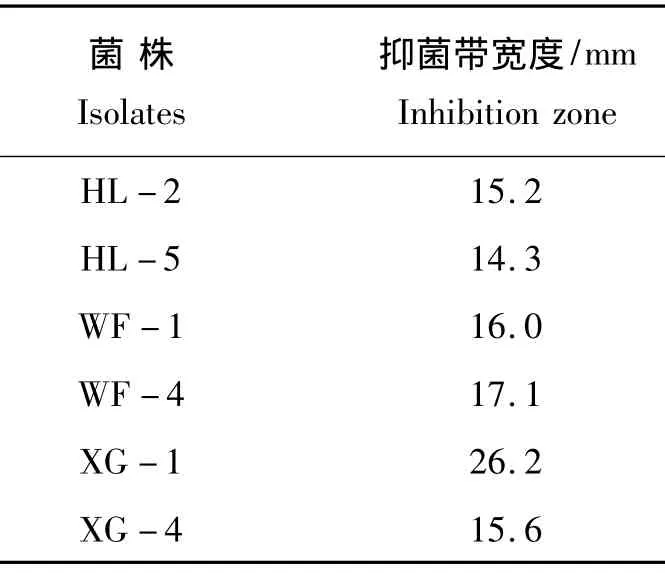
HL -2 15.2 HL -5 14.3 WF -1 16.0 WF -4 17.1 XG -1 26.2 XG -4 15.6

图1 菌株XG-1与西瓜枯萎病菌(FON)的对峙培养Fig.1 Confrontation culture of strain XG -1 and FON
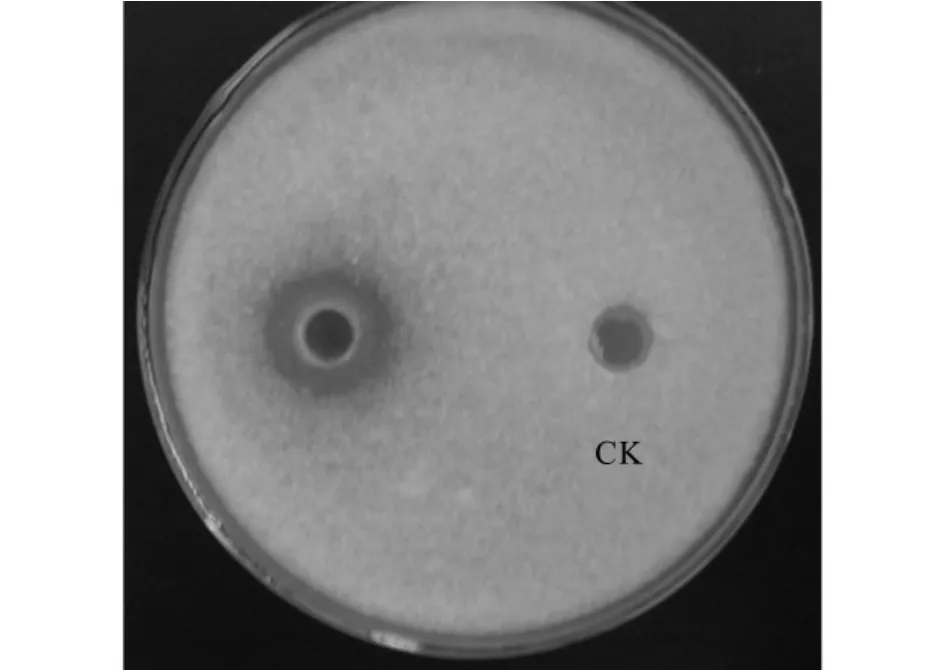
图2 菌株XG-1对西瓜枯萎病菌(FON)的抑制作用Fig.2 Inhibitory effect of strain XG -1 on FON

表2 菌株XG-1抑菌谱的测定Tab.2 Test of strain XG-1 antibacterial spectrum
2.3 拮抗菌株的鉴定
2.3.1 形态特征鉴定 菌株XG-1在NA培养基上生长良好,菌落表面粗糙,不透明,污白色。圆形或不规则形,边缘不光滑,随时间培养的延长,菌落边缘呈锯齿状,表面干燥皱缩。革兰氏染色呈阳性,菌体为杆状,有芽孢。初步将菌株XG-1鉴定为芽孢杆菌属(Bacillus)。
2.3.2 分子鉴定提取菌株XG-1基因组DNA为模板,以细菌16S rDNA通用引物进行PCR扩增。再经1%琼脂糖凝胶电泳,结果表明在1500 bp左右有一条明显的条带。切胶回收后交上海博亚公司测序,在 GenBank中的登录号为KC348439,进行 Blast同源序列比对,与枯草芽孢杆菌(Bacillus subtilis)相似性达99%,结合菌株XG-1形态特征,将其鉴定为枯草芽孢杆菌。
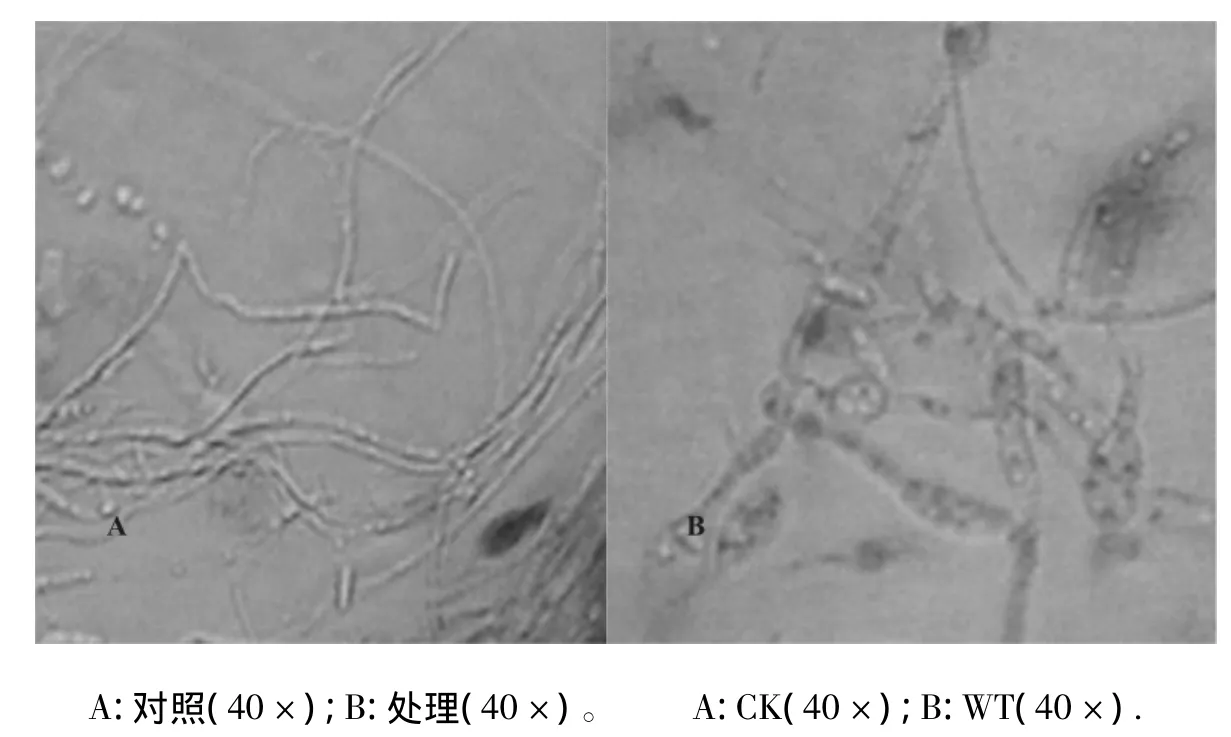
图3 拮抗菌XG-1对西瓜枯萎病菌(FON)菌丝生长的影响Fig.3 Effect of antagonistic strain XG -1 on FON mycelia growth
2.4 拮抗菌XG-1对病原菌菌丝生长的影响
将菌株XG-1与西瓜枯萎病菌对峙培养5 d后,靠近接抗菌的病菌不能正常扩展生长,取出盖玻片显微观察。结果图3所示,对照菌丝表面光滑,生长茂盛,而对峙培养的菌丝稀疏,原生质浓缩,出现空泡,部分发生断裂,膨大。
2.5 拮抗菌XG-1无菌滤液对病原菌孢子萌发的影响
XG-1无菌滤液与西瓜枯萎病菌孢子悬浮液按不同浓度共培养12 h后,镜检结果如图4所示,从中可看出,XG-1无菌滤液对西瓜枯萎病菌孢子萌发具有较强的抑制作用,随着浓度的增加而增加,当无菌滤液浓度为50%时,抑制率达到72.89%,当浓度为10%时,抑制率仅为15.51%。

图4 菌株XG-1无菌滤液对西瓜枯萎病菌(FON)孢子萌发的抑制Fig.4 Inhibition of cell-free filtrate of strain XG -1 on the germination of FON spores
3 结论与讨论
随着人们对环境及健康意识的提高,人们对植物病害的防治观念逐渐由传统的化学防治转变到生物防治[11]。目前,用于西瓜枯萎病的生防菌主要集中在丛枝菌根(AM)真菌及根际土壤微生物[12-14],有关利用植物内生菌进行西瓜枯萎病防治的研究报道不多。研究表明,在植物体内存在着大量的对植物病害具有较好防治作用的内生菌,这些内生菌对化学药剂难以发挥作用的植物土传病害、维管束病害更显示其独特的优势[15]。宋光桃[16]从健康油茶组织中分离筛选出枯草芽孢杆菌R6,对油茶根腐病菌的抑菌圈半径达12mm。本研究通过平板对峙及抑菌圈法双重法,从西瓜植株内分离筛选到一株对西瓜枯萎病菌具有较强抑制作用的细菌XG-1,抑菌圈直径达21.4mm,并将其鉴定为枯草芽孢杆菌(Bacillus subtilis)。
芽孢杆菌由于自身的众多优势,广泛存在于自然界,生长快、营养简单、易分离培养,其开发与应用是一直是生物防治的热点。本试验中,枯草芽孢杆菌XG-1对西瓜枯萎病菌菌丝生长具有较强的抑制作用,使其变得稀疏,出现畸形特征,还能抑制病原孢子的萌发,这与LIU[17]等的研究报道相符。
近年来,植物内生枯草芽孢杆菌活性物质的研究较多,认为其产生的抑菌物质主要包括细菌素、活性蛋白及脂肽类、多肽类等[18]。江木兰[19]从油菜内生枯草芽孢杆菌BY-2的胞外抑菌物中分离纯化出枯草菌表面活性素Surfactin。本研究发现,菌株XG-1的无菌滤液能形成明显的抑菌圈,表明其胞外产生了活性物质,具体类型及性质有待进一步研究。
[1]Fravel D,Olivain C,Alabouvette C.Fusarium oxysporum and its biocontrol[J].New Phytologist,2003,157:493-502.
[2]Zhang Z,Zhang J,wang Y.Molecular detection of F.oxysporum f.sp.niveum and Mycosphaerella melonis in infected plant tissues and soil[J].FEMS Microbiol Lett,2005,249:39-47.
[3]Ozaktan H,Bora T.Biological control of Fusarium oxysporum f.sp.melon is by the formulations of Fluorescent pseudomonas[J].Journal of Turkish Phytopathology,2000,29(23):133 -149.
[4]邓振山,马娜娜,徐文梅,等.大蒜鳞茎中抗番茄灰霉病内生菌的筛选及其防治效果[J].西北农林科技大学学报:自然科学版,2012,40(5):50 -56.
[5]Li Shubin,Fang Mao,Zhou Renchao,et al.Characterization and evaluation of the endophyte Bacillus B014 as a potential biocontrol agent for the control of Xanthomonas axonopodis pv.dieffenbachiae- Induced blight of Anthurium[J].Biological Control,2012,63:9 -16.
[6]李强,刘军,周东坡,等.植物内生菌的开发与研究进展[J].生物技术通报,2006(3):33-37.
[7]方中达.植病研究法[M].3版.北京:中国农业出版社,1998:46-47.
[8]Bergl G,Fritze A,Roskot N,et al.Evaluation of potential biocontrol rhizobacteria from different host plants of Verticillium dahliae Kleb[J].Journal of Applied Microbiology,2001,91:963 -971.
[9]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:267-295.
[10]王晶晶,蒋士君,常淑娴,等.两株生防菌对烟草黑胫病的抑制活性及其鉴定[J].中国烟草学报,2011,17(6):89-93.
[11]Fernando W G D,Nakkeeran S,Zhang Y,et al.Biological control of Sclerotinia sclerotiorum(Lib.)de Bary by Pseudomonas and Bacillus species on Canola petals[J].Crop Protection,2007,26(2):100 – 107.
[12]宋顺华,吴萍,邢宝田.多粘类芽胞杆菌WY110对西瓜枯萎病的控制作用[J],植物保护学报,2011,38(6):571-573.
[13]赵丽明,丁延芹,路晓萌,等.西瓜根际枯萎病拮抗放线菌的筛选及鉴定[J].生物技术通报,2010(5):107-110.
[14]李敏,刘润进,赵洪海.AM真菌和镰刀菌对西瓜根系几种酶活性的影响[J].菌物系统,2001,20(4):547-551.
[15]徐大可.一株具有抑菌活性的越橘内生细菌的研究[D].大连:大连理工大学,2007.
[16]宋光桃,周国英,刘君昂,等.油茶根腐病拮抗内生细菌的筛选及鉴定[J].植物保护学报,2010,37(2):137-140.
[17]Liu Yan,Tao Jing,Yan Yujun,et al.Biocontrol efficiency of Bacillus subtilis SL-13 and characterization of an antifungal chitinase[J].Chinese Journal of Chemical Engineering,2011,19(1):128 -134.
[18]刘雪,穆常青,蒋细良,等.枯草芽孢杆菌代谢物质的研究进展及其在植病生防中的应用[J].中国生物防治,2006,22(1):179-184.
[19]江木兰,王国平,胡小加,等.油菜内生菌BY-2的脂肽类抑菌物质的分子结构鉴定[J].中国油料作物学报,2010,32(2):279-284.
