菜心cDNA-AFLP分析体系的优化与建立
2013-04-11肖旭峰雷建军
肖旭峰,王 恒,黄 敏,雷建军
(1.江西农业大学 农学院,江西 南昌 330045;2.华南农业大学 园艺学院,广东 广州 510128;3.江西农业大学 林学院,江西 南昌 330045)
cDNA-AFLP(cDNA amplified fragment length polymorphism)技术的出现是RNA指纹技术重大突破。该技术以mRNA反转录的cDNA为研究对象,具有重复性好、灵敏度高、可靠性强等优点,对生物体转录组可进行全面、系统的分析,目前仍被用于分析转录组,寻找差异表达基因最有效的手段之一[1],现已从牵牛花、马铃薯、大白菜、玉米、棉花等植物中分离和克隆了多个有价值的基因[2]。
菜心 (Brassica rapa syn.campestris L.ssp.chinensis var.utilis Tsen et Lee)是目前我国华南地区栽培规模最大的特产蔬菜之一[3]。菜心的花薹形成是一种抽薹现象,植株从花芽分化至开花的整个过程,经历了花芽形成、促进花芽发育、花芽成熟、抽薹及开花等过程[4],可能涉及到多个相关基因表达调控。利用cDNA-AFLP技术分离获得调控菜心抽薹的功能基因,从分子水平上调控功能基因表达来促进菜心花薹形成,从而达到提高菜心经济产量的目标,是一个具有重要现实意义的课题。然而,cDNAAFLP技术的操作要求较高,过程较繁琐。整个流程从总RNA提取,双链cDNA合成,限制性内切酶酶切,接头连接,预扩增,选择性扩增至PAGE电泳,中间每个步骤环环相扣,任何细节都可能影响到整个实验成败[5-7],因此优化和建立适合菜心cDNA-AFLP的反应体系显得尤其重要。本文以菜心顶端分生组织为试材,对cDNA-AFLP反应体系中关键影响因素进行优化,建立适用于菜心抽薹相关基因分离研究的反应体系,为菜心抽薹的分子机理进一步深入研究奠定基础。
1 材料与方法
1.1 材 料
供试材料为菜心早熟品种“油青49”及晚熟品种“油青甜菜心80天”,于2011年春季种植于江西农业大学蔬菜试验基地,取第一、二、三、五片真叶及开花5个时期顶端分生组织(生长点),液氮处理后-80℃冰箱保存备用。
1.2 主要试剂
Trizol试剂(Invitrogen 公司);Power ScriptTMReverse Transcriptase、Advantage 2 Polymerase Mix(CLONTECH公司;限制性内切酶Taq I与Ase I(NEB公司);T4连接酶、Taq酶、dNTPs、DL2000等(宝生物工程(大连)有限公司);水饱和酚、亲和硅烷、剥离硅烷、尿素、丙烯酰胺和甲叉双丙烯酰胺等(北京鼎国生物技术有限公司);其他试剂均为国产分析纯。
1.3 接头及相关引物
反转录合成cDNA的引物序列参考BD SMARTTMPCR cDNA Synthesis Kit说明书,引物AFLP分析用接头和引物见表1,接头与引物由上海生物工程技术服务有限公司合成。
1.4 方法
1.4.1 RNA提取与cDNA合成 采用Trizol法分离纯化菜心顶端分生组织总RNA,具体步骤参照Invitrogen公司Trizol Reagent说明书进行,15 g/L琼脂糖凝胶电泳检测总RNA完整性。双链cDNA合成步骤则参照CLONTECH公司SMARTTMcDNA Library construction kit说明书。
1.4.2 cDNA的酶切与接头连接 采用Taq I和Ase I两种限制性内切酶对cDNA进行分步酶切。先用TaqI酶切,酶切温度65℃,3 h。体系为cDNA(约100 ng)8μL,Taq I(10 U)1μL,10×NEB buffer 32μL,10 ×BSA 0.2μL,补充ddH20 至总体积20μL;然后再用Ase I酶切,温度为37℃,3 h。在上述酶切体系中加入Ase I(10 U)1μL,10×Ase I buffer 1μL,补充ddH20至总体积30μL,37℃再保温酶切3 h。双酶切结束后,取8μL酶切产物用于电泳,检测是否酶切完全。

表1 cDNA-AFLP接头与引物核苷酸序列Tab.1 Adapters and primers sequence of cDNA-AFLP analysis system
对双酶切产物连接接头,其体系为双酶切后的产物22μL,Taq I(50μmol/L)接头1μL,Ase I(5μmol/L)接头 1μL,T4Linkage buffer 3μL,T4连接酶 1μL,最后补充 ddH20 至总体积 30μL,16 ℃恒温槽下连接过夜。取5μL于10 g/L琼脂糖凝胶电泳检测。

图1 菜心顶端分生组织总RNA电泳Fig.1 Total RNA analysis from shoot tips

图2 反转录合成双链cDNAFig.2 The amplification of double-strand cDNA
1.4.3 PCR体系优化 预扩增反应体系如下:连接产物5μL,模板稀释倍数分别设定了5、10、15、20倍 4 个梯度用于预扩增,上、下游引物各 1μL,10×PCR Buffer 2.5μL(不含 Mg2+),Mg2+(25mmol/L)分别筛选 1.5,1.8,2.0,2.5μL 4 个梯度,dNTPs(10mmol/L)0.5μL,Taq 酶(5 U)0.4μL,补充 ddH20至总体积25μL。PCR反应条件为:94℃预变性1min;94℃ 30 s,退火温度分别筛选52,54,56,58℃ 4个梯度,循环数设定15、18、21、24、27和306个梯度,72℃延伸1min,15 g/L琼脂糖凝胶电泳检测,筛选最佳预扩增体系。
选择性扩增反应体系与最佳预扩增体系相同,用选择性扩增引物代替相应的预扩增引物,将预扩增产物稀释20倍作为选择性扩增的模板。
反应结束后,取5μL产物用Bio-Rad公司POWER PAC3000垂直电泳仪电泳,电泳温度设定为45℃,80 W恒定功率电泳约90min。银染显色。
2 结果与分析
2.1 总RNA提取及双链cDNA合成
高纯度及完整性好的总RNA制备是cDNAAFLP成功的关键,尤其对低表达丰度基因的分离[8]。由图1可知,利用 Trizol法提取的菜心总RNA带型清晰整齐,点样孔干净,没有拖尾和弥散,28 S宽度和亮度约是18 S的2倍,表明该方法提取的总RNA完整性好,杂质去除彻底,适用于双链cDNA合成。
双链cDNA合成是cDNA-AFLP技术体系中一个重要的限速步骤,双链cDNA质量好坏与后续实验成败有直接地关系[4]。根据CLONTECH公司发明的SMART法技术原理,将获得的总RNA为模板,省略了mRNA纯化步骤,也能成功获得带型清晰明亮,弥散带分布于0.5~8 kb的双链cDNA,表明该试剂盒方法合成菜心cDNA双链完全能满足后续实验的要求,其中合成的最佳循环数为24个(图2)。

图3 双链cDNA酶切电泳结果Fig.3 The products of double-strand cDNA
2.2 酶切检测
双链cDNA是否被完全酶切是影响cDNA-AFLP多态性信息量准确的根本保证[9]。TaqI和AseI两个限制性内切酶被广泛应用在不同物种中的双链cDNA酶切。由图3可知,cDNA条带呈均匀的弥散状;与未酶切产物相比,酶切后cDNA片段分布范围已明显减小,且大部分聚集在100~1000 bp,说明双链cDNA酶切较彻底,适合下一步接头连接与多态性扩增。
2.3 预扩增体系优化
预扩增的目的是为了纯化模板,为下一步选择性扩增作准备[10]。分别对影响预扩增反应的关键因子,如模板稀释倍数、扩增循环数、退火温度及Mg2+浓度进行优化。连接产物稀释5、10、15和20倍后对预扩增影响结果较显著。稀释20倍模板获得产物弥散带范围更大,亮度更强,说明20倍是该反应中最佳模板稀释倍数(图4A)。不同循环次数(图4B)对预扩增反应的影响也较大,条带亮度随循环数增加而增强,其中27个循环数扩增的条带亮度最强,效果最佳。预扩体系中分别加入Mg2+(25mmol/L)1.5,1.8,2.0,2.5μL,,筛选最适宜的 Mg2+量,结果发现 Mg2+对预扩增影响较大(图 4C),其中加入了2.5μL Mg2+(25mmol/L)的扩增产物条带最亮,且均匀一致,是最佳Mg2+用量。筛选不同的退火温度对预扩增反应的影响,结果差异不大。从图4D可知,50~58℃均适合于预扩增反应。

图4 预扩增体系优化电泳检测Fig.4 Improvement of pre-amplification system
2.4 选择性扩增产物聚丙烯酰胺凝胶电泳(PAGE)
选择性扩增是从扩增产物中筛选出能被合适引物组合选择性碱基识别的片段,结果通常用高分辨PAGE电泳检测[11]。选择性扩增产物分别用琼脂糖凝胶电泳及PAGE电泳检测,扩增的主带清晰明亮,扩增信号强度基本一致,扩增条带密度分布均匀,且主要分布于100~800 bp(图5),说明通过优化影响菜心cDNAAFLP分析体系关键因子,建立了适合菜心抽薹开花相关基因分离反应体系,为深入研究菜心抽薹分子机理奠定了基础。
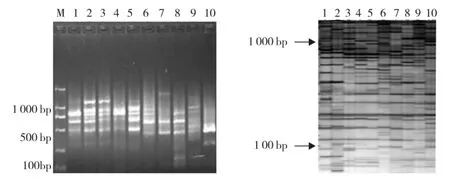
图5 选择性扩增产物琼脂糖凝胶电泳及PAGE电泳检测Fig.5 The products of selective amplification by gel Electrophoresis
3 讨论
高质量RNA及双链cDNA合成均是cDNA-AFLP分析基因差异表达的关键因子。完整的RNA能正确地反映作物的转录组信息[12]。利用Trizol法获得菜心的总RNA,其点样孔干净,没有拖尾与弥散,表明蛋白质污染少,质量较高,符合菜心cDNA-AFLP实验要求。SMART法是目前双链cDNA合成应用较广泛的方法之一,该方法直接利用作物总RNA为模板,合成高质量、高产量的双链cDNA,省略了mRNA纯化步骤,从而降低了实验成本,减少了基因信息丢失或改变[13-14],适合菜心抽薹转录组的差异分析。其次,应用经典双酶组合Taq I/Ase I对菜心双链cDNA进行酶切,获得的酶切片段是随机的,通常几十至数千个碱基的跨度,但大部分集中于100~1000 bp,是cDNA-AFLP获得双酶切产物的理想结果。再次,以连接产物为模板,其稀释浓度的大小对预扩增反应的质量和效率有直接影响力[15]。扩增条带随模板稀释倍数增大而增强,这可能是由于过高浓度的模板使引物或dNTP提早耗尽,导致预扩增产物产量较低的原因[16]。
循环数是影响本实验预扩增结果的重要因素。众所周知,循环数增加有利于目的片段数目增长,但循环扩增次数太多可能会导致非预期杂带的比例也增大,这是由于引物非特异性结合或Taq酶活性下降所致[16]。27个循环数获取的产物与较小循环数扩增的产物相比,其带型结构基本一致但弥散带更清亮;而30个循环扩增,其带型结构已发生明显变化,说明PCR过程可能出现了非特性扩增现象,不能应用于后续选择性扩增实验。
与前人的研究报道不太一致[17-19],Mg2+浓度是本实验PCR扩增反应中最关键的影响因子。Mg2+浓度是影响PCR结果的重要变量之一,反应中Taq堂甘荕g2+的依赖酶,对Mg2+浓度特别敏感,最佳Mg2+浓度不仅有利于酶活性提高从而增加扩增产物产率及质量,而且对反应特异性、引物退火、模板、PCR产物解链温度、引物二聚体形成等均有影响[20]。实验体系中加入2.5μL Mg2+(25mmol/L)扩增的产物,其检测的结果明显更好,获得的指纹丰富程度及有价值的位点的比例明显更多,是菜心PCR扩增的最佳Mg2+(25mmol/L)用量。最后,将获得选择性扩增产物经聚丙烯酰胺凝胶电泳(PAGE)检测,发现带型清晰、分辨率高、扩增信号强度基本一致、覆盖面广、重复性好等,说明优化和建立的菜心cDNA-AFLP分析体系适用于分析并研究菜心抽薹开花转录组差异显示基因,为菜心抽薹分子机制研究提供重要参考。
[1]Durrant W E,Rowland O,Piedras P,et al.cDNA -AFLP reveals a striking overlap in race-specific resistance and wound response gene expression profiles[J].The Plant Cell,2000,12(6):963-977.
[2]郭莹,杨晓云,张青霞,等.大白菜cDNA-AFLP分析体系的优化[J].分子植物育种,2010,8(5):1003-1007.
[3]蔡绵聪,李淑仪,陈真元,等.菜心氮磷钾施肥效应研究[J].土壤通报,2010,41(1):126 -132.
[4]肖旭峰,曹必好,王勇,等.菜薹花芽分化及BrcuFLC基因的克隆与表达[J].园艺学报,2008,35(6):827-832.
[5]赵丽华.石榴 AFLP 反应体系的建立及优化[J].北方园艺,2012,21:79-82.
[6]于虹,丁国华.cDNA-AFLP技术及在差异表达基因克隆上的应用[J].中国农学通报,2007,23(12):77-80.
[7]康俊根,王晓武,张国裕,等.利用cDNA-AFLP检测甘蓝雄性不育相关基因的时序性表达[J].园艺学报,2006,33(3):544-548.
[8]王永勤,曹家树,符庆功,等.利用cDNA-AFLP技术分析白菜核雄性不育两用系的表达差异[J].中国农业科学,2003,36(5):557 -560.
[9]万翔,刘富中,宋明,等.茄子AFLP技术体系的优化与建立[J].西南农业大学学报,2005,27(2):226-229.
[10]付凤玲,李晚忱.用cDNA-AFLP技术构建基因组转录图谱[J].分子植物育种,2003,1(4):523-529.
[11]田胜平,汪阳东,陈益存,等.山苍子AFLP反应体系的建立及其引物筛选[J].林业科学研究,2012,25(2):174-181.
[12]吴智明,曾晶,胡开林,等.辣椒cDNA-AFLP体系的优化与应用[J].中国农学通报,2010,26(12):26-29.
[13]唐美琼,姚绍嫦,李林轩,等.药用植物草珊瑚AFLP反应体系的建立[J].湖北农业科学,2012,51(17):3879-3881.
[14]王忠,杨清,汪仁,等.野生茄子cDNA-AFLP分析体系的优化和建立[J].生物技术,2012,9:108-112.
[15]许锦彪,段彪,邵园元,等.水稻叶片cDNA-AFLP技术体系的建立和优化[J].种子,2012,31(6):33-39.
[16]黄河,王顺利,曹华雯,等.甘菊 cDNA -AFLP 反应体系的优化[J].生物技术通报,2009,11:108 -113.
[17]李亚丽,沈文涛,言普,等.建立番木瓜性别研究的 cDNA-AFLP分析体系[J].热带作物学报,2009,30(4):515-519.
[18]郭彦彦,唐文煜,邢世岩,等.银杏AFLP反应体系的建立及优化[J].江西农业大学学报,2006,28(3):377-381.
[19]佟广香,匡友谊,尹家胜,等.唇螖基因组AFLP反应体系的建立及优化[J].江西农业大学学报,2009,31(4):727-733.
[20]桑燕,汤青林,王志敏,等.芥菜 cDNA -AFLP 反应体系的优化[J].西南大学学报,2008,30(4):101-105.
