刺五加鲨烯合酶基因的表达及其对皂苷含量的影响
2013-04-10邢朝斌龙月红劳凤云庄鹏宇修乐山
邢朝斌,龙月红,劳凤云,庄鹏宇,修乐山
(河北联合大学a.生命科学学院;b.药学院,河北 唐山 063000)
刺五加Eleutherococcus senticosus是我国传统的珍贵药用植物,其根、茎、叶均可入药,具有增强免疫力、抗疲劳、抗衰老等多种生物活性,三萜皂苷类化合物是其主要活性成分之一[1-2]。有关研究结果表明,三萜皂苷的含量和组成随着植物的遗传背景、组织类型、生长年龄、生理状况及环境因子的变化而发生显著的变化,而其变化又取决于三萜皂苷合成途径中的一些关键酶基因及其在细胞中的表达水平[2-3]。三萜皂苷类化合物在生物体中均需通过依赖甲羟戊酸的类异戊二烯进行合成[3,5],在合成途径中,鲨烯合酶(squalene synthase,SS)催化两分子的法呢酰基二磷酸合成鲨烯,是三萜皂苷类化合物生物合成的第一个关键步骤[6]。
目前,本实验室已经克隆出刺五加的SS基因[7]和作为内参照基因的甘油醛-3-磷酸脱氢酶(GAPDH)基因[8]的cDNA序列,并利用基于光密度值分析的终端相对定量RT-PCR法初步分析了其表达情况[9]。但该方法将扩增效率假定为1,而实际中难以达到,从而造成了分析结果准确性低的弊端[10-11]。实时定量PCR(quantitative real time PCR,qRT-PCR)技术因在指数扩增期间,通过连续监测荧光信号强弱的变化即时测定特异性产物的量来推断目的基因的初始量,所以可克服终端定量存在的弊端[12]。文中采用qRT-PCR法检测了刺五加不同生长发育时期其不同器官和不同皂苷含量组间的SS基因表达情况,并分析了其对刺五加中皂苷含量的影响情况,以期为阐明刺五加的皂苷合成机理奠定基础。
1 材料与方法
1.1 材 料
供试的刺五加分别为采自于辽宁省本溪市,吉林省穆棱市、珲春市、梅河口市、伊通满族自治县,黑龙江省鸡西市和河北省兴隆县的3年生野生刺五加。经河北联合大学生命科学学院邢朝斌副教授鉴定,其为五加科植物刺五加E.senticosus。
1.2 试 剂
SYBR Premix Ex TaqTM II购于宝生物工程(大连)有限公司;Taq酶、植物RNA提取试剂 盒、RevertAidTM First strand cDNA synthesis Kit(Fermentas)和dNTPs购于天根生化科技(北京)有限公司;齐墩果酸对照品(批号为110709-200505,购于中国药品生物制品检定所,用于测定刺五加总皂苷含量);甲醇、香兰素、乙醇、浓硫酸、石油醚均为国产分析纯;市售娃哈哈纯净水。
1.3 仪 器
UV-9100紫外-可见分光光度仪(北京瑞利分析仪器公司);KDC-16H高速台式离心机、1 /1万电子天平(上海亚荣仪器厂);FW 100型高速万能粉碎机(天津市泰斯特仪器有限公司);RE-52ZZ旋转蒸发仪(上海亚荣仪器厂);KQ3200DV型数控超声波清洗器(昆山市超声仪器有限公司);Rotor gene 3000 real time PCR 仪(德国Qiagen 公司);CHA-S型气浴摇床(金坛市精达仪器制造厂)。
1.4 方 法
1.4.1 总RNA的提取与逆转录
分别在4月26日(萌芽期)、5月26日(叶片完全展开期)、6月26日(盛花期)、7月26日(果实快速生长期)、8月26日(果实成熟期)和9月26日(叶片衰老期)取叶片、叶柄、茎和根为总RNA提取材料。同时,在刺五加萌芽后,以穆棱产的刺五加为试材,喷施5 mmol/L茉莉酸甲酯(methyl jasmonate,MeJA)于叶片表面,至滴水为止,连续喷施3次,每次间隔5 d,并以蒸馏水为对照,进行平行处理。
按照植物RNA提取试剂盒说明书的要求,称取各刺五加样本0.1 g,提取总RNA。用琼脂糖凝胶电泳检测RNA的完整性,以紫外分光光度法测定其纯度和浓度。参考RevertAidTM First strand cDNA synthesis Kit逆转录试剂的说明,取总RNA 3 μL,以Oligo(dT)18为引物,合成cDNA第一链,反应总体系 20 μL。
1.4.2 引 物
根据已克隆的刺五加SS基因(HQ456918)、GAPDH(HQ184063) 基 因 的 cDNA序 列,利 用Primer premier 5.0设 计real time PCR特 异 性 引 物。GAPDH的 上 游 引 物 为 5′-GATTTGGCATTGTTGAGGG-3′,下 游 引 物 为 5′-TGCTATCGCCTATGAAGTCC-3′;SS 基因的上游引物为 5′-GACACTGTTGAGGATGACACA-3′,下游引物为 5′-GCCAAATCTTCTAACCCAGA-3′。引物由生工生物工程(上海)有限公司合成,PAGE纯化。
1.4.3 Real time PCR反应
以含有刺五加SS基因和GAPDH基因的质粒为标准品,提取高浓度的质粒DNA,10倍梯度稀释,共设5个梯度,用于制作各自的标准曲线。Real time PCR反应总体系为25 μL,其中,10倍稀释的cDNA或各浓度的质粒DNA模板1 μL,上下游引物各 1 μL,SYBR®Premix Ex TaqTMII 12.5 μL,补 dd H2O 至 25 μL。利用 Rotor gene 6 000 real time PCR仪,95 ℃预变性处理30 s后,94 ℃变性 5 s,55 ℃退火 30 s,72 ℃延伸 20 s,40个循环进行PCR扩增。溶解曲线分析温度范围为72~95 ℃,每1 ℃读1次,持续5 s,重复3次。
1.4.4 数据的收集与分析
运用Rotor gene 6软件分别计算每个样品SS基因和GAPDH基因的定量结果,以GAPDH基因的定量结果求出每个样品总RNA加样量的误差,用SS基因的定量结果除以总RNA加样量误差得到校正后的结果。利用如下公式计算各样本中SS基因的表达量:
相对表达量=(待测样品SS基因初始浓度/待测样品GAPDH基因初始浓度)/(对照样品SS基因初始浓度/对照样品GAPDH基因初始浓度)。
1.4.5 刺五加总皂苷含量的测定与相关性分析
参照邢朝斌等人[13-14]的方法进行测定,根据如下回归方程计算刺五加的总皂苷含量:

再根据总皂苷含量,应用SPSS 17.0软件,将刺五加划分为具有极显著差异(P<0.01)的高、中、低含量组,并进行显著性检验和相关性分析。
2 结果与分析
2.1 SS基因在刺五加不同生长发育时期表达量的变化情况
自萌芽期始至叶片衰老期的整个生长期中,刺五加的SS基因均有表达,但表达量呈现出“低—高—低—高—低”的变化趋势(如图1所示)。文中各图中的不同小写字母代表差异显著(P<0.05)。由图1可知,萌芽期(4月26日)其表达量最低,叶片完全展开后(5月26日)其表达量升高至萌芽期的1.56倍,盛花期(6月26日)SS基因的表达量达到整个生长期中的最大值,为萌芽期的3.11倍。进入果实快速生长期(7月26日)时SS基因的表达量降低至萌芽期的2.02倍,但仍显著高于萌芽期的表达量(P<0.05)。果实成熟期(8月26日)时,SS基因的表达量再次小幅升高至萌芽期的2.41倍。至叶片进入衰老期(9月26日)后,SS基因的表达量再次降低,但仍达到萌芽期的1.48倍。
2.2 SS基因在刺五加不同器官中表达量的变化情况
在果实成熟期(8月26日),刺五加不同器官中SS基因均有表达。其中,根中SS基因的表达量显著高于茎、叶和叶柄中的表达量(P<0.05),茎中的表达量最低,仅为根中的51.88%,叶片和叶柄中SS基因的表达量介于根和茎中SS基因的表达量之间,且与根和茎中表达量的差异均达到显著水平(P<0.05),但叶片与叶柄中的表达量间的差异未达显著水平(如图2所示)。
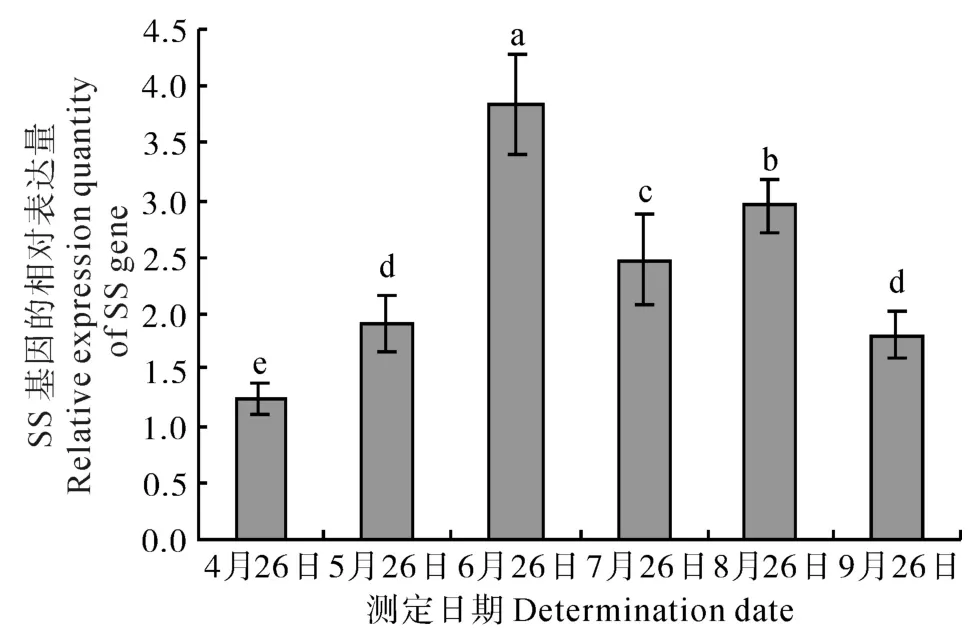
图1 刺五加不同生长发育时期SS基因的相对表达量Fig.1 Relative expression quantity of SS gene at different growth and development stages of E. senticosus
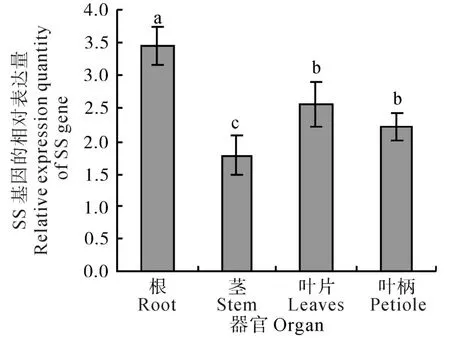
图2 刺五加不同器官中SS基因的相对表达量Fig.2 Relative expression quantity of SS gene in different organs of E. senticosus
2.3 MeJA对SS基因表达的影响
在整个生长期中,MeJA处理与清水处理(对照)的SS基因表达量均呈现出“低—高—低—高—低”的变化趋势(如图3所示),且相同生长发育期内,MeJA处理组的SS基因表达量均略高于对照组的表达量,但差异未达到显著水平。其中,在盛花期(6月26日),MeJA将SS基因的表达量提高到了对照的1.16倍,为提升的最大值。
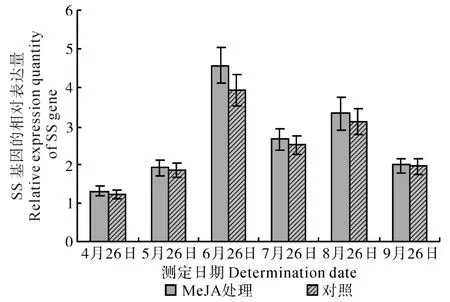
图3 MeJA处理的刺五加SS基因的相对表达量Fig.3 Relative expression quantity of SS gene in E. senticosus treated by MeJA
2.4 刺五加总皂苷含量的分组情况
所测刺五加样本的总皂苷含量为0.871%~3.124%。采用SPSS 17.0软件将30株刺五加划分为具有极显著差异(P<0.01)的高含量组、中含量组和低含量组,每组10株。其中,低含量组、中含量组、高含量组的总皂苷含量分别为0.871%~1.028%、1.273%~1.532%、2.166%~3.124%。高含量组的总皂苷平均含量分别是中含量组和低含量组的1.89和2.79倍。
2.5 SS基因表达对刺五加总皂苷含量的影响
刺五加总皂苷高、中和低含量组样本的SS基因表达量呈现依次降低的变化趋势,且三者间的差异达到极显著水平(P<0.01)(如图4所示)。总皂苷高含量组的SS基因表达量最高,分别达到中、低含量组表达量的1.30和1.51倍。刺五加的总皂苷含量与SS基因的表达量之间呈现出同升同降的变化趋势,存在着极显著的正相关关系(P<0.01)。
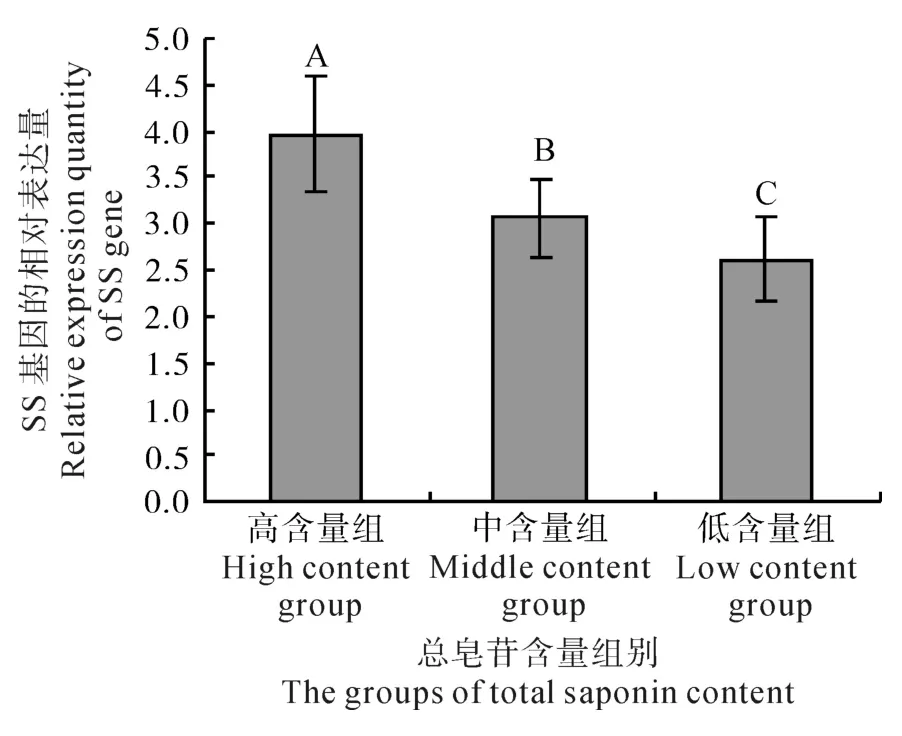
图4 刺五加不同总皂苷含量组的SS基因相对表达量Fig.4 Relative expression quantity of SS gene in E. senticosus with different saponin contents
3 讨 论
鲨烯合酶催化生成的鲨烯是生物合成三萜皂苷类和甾醇类化合物的第一个前体物质[3]。在烟草细胞的培养物中加入真菌诱导子后,可迅速降低其鲨烯合酶的酶活性,进而使甾醇的生物合成和积累受到显著抑制[15]。将人参的SS基因转导入刺五加后,SS基因的过量表达显著促进了甾醇和三萜皂苷类化合物的大量合成[16],而转SS基因的人参再生植株的三萜皂苷产量却达到了对照的3倍[17],这说明,鲨烯合酶在植物甾醇和三萜皂苷的生物合成中具有很强的调控功能。
研究中发现,刺五加的SS基因在其整个生长期中的表达量呈现出如下的变化趋势:自萌芽期开始表达,而后逐渐上升,至盛花期表达量达到最大值,然后下降,至果实成熟期又小幅回升,叶片衰老后再次降低,即“低—高—低—高—低”的变化趋势,这与其总皂苷积累的规律基本相符[18]。刺五加SS基因的表达量与总皂苷含量的相关性分析结果也表明,刺五加的总皂苷含量与SS基因的表达量之间呈现出同升同降的变化趋势,两者间存在极显著的正相关关系(P<0.01),这说明鲨烯合酶在刺五加皂苷的生物合成中发挥着重要作用。对刺五加不同器官中SS基因表达量的分析结果表明,刺五加的SS基因在其根中的表达量最高,叶片次之,叶柄和茎中的较少,这与多数物种中SS基因可在各种组织和器官中进行转录、表达,其中在叶和根部中含量最高[6,19]的特点一致。MeJA可提高多种药用植物中三萜类化合物生物合成关键酶基因的表达量,并进而提高其三萜皂苷的产量[20-21],但在刺五加中MeJA处理组的总皂苷含量和SS基因的表达量虽略高于对照组,但均未达到显著水平。这可能与本实验中MeJA处理的材料为刺五加的植株且其仅在生长期的早期被作短期处理过,而非其他物种中常用的在悬浮培养细胞的培养基中加入MeJA使培养物长期处于MeJA的作用之下有关。
参考文献:
[1]涂正伟,周渭渭,单 淇,等.刺五加的研究进展[J].药物评价研究,2011,34(3):213-216.
[2]李 宏,吴东亮,吴乾隆,等.基于植物区系分析的雾灵山自然保护区种子植物解说对象研究[J].中南林业科技大学学报,2011,31(8):119-124,129.
[3]Haralampidis K,Trojanowska M,Osbourn A. Biosynthesis of triterpenoid saponins in plants [J]. Adv Biochem Eng Biotechnol,2002,75:31-49.
[4]许若娴,曹福祥,彭继庆,等.云南萝芙木异胡豆苷合成酶基因的克隆与分析[J].中南林业科技大学学报,2012,32(6):128-131.
[5]Choi D W,Jung J,Ha Y I,et al. Analysis of transcripts in methyl jasmonate-treated ginseng hairy roots to identify genes involved in the biosynthesis of ginsenosides and other secondary metabolites [J]. Plant Cell Rep,2005,23(8):557-566.
[6]Kim T D,Han J Y,Huh G H,et al. Expression and functional characterization of three squalene synthase genes associated with saponin biosynthesis inPanax ginseng[J].Plant Cell Physiol,2011,52(1):125-137.
[7]龙月红,邢朝斌,王明艳,等.刺五加鲨烯合酶基因cDNA的克隆与序列分析[J].生物技术通报,2012,(2):112-116.
[8]邢朝斌,吴 鹏,陈 龙,等.刺五加GAPDH基因的克隆及序列分析[J].中草药,2012,43(1):155-158.
[9]邢朝斌,龙月红,吴 鹏,等.刺五加皂苷合成关键酶基因表达的半定量RT-PCR分析[J].基因组学与应用生物学,2011,30(6):691-696.
[10]戴 超,刘雪梅,周 菲.白桦基因表达半定量RT-PCR中内参基因的选择[J].经济林研究,2011,29(1):34-39.
[11]孙丰宾,魏继承,刘 瀛,等.白桦钙调蛋白基因CaM的分离及其转录表达[J].经济林研究,2011,29(4):6-12.
[12]Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method [J]. Methods,2001,25(4):402-408.
[13]邢朝斌,龙月红,劳凤云,等.内生真菌对刺五加皂苷合成关键酶基因表达及皂苷含量的影响[J].中国中药杂志,2012,37(14): 2041-2045.
[14]邢朝斌,劳凤云,龙月红,等.刺五加鲨烯合酶和鲨烯环氧酶基因单核苷酸多态性及其与总皂苷量的相关性研究[J].中草药,2012,43(10):2020-2024.
[15]Vogeli U,Chappell J. Induction of sesquiterpene cyclase and suppression of squalene synthetase activities in plant cell cultures treated with fungal elicitor[J].Plant Physiol,1988,88(4):1291-1296.
[16]Seo J W,Jeong J H,Shin C G,et al. Overexpression of squalene synthase in Eleutherococcus senticosus increases phytosterol and triterpene accumulation [J]. Phytochemistry,2005,66(8):869-877.
[17]Lee M H,Jeong J H,Seo J W,et al. Enhanced triterpene and phytosterol biosynthesis in Panax ginseng overexpressing squalene synthase gene[J]. Plant Cell Physiol,2004,45(8):976-984.
[18]孟祥才,颜丙鹏,孙 晖,等.不同性别类型刺五加叶有效成分含量季节积累规律研究[J].时珍国医国药,2011,22(1):88-90.
[19]蒋世翠,刘伟灿,王 义,等.西洋参不同器官中皂苷量与鲨烯合成酶和鲨烯环氧酶基因表达的相关性[J]. 中草药,2011,42(3):579-584.
[20]Kim Y S,Cho J H,Park S,et al.Gene regulation patterns in triterpene biosynthetic pathway driven by overexpression of squalene synthase and methyl jasmonate elicitation inBupleurum falcatum[J]. Planta,2011,233(2):343-355.
[21]Shohael A M,Murthy H N,Hahn E J,et al. Increased eleutheroside production in Eleutherococcus sessiliflorus embryogenic suspension cultures with methyl jasmonate treatment[J].Biochemical Engineering Journal,2008,38(2):270-273.
