18F-FDG PET/CT显像在索拉非尼治疗肝细胞癌预后评估中的应用
2013-03-31李金鹏石丛丛宋金龙
李金鹏, 石丛丛, 宋金龙, 陈 华, 李 蕾
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一[1]。索拉非尼具有抗肿瘤新生血管形成及调节免疫等作用,然而治疗进展期HCC的疗效仍然有限,为进一步探讨索拉非尼治疗的最佳适应证,提高其治疗指数,因此选择合适的患者和监测治疗后效果非常重要。
18F-FDG PET/CT是通过肿瘤对FDG摄取的程度进行功能成像,FDG在HCC肿瘤细胞内的浓聚程度反映HCC的代谢和增殖情况,在恶性肿瘤诊断、分期及疗效评价有独特的应用价值[1]。本研究前瞻性研究了 40例应用索拉非尼治疗的前行18FFDG PET检查的进展期HCC患者,并根据新修订的实体瘤疗效评价标准 (the modified response evaluation criteria in solid tumors,mRECIST)[2]评价其疗效,分析其预后影响因素,现将结果报道如下。
1 材料与方法
1.1 一般临床资料
2005年8月至2011年7月我院收治并完成随访的62例HCC患者。患者均经临床、影像学及甲胎蛋白(AFP)检测确诊,12例经穿刺活检病理证实诊断,无外科治疗指征或本人拒绝手术治疗。纳入标准包括:预计生存时间大于12周,Child-Pugh分级 A/B级,ECOG PS评分0~2,总胆红素(TBIL)≤51.3μmol,丙氨酸转氨酶(ALT)和天冬氨酸转氨酶 (AST)>正常上限值5倍,凝血酶原活动度≥40%,血肌酐(Cr)≤正常1.5倍。根据mRECIST评价标准至少有1个能够被测量的靶病灶。主要排除标准包括近期 (4周内)消化道出血、合并妊娠和Child-Pugh分级 C级。其中40例患者索拉非尼治疗前后行18F-FDG PET/CT检查,其中男29例,女11例;中位年龄48(28~72)岁;ECOG评分,0分16例,1分20例,2分4例;30例为中分化肝癌,10例为低分化肝癌;中位肿瘤直径6.5(1.8~18.3)cm;肿瘤数目1个者8例,2个者18例,3个者9例,4个者5例;门脉主干受侵犯26例,2、3级分支受侵犯14例;伴肺转移30例,肾上腺转移4例,骨转移2例;Child-Pugh A级28例,B级12例;中位血小板计数115(35~367)×109/L;AFP≥400 ng/ml 30例,AFP<400 ng/ml 10例;服用索拉非尼前接受手术治疗6例,射频消融治疗10例,介入治疗20例,放疗2例,化疗2例。
1.2 方法
1.2.1 治疗方案 口服索拉非尼400mg,2次/d。服药期间根据不良反应调整用药剂量。如发生2级以下不良反应的患者对症治疗,2级以上不良反应者需减低1个剂量级,3级或以上不良反应时,则考虑停药至毒性缓解。停药指征为患者出现不能耐受的不良反应或是患者主动要求停止治疗。
1.2.2 疗效评价 首次服用索拉非尼前4周之内行18F-FDG PET扫描,其最大标准化摄取值(SUVmax)作为基线水平。治疗后每4周增强CT或MRI检查1次,根据mRECIST评价标准评价疗效,分完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和进展(PD),以CR+PR+SD计算疾病控制率(DCR)。不良反应分级根据美国国立癌症研究所常见毒性分级标准3.0版(NCICTC3.0)共分1~4级[3]。
1.2.318F-FDG PET/CT显像 采用美国GE公司Discover LS型PET/CT仪。显像剂:18F-FDG由GE公司的Mini Tracer回旋加速器生产并通过自动合成模块自动合成,放化纯度均>95%。
患者检查前血糖 <6 mmol/L,禁食、安静6 h,肘中静脉注射7.4 MBq/kg FDG,平卧休息50 min后全身行PET/CT扫描。PET数据经CT衰减校正后行OSEM重建,在XELERIS工作站采用二维采集OSEM法进行横断面、冠状面和矢状面图像重建,经多层面、多幅成像与CT图像融合。CT扫描参数:电压140 kV,电流80mA,螺距0.75。PET扫描4min/床位。
1.2.4 图像分析 由2名有经验的主治医师职称以上医师共同阅片,对PET/CT原始及融合图像,进行综合分析。PET图像分析采用视觉和半定量分析相结合:① 视觉观察肝脏的大小、形态、放射性分布、有无放射性浓聚灶或稀疏区(高于或低于周围肝组织摄取)。②半定量分析采用SUVmax在浓聚灶部位设感兴趣区(ROI),计算机程序自动计算出该部位的SUVmax。
1.3 统计学方法
采用SPSS19.0软件进行分析。应用Kaplan-Meier法计算中位PFS和OS,用Log-rank法进行差异性检验。Cox风险比例模型分析多个因素对患者预后的影响。P<0.05差异有统计学意义。疾病控制率(DCR)定义为,CT评估最佳应答为CR、PR和SD的患者人数所占总人数的比率;总生存期(OS)定义开始服用索拉非尼至任何原因引起死亡时间间隔;无进展生存期(PFS)定义开始服用索拉非尼治疗至影像学上表现进展或任何原因引起死亡时间间隔。
2 结果
2.1 一般情况
40例中晚期HCC患者接受索拉非尼治疗,其中7例(17.5%)患者因不良反应剂量减半或中断治疗1~2周后均恢复至标准剂量。所有入组患者治疗前行18F-FDG PET/CT检查,其SUVmax的最佳临界值为5.5,SUVmax<5.5组患者14例,SUVmax>5.5组患者26例。两组患者在性别、年龄、ECOG评分、肿瘤分化、肿瘤直径、肿瘤数目、门脉侵犯、肝外转移、HBV感染、Child-Pugh分级、血小板计数、AFP及局部治疗方面差异无统计学意义(P>0.05,表1)。
2.2 PET/CT显像结果
40例患者中,36例患者肝内病灶放射性摄取异常增高,SUVmax为9.79(95%CI:7.38~12.20);34例患者肺内病灶异常放射性浓聚,SUVmax为7.18(95%CI:0.79~13.50);14例淋巴结病灶异常放射性浓聚,SUVmax为9.01(95%CI:6.38~11.64);2例骨病灶异常放射性浓聚,SUVmax为7.09(95% CI:3.46~14.46),4例肾上腺病灶异常放射性浓聚,SUVmax为4.38。
36例肝内病灶异常放射性浓聚患者中,26例肝内局灶残留、复发并合并肝外转移,包括淋巴结转移2例,骨转移2例,表现均为转移病灶异常放射性浓聚;10例患者肝内未见局部残留或复发、转移,但发现肝外转移,包括骨转移2例,淋巴结转移2例,肺转移6例,表现均为转移病灶异常放射性浓聚。肝内病灶的SUVmax值显著高于其他部位病灶SUVmax值(各为10.10和5.61;P<0.05)。
2.3 近期疗效
SUVmax<5.5组ORR为7.14%,SUVmax>5.5组ORR为7.69%,组间比较差异无统计学意义(χ2=0.004;P=0.950);SUVmax<5.5组DCR为64.29%,SUVmax>5.5组DCR为61.54%,组间比较差异无统计学意义(χ2=0.029;P=0.864),见表2。
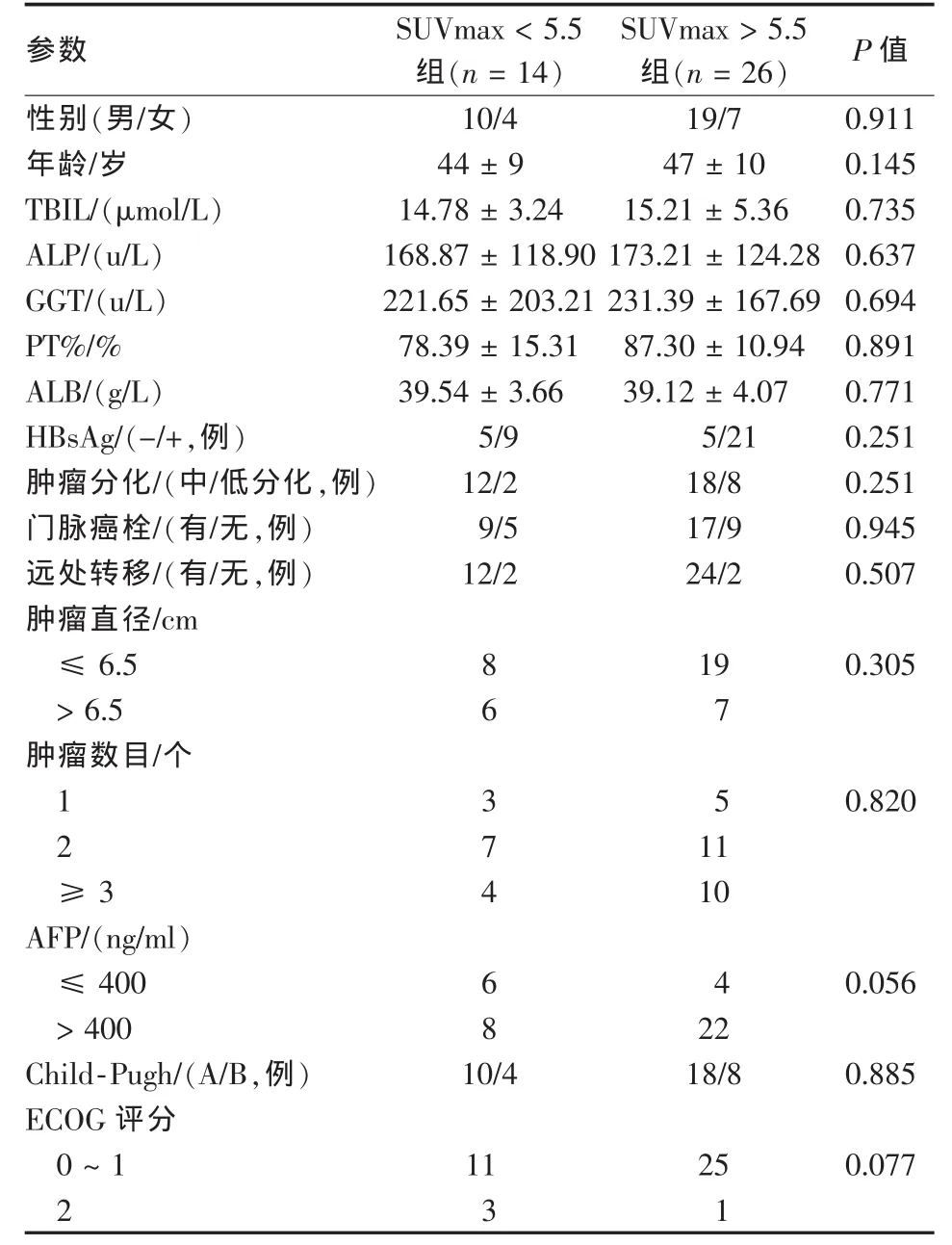
表1 两组患者临床资料比较
2.4 PFS和OS
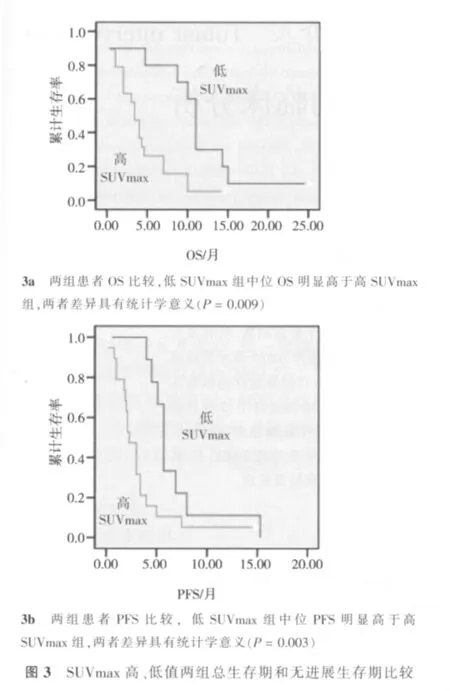
SUVmax<5.5组中位OS和中位PFS分别为11.0和5.7个月,SUVmax>5.5组则分别为4.0和2.3个月,两者相比,低SUVmax组比高SUV组有较高OS和PFS,差异有统计学意义 (P=0.009,P=0.003),见表3。两组患者PET-CT图片见图1、2;两组患者的生存曲线见图3。
多变量分析显示,高SUVmax、ECOG评分、高水平AFP和门脉主干癌栓是降低OS的独立影响因素,高SUVmax、高AFP值是降低PFS独立影响因素(表4)。
2.5 不良反应
治疗期间最常见的不良反应为皮肤损害(30例,75.0%)、腹泻 (21例,52.5%)、高血压 (2例,5.0%)、脱发(5例,12.5%)、骨髓抑制(3例,7.5%)和肝功能损害(8例,20.0%)。全组有7例(17.5%)患者出现3级手足综合征,2例(5.0%)患者出现3级腹泻,其余患者的不良反应均为l~2级,未出现4级与索拉非尼治疗相关的不良反应。

表2 SUVmax<5.5组与SUVmax>5.5组患者近期疗效比较



表3 两组患者OS和PFS比较
3 讨论
多宗临床试验已经证实,索拉非尼可以延长进展期肝癌患者的生存期,部分患者口服药物后肿瘤仍明显进展,如何预测其效能、探讨其影响因素是目前国内外学者研究的热点。Abou-Alfa等[4]研究发现肿瘤细胞磷酸化细胞外信号调节激酶(pERK)水平高的患者TTP较长,可以作为预测索拉非尼疗效的指标。Llovet等[5]报道大型Ⅲ期临床试验SHARP研究结果,证实索拉非尼能有效地阻止病情恶化,显著延长晚期肝癌患者的生存时间,同时也指出寻找预测其疗效的分子生物学标志物的重要性。因此,在新的治疗策略的实施中,若能在早期进行疗效监测和预后监测,同时有针对性的调整治疗计划,可提高HCC患者的生存质量和生存率。
18F-FDG PET/CT是通过肿瘤对FDG摄取的程度进行功能成像,其最大优势在于可以从分子水平检测和识别活体内不同状态下先于组织器官结构变化而发生的代谢改变。研究表明肿瘤细胞FDG摄取与细胞分化程度和倍增时间关联密切[6],故衡量肿瘤FDG摄取高低的SUV值可能成为肿瘤预后因素之一,目前已有研究证实FDG PET在肿瘤的诊断、分期及疗效评估和监测复发等方面发挥重要作用[7]。尽管SUV值是一个半定量指标,与葡萄糖代谢和肿瘤细胞密度密切相关,而肿瘤细胞的高密度和高代谢意味着较差的预后。Lee等[8]报道41例鼻咽癌患者原发肿瘤SUV值对预后影响,并提出SUVmax最佳临界值为5。本研究对40例中晚期肝癌患者进行长期随访,并分析口服索拉非尼前原发灶及转移灶SUVmax值与预后的关系,发现中晚期肝癌原发肿瘤SUVmax值的最佳临界值为5.5,且低SUVmax组中位总生存期和无肿瘤进展生存期均高于高SUVmax组,因为SUVmax值较高者体内肿瘤细胞具有较高活性状态和恶性程度,所以更有可能出现局部复发和转移,从而导致生存率降低。

表4 影响索拉非尼治疗进展期肝癌OS和PFS的多因素分析
本研究的局限性在于:样本数量较小,参考标准有限,限制对结果的解释;没有前瞻性随机对照研究;虽然本研究揭示FDG摄取和预后之间关系,但SUV不是索拉非尼信号转导通路生物学分子,其作用也不同于c-KIT、VEGF等生物学标志物[9]。
[1] Higashi T,Hatano E,Ikai I,et al.FDG PET as a prognostic predictor in the early post-therapeutic evaluation for unresectable hepatocellular carcinoma[J].Eur J Nucl Med Mol Imaging,2010,37:468-482.
[2] LencioniR,Llovet JR.Modified RECIST(mRECIST)assessment for hepatocellular carcinoma[J].Semin Liver Dis,2010,30:52-60.
[3] Trotti A,Colevas AD,Setser A,et al.CTCAE v3.0:development of a comprehensive grading system for the adverse effects of Cancer treatment[J].Semin Radiat Oncol,2003,13:176-181.
[4] Abou-Alfa GK,Letourneau R,Harker G,et al.Randomized phaseⅢ study of exatecan and gemcitabine compared with gemcitabine alone in untreated advanced pancreatic Cancer[J].J Clin Oncol,2006,24:4441-4447.
[5] Llovet JM,Shan M,Lathia C,et al.Biomarkers predicting outcome of patients with advanced hepatocellular carcinoma(HCC)randomized in the phaseⅢ SHARP trial[C].AASLD 59th Annual Meeting,2008.
[6] 张华琦,于金明,孟 雪,等.18F-氟脱氧葡萄糖PET-CT显像预测Ⅲ期非小细胞肺癌的预后 [J].中华肿瘤杂志,2010,8:603-606.
[7] 徐晓庆,孙新东,于金明,等.FDG PET-CT标准摄取值用于非小细胞肺癌复发的预测价值 [J].中华放射肿瘤学杂志,2008,17:97-100.
[8] Lee SW,Nam SY,Im KC,et al.Prediction of prognosis using standardized uptake value of 2-[18F]fluoro-2-deoxy-d-glucose positron emission tomography for nasopharyngeal carcinomas[J].Radiother Oncol,2008,87:211-216.
[9] Shin DY,Han SW,Oh DY,et al.Prognostic implication of(18)F FDG-PET in patients with extrahepatic metastatic hepatocellular carcinoma undergoing systemic treatment, a retrospective cohort study[J].Cancer Chemother Pharmacol,2011,68:165-175.
