缬沙坦与贝那普利联合应用对糖尿病肾病大鼠nephrin蛋白表达的影响
2013-03-30王秀丽张秀香
王秀丽 张秀香
根据IDF 2007年第3版Diabetes Atlas统计中国糖尿病患者人数已达3 980万,预计2025年将达到5 930万[1],大约1/3的糖尿病患者最终发展为糖尿病肾病(DN)[2],DN引发终末期肾功能衰竭(ESRD)已成为糖尿病患者主要死因[3]。因此对DN进行早期干预非常重要。蛋白尿作为一项独立危险因素,已经成为DN进展的一项重要病理特征,临床研究和动物实验[4-6]表明肾脏足细胞(podocyte)的病变是导致蛋白尿的主要原因,包括足细胞肥大,足突缺失、融合,以及足细胞从基底膜的分离和凋亡,上皮间质的转化等。而肾组织nephrin蛋白的表达水平变化与足细胞的病变密切相关[7-9],本研究在糖尿病大鼠模型基础上,根据缬沙坦与贝那普利不同的药理机制,对DN进行联合干预观察大鼠nephrin表达的变化,同时观察肾组织病理变化,探讨缬沙坦与贝那普利联合应用治疗糖尿病肾病的作用机制及治疗优势。
1 材料与方法
1.1 材料 雄性SD大鼠24只,体重(200±20)g,普通级,由华北煤炭医学院实验动物中心提供;链脲佐菌素(STZ,Sigma公司),盐酸贝那普利片(北京诺华制药有限公司,10 mg/片),缬沙坦胶囊(北京诺华制药有限公司,80 mg/粒)。
1.2 DN模型建立及分组 将24只大鼠适应性喂养1周后随机分为正常对照组(NC组)、糖尿病组(DN组)、缬沙坦与贝那普利联合干预组(CT组),每组8只。DN、CT组以10%水合氯醛3.5 ml/kg腹腔注射麻醉,行左肾摘除术。
1.3 方法 常规消毒,背部切口1~1.5 cm,暴露左肾,剥离肾脏脂肪及肾上腺,结扎左肾门血管,切除左肾,缝合切口。术后1周,按体重给予STZ 55 mg/kg(溶解在0.1 mol/L的枸橼酸钠缓冲液中,pH值4.2)一次性腹腔注射建立DM大鼠模型(血糖>16.7 mmol/L,尿糖 +++ ~ ++++),NC 组予等量枸橼酸钠缓冲液腹腔注射。成模后第2天开始,CT组给予盐酸贝那普利 10 mg·kg-1·d-1和缬沙坦 10 mg·kg-1·d-1混悬液灌胃,NC、DN组给予等量0.9%氯化钠溶液。实验期间所有大鼠均自由饮水及进食,不给予胰岛素及其他任何降糖药物,8周后处死。
1.4 标本收集及指标测定 观察指标:于实验前及实验第8周测定并记录各组大鼠体重。肾脏病理:第8周末麻醉状态下腹主动脉取血处死大鼠后留取部分右肾组织采用10%中性甲醛固定,行免疫组织化学染色,同时将部分肾皮质切成1 mm的立方小块,2.5%戊二醛固定,用来制作超薄切片,并在铅铀双染色后在日产JEM-1230型透射电子显微镜下观察各组大鼠肾脏病理变化;免疫组织化学检测:所有待检测标本以10%甲醛固定,石蜡包埋,制成厚4 μm的切片,采用Elivision法检测肾组织中nephrin的表达。切片脱蜡后加3%H2O2去离子水灭活内源性过氧化物酶活性,液微波修复,3%过氧化氢孵育,滴加兔抗大鼠nephrin抗体(博奥森试剂公司),4℃过夜,依次滴加聚合物增强剂(试剂A)和酶标抗兔聚合物(试剂B),滴加DAB显色剂(以上试剂均属福州迈新生物技术开发公司),镜下控制显色时间,之后苏木精轻度复染细胞核,蓝化、脱水、透明,中性树胶封片。nephrin表达采用半定量分析,即随机选取10个连续不重复的视野(×200),根据肾小球足细胞着色情况计算阳性指数(PI):阳性信号面积×阳性强度,求和、取平均数。
1.5 统计学分析应用SPSS 13.0统计软件,计量资料以表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠nephrin表达阳性指数情况 与NC组(5.9±0.7)比较,DN 组(2.1 ±0.3)nephrin表达明显下调,差异有统计学意义(t=13.40,P<0.01);CT 组(5.0 ±0.7)表达轻度下调,下调程度低于NC组正常值(t=2.53,P<0.05),但明显高于 DN 组(t=10.60,P<0.01)。
2.2 免疫组化情况 NC组大鼠肾小球基底膜上,可见nephrin正常线性分布,nephrin蛋白特异性的表达在肾小球基底膜足突细胞上,肾小管中也有少量表达;DN组大鼠肾小球基底膜nephrin呈颗粒状分布,颜色变浅;CT组肾小球基底膜nephrin呈斑点/线状分布。见图1。
2.3 电镜情况 NC组肾小球结构清晰,基底膜均匀一致,基本无足突细胞融合。DM组肾小球毛细血管基底膜厚薄不均,总体呈明显增厚,结构模糊不清,足突破坏、融合、部分脱落,系膜基质增多、肿胀,系膜区基质增生,可见少量电子致密物质沉积。CT组基底膜基本均匀,无明显增厚,足突细胞宽度变小、足突融合率降低。足突细胞数基本恢复正常,仅有少量足突细胞融合,系膜区基质轻度增生。见图2。
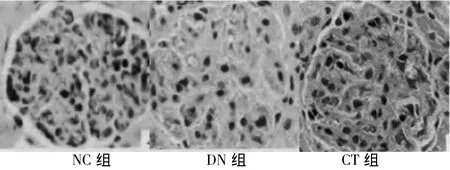
图1 3组大鼠nephrin免疫组织化学染色结果(Elivision×200)
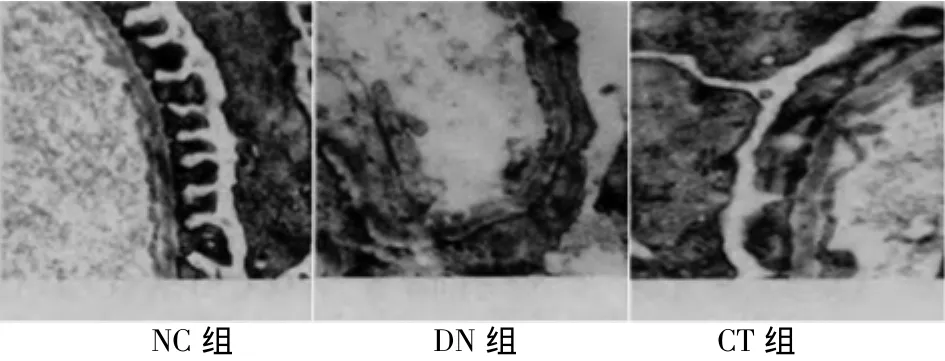
图2 3组大鼠肾足细胞电镜结果(铀铅染色×6 000)
3 讨论
DN的发生主要与肾小球的滤过障碍相关,位于肾小球基底膜(GBM)外侧的足细胞的足突相互交替形成裂孔构成足突间裂孔隔膜,是蛋白质丢失的最后屏障。足细胞nephrin蛋白是一种由1 241个氨基酸组成的跨膜糖蛋白,属于细胞黏附分子中的免疫球蛋白超家族成员,是裂孔隔膜上发现的第一个跨膜蛋白,由足细胞表达、构成裂孔隔膜拉链样结构,与podocin、CD2AP组成复合体,维持裂孔隔膜结构的完整,阻止蛋白滤出。nephrin作为足细胞裂隙膜的关键组成成分,对高度特异性的足细胞功能起到关键作用,能通过介导上皮细胞与基质的相互作用影响GBM的通透性和基质的沉积,影响肾脏滤过膜结构与屏障功能完整性。本研究发现,DN动物模型观察8周后nephrin表达明显下调,形态学显示呈颗粒状减少,同时电镜示基底膜足细胞受损,而CT组经缬沙坦与贝那普利联合干预8周后nephrin表达上调,免疫组化显示nephrin呈斑点/线状恢复过程,电镜示基底膜足细胞大致恢复正常。这一结果与缬沙坦和贝那普利各自作用机制及DN发病过程中肾素-血管紧张素系统(renin.angiotensin system,RAS)过度激活相关[10],作为 RAS重要成员的血管紧张素Ⅱ(angiotensinⅡ,ANGⅡ)、血管紧张素Ⅱ受体(angiotensinⅡ type receptor,ATR)在RAS中最具生物活性,ANGⅡ通过对足细胞裂孔膜上具有重要生理功能的蛋白nephrin表达的调节导致足细胞受损,增加尿蛋白排泄;RT-PCR技术证明分化的人肾脏足细胞上有大量ATR1表达[11];贝那普利为血管紧张素转换酶抑制药,抑制血管紧张素转换酶(ACE),阻止血管紧张素Ⅰ转化成血管紧张素Ⅱ,从而减低由血管紧张素Ⅱ介导的一切作用;缬沙坦是一种特异性的血管紧张素Ⅱ(AT1)受体拮抗剂,它选择性地作用于AT1受体亚型,阻断ANGⅡ与AT1受体的结合。众多研究对两种药物对DN的疗效已有确切报道[12,13],但对两药联合应用对DN的干预报道少见,本研究在RAS对nephrin表达影响致DN发病机制基础上,利用缬沙坦与贝那普利不同的药理特点对DN大鼠模型进行联合干预,成功调节了nephrin的表达,恢复肾小球足细胞功能形态,从而更有效的改善DN症状,延缓DN进展。
1 杨明功,陈明卫.预防为主,规范诊疗,安全达标的糖尿病防治理念.国际内分泌代谢杂志,2009,29:73.
2 Wild S,Roglic G,Green A,et al.Global prevalence of diabetes:estimates for the year 2000 and projections for 2030.Diabetes Care,2004,27:1047-1053.
3 刘新民,潘长玉,张达青,等主编.实用内分泌学.第1版.北京:人民军医出版社,2004.1459-1053.
4 Teiken JM,Audettey JL,Laturnus DI,et al.Podocyte loss in aging OVE26 diabetic mice.Anat Rec(Hoboken),2008,291:114-121.
5 邢燕,叶山东.足细胞与糖尿病肾病关系的若干研究进展.国际老年医学杂志,2001,32:39-43.
6 吕伟,齐栋.足细胞凋亡在糖尿病肾病发病中的作用.医学综述,2010,16,269-271.
7 Sheerin NS.A novel role for nephrin in the maintenance of glomerular structure.J Am Soc Nephrol,2009,20:1661-1663.
8 匡蕾.Nephrin与糖尿病肾病的关系.国际病理科学与临床杂志,2011,31:139-143.
9 White KE,Bilous RW.Diabiopsies Study Group.Structural alterations to the podocyte are related to proteinuria in type 2 diabetic patients.Nephrol Dial Transplant,2004,19:1437.
10 邵德翠,陆利民.肾素-血管紧张素系统在糖尿病肾病肾脏足细胞损伤中的作用.生理科学进展,2011,42:246-250.
11 Liebau MC,Lang D,Bohm J,et al.Functional expression of the renninangiotensin system in human podocytes.Am J Physiol Renal Physiol,2006,290:710-719.
12 Kalaitzidis R,Bakris GL.Effects of angiotensin receptor block-ers on diabetic nephropathy.J Hypertens Suppl,2009,27:15-21.
13 Davi SB,Dei CA,Long DA,et al,Podocyte-specific expression of angiopoietin-2 causes proteinuria and apoptosis of glomerular endothelia.J Am Soc Nephrol,2007,18:2320-2329.
