晚期氧化蛋白产物通过ERK通路促进ECV304细胞基质细胞衍生因子-1α的表达*
2013-03-25史春虹姜一农单路娟高彦国
史春虹,姜一农,单路娟,路 岩,张 英,高彦国
(1.大连医科大学附属一院内分泌科,2.心内科,3.中心实验室,辽宁大连116011;4.大连大学附属新华医院,辽宁 大连116011)
氧化应激在多种疾病的发病机制中起到关键作用,被认为是动脉粥样硬化的基本原因。晚期氧化蛋白产物是一种蛋白质氧化应激标志物,在动脉粥样硬化性心血管疾病患者体内明显升高[1],研究显示[2,3],晚期氧化蛋白产物可促进内皮细胞,脂肪细胞等动脉粥样硬化相关的细胞成分分泌多种炎症因子,新近研究表明[4],晚期氧化蛋白产物还能抑制胆固醇从巨噬细胞外流,促进泡沫细胞形成,参与动脉粥样硬化的进展,但是具体机制仍未有定论。基质细胞衍生因子1α可趋化单核细胞向内皮细胞粘附进而进入血管壁,而这一过程是动脉粥样硬化病灶形成的主要环节,目前国内尚无关于晚期氧化蛋白产物对基质细胞衍生因子1α作用的研究,本文探讨晚期氧化蛋白产物对ECV304细胞分泌基质细胞衍生因子1α的影响以及可能的信号通路,以期对氧化应激促进动脉粥样硬化的发病机制寻找理论依据。
1 材料与方法
1.1 材料
ECV304细胞购自中国科学院上海生物化学与细胞生物学研究所细胞库。RPMI-1640培养基购自Gibco,胎牛血清购自杭州四季青生物技术公司。基质细胞衍生因子 1α(stromal cell-derived factor-1α,SDF-1α)抗体购自博士德公司,Takara RNA PCR Kit(AMV)Ver 3.0购自大连宝生物公司,p-ERK1/2抗体购自 Santa Cruz,U0126购自 Sigma,SDF-lα定量酶联免疫试剂盒购自上海森雄公司。
1.2 细胞培养
细胞常规培养于37℃,5%CO2,湿润的恒温孵箱中。培养液为含有10%胎牛血清的RPMI1640培养基。当细胞覆盖率达70%~90%时,以0.25%胰蛋白酶-0.03%EDTA溶液消化,按1∶5传代。取第3~5代处于对数生长期的细胞用于实验。实验前细胞均经过12 h无血清培养,实验过程中设复孔,常规以台盼蓝染色法检测细胞死亡率,各组细胞死亡率均≤5%。
1.3 AOPP-BSA的制备及浓度测定
200mg/ml牛血清白蛋白(bovine serum albumin,BSA)与 0.2 mol/L NaOCl各取等量混合,室温孵育30 min,4℃以 0.01 mol/L PBS(pH 7.4)透析 24 h,0.22μm硝酸纤维素膜过滤消毒,-70℃冻存。以经同样处理但未加NaOCl的BSA作对照。AOPP的测定应用分光光度法,酸性条件340 nm测AOPP-BSA浓度,以氯胺-T为标准品,实际测定的为AOPP对氯胺-T的相对浓度。
1.4 RT-PCR法检测 ECV304细胞 SDF-1αmRNA的表达
将ECV304细胞接种于6孔板,待长成单层后移去普通 RPMI 1640培养液,加入含有200μmol/L BSA,0,50,100,200μmol/L AOPP-BSA的 RPMI 1640培养液孵育6 h后收集细胞。加入Trizol试剂提取细胞总RNA。应用 Takara RNA PCR Kit(AMV)Ver 3.0试剂盒,以 GAPDH为内对照,SDF-1α扩增产物全长495 bp,上游引物5’-AAGCCCGTCAGCCTG AGC TAC-3’,下游引物 5’-AGT TAT CTA CAT CTT GAA CCTCT-3’GAPDH扩增产物全长697 bp,上游引物 5’-TCA CCA TCT TCC AGG AGC GAG-3’,下游引物 5’-TGT CGC TGT TGA AGT CAG AG-3’。反应条件:94℃变性 30 s,58℃退火 45 s,72℃延伸 1min,共28个循环。PCR产物进行琼脂糖凝胶电泳,以凝胶成像系统采集电泳结果,并应用附带软件分析目标条带与内参条带吸光度值之比,进行半定量PCR。
1.5 Western blot法检测 ECV304细胞 SDF-1α及p-ERK1/2蛋白水平
将ECV304细胞接种于6孔板,待长成单层后移去普通 RPMI 1640培养液,加入含有200μmol/L BSA,0,50,100,200μmol/L AOPP-BSA的 RPMI 1640培养液孵育 24 h,或者 15 min,或者含 200 μmol/L AOPP-BSA的 RPMI 1640培养液孵育 0、15、30、60、120min后收集细胞,去除培养液,冰 PBS漂洗细胞 3次,加入 100μl细胞裂解缓冲液,4℃12 000 r/min离心10min,取上清。采用BCA蛋白质定量试剂盒测定总蛋白浓度。蛋白上样量为每孔32μg,以10%分离胶100 V恒压电泳,4℃200mA电转移1.5 h至硝酸纤维素膜,脱脂奶粉封闭过夜,以1∶1 000封闭液稀释一抗,内参一抗的稀释终浓度为1∶800,室温下孵育 2 h,以 1∶5 000封闭液稀释辣根过氧化物酶标记的二抗,室温下孵育1.5 h,化学发光法显像,UVP凝胶图像处理系统Labworks4.6软件分析目的条带的灰度值。
1.6 酶联免疫吸附试验(ELISA)检测ECV304细胞上清液中SDF-1α水平
将ECV304细胞接种于12孔板,待长成单层后移去普通 RPMI 1640培养液,分别与含0.1,1,10 μmol/LU0126的培养基孵育1 h,之后吸出上述培养基,以无血清培养基洗涤细胞1次,再加入含200 μmol/L AOPP-BSA的 RPMI1640培养液孵育24 h,收集上清液。按照试剂盒说明书操作,在492 nm处测吸光度值。以统计软件SPSS 13.0拟合标准曲线,计算各样本浓度。
1.7 统计学分析
所有数据以均数 ±标准差(±s)表示,采用SPSS 13.0软件进行数据分析。组间均数比较采用单因素方差分析(ANOVA)。
2 结果
2.1 AOPP-BSA对 ECV304细胞 SDF-1αmRNA表达的影响
与对照组比较,BSA组SDF-1αmRNA表达量升高,但无统计学意义,不同浓度(50μmol/L,100 μmol/L,200μmol/L)的 AOPP-BSA均显著升高 SDF-1αmRNA的表达(分别为P<0.05,P<0.01,P<0.01)。与 50μmol/L AOPP-BSA组比较,100μmol/L及 200μmol/L AOPP-BSA组 SDF-1αmRNA的表达量升高(P均<0.01)。200μmol/L AOPP-BSA组比 100 μmol/L AOPP-BSA组 SDF-1αmRNA的表达量升高(P<0.05,图 1,表 1)。
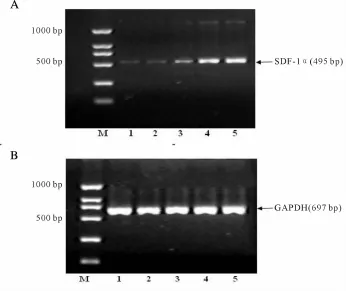
Fig.1 Effects of AOPP on SDF-1αmRNA expression in ECV304 cells by dose dependentmanner
Tab.1 Effects of AOPP on SDF-1αmRNA and protein expression in ECV304 cells(±s,n=3)

Tab.1 Effects of AOPP on SDF-1αmRNA and protein expression in ECV304 cells(±s,n=3)
SDF-1α:Stromal cell-derived factor-1α;AOPP:Advanced oxidation protein products;BSA:Bovine serum albumin*P<0.05,**P<0.01 vs control; #P<0.05,##P<0.01 vs 50μmol/L AOPP-BSA;△P<0.05 vs 100μmol/L AOPP-BSA
Group SDF-1αmRNA/GAPDHmRNA SDF-1αproten/β-actin protein Control 0.035±0.010 0.214±0.040 200μmol/L BSA 0.043±0.009 0.197±0.052 50μmol/L AOPP-BSA 0.116±0.024* 0.604±0.088*100μmol/L AOPP-BSA 0.259±0.086**## 0.996±0.083**#200μmol/L AOPP-BSA 0.330±0.058**##△ 1.108±0.124**#
2.2 AOPP-BSA对ECV304细胞表达SDF-1α蛋白水平的影响
与对照组比较,BSA组 SDF-1α蛋白表达量升高,但无统计学意义,不同浓度(50μmol/L,100 μmol/L,200μmol/L)的 AOPP-BSA显著升高 SDF-1α蛋白的表达(分别为P<0.05,P<0.01,P<0.01)。与 50μmol/L AOPP-BSA组比较,100μmol/L及 200 μmol/LAOPP-BSA组 SDF-1α蛋白的表达量升高(P均 <0.05)。200μmol/L AOPP-BSA组比 100μmol/L AOPP-BSA组SDF-1αmRNA的表达量升高,但差异无统计学意义(图2,表1)。
2.3 AOPP-BSA对 ECV304细胞 p-ERK1/2蛋白表达的影响
与对照组比较,BSA组ECV304细胞ERK1/2蛋白磷酸化水平下降,但无统计学意义,不同浓度(50 μmol/L,100μmol/L,200μmol/L)的 AOPP-BSA显著升高ERK1/2蛋白磷酸化水平(分别为P<0.05,P<0.01,P<0.01)。与 50μmol/L AOPP-BSA组比较,100μmol/L及 200μmol/LAOPP-BSA组 ERK1/2蛋白磷酸化水平升高(P均 <0.01)。200μmol/L AOPP-BSA组比 100μmol/L AOPP-BSA组 ERK1/2蛋白磷酸化水平升高(P<0.01,图 3,表 2)。
200μmol/L AOPP-BSA刺激 15 min后 ERK1/2磷酸化蛋白量与对照组相比显著升高(P<0.01),之后逐渐下降,120 min ERK1/2磷酸化蛋白量与对照组相比仍处于较高水平(P<0.05)。AOPP-BSA以时间依赖的方式调节ERK1/2蛋白磷酸化活性(图 3,表 3)。

Fig.2 Effects of AOPP on SDF-1αprotein expression in ECV304 cells by dose dependentmanner

Fig.3 Effects of AOPP on pERK1/2 protein expression in ECV304 cells by dose and time dependentmanner
Tab.2 Effects of AOPP on pERK1/2 protein expression in ECV304 cells by dose-dependentmanner(±s,n=3)

Tab.2 Effects of AOPP on pERK1/2 protein expression in ECV304 cells by dose-dependentmanner(±s,n=3)
AOPP:Advanced oxidation protein products;BSA:Bovine serum albumin*P<0.05,**P<0.01 vs control;##P<0.01 vs 50μmol/L AOPP-BSA;△△P<0.01 vs 100μmol/L AOPP-BSA
Group pERK1/2 protein/β-actin protein Control 0.216±0.035 200μmol/L BSA 0.167±0.041 50μmol/L AOPP-BSA 0.308±0.076*100μmol/L AOPP-BSA 0.490±0.083**##200μmol/L AOPP-BSA 0.798±0.095**##△△
Tab.3 Effects of AOPP on pERK1/2 protein expression in ECV304 cells by time-dependentmanner(±s,n=3)

Tab.3 Effects of AOPP on pERK1/2 protein expression in ECV304 cells by time-dependentmanner(±s,n=3)
AOPP:Advanced oxidation protein products*P<0.05,**P<0.01 vs control; ##P<0.01 vs 15 min;△P<0.05,△△P<0.01 vs 30min
Group pERK1/2 protein/β-actin protein 0min(Control) 0.086±0.009 15min 0.801±0.096**30min 0.310±0.082**##60min 0.235±0.037**##△120min 0.152±0.024*##△△
2.4 ERK1/2选择性抑制剂U0126抑制AOPP-BSA对ECV304细胞SDF-1α蛋白表达的促进作用
与对照组比较,AOPP-BSA可显著升高ECV304细胞 SDF-1α蛋白的表达(P<0.01),与 AOPP-BSA组相比较,0.1μmol/LU0126使 AOPP-BSA作用下的SDF-1α蛋白表达量减少,但是差异无统计学意义。1μmol/LU0126使 SDF-1α蛋白表达量进一步减少(P<0.05),10μmol/L U0126显著降低 SDF-1α蛋白的表达(P<0.01,表 4)。
Tab.4 Effects of U0126 of different concentrations on SDF-1αexpression in ECV304 cells after AOPP-BSA stimulating(±s,n=3)
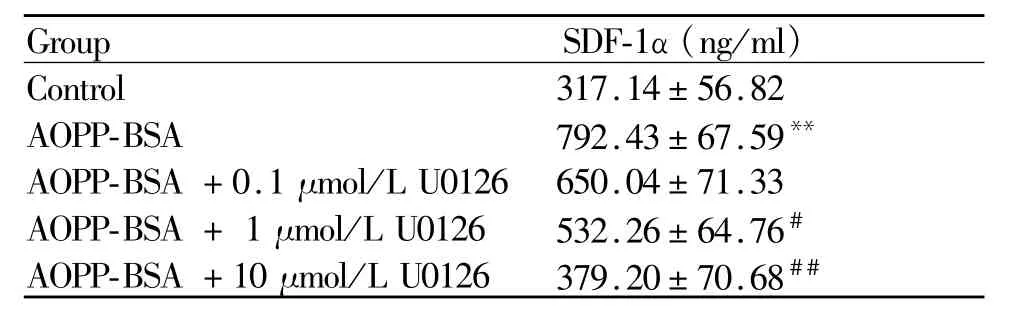
Tab.4 Effects of U0126 of different concentrations on SDF-1αexpression in ECV304 cells after AOPP-BSA stimulating(±s,n=3)
ECV304 cellswere pretreated with U0126 of different concentrations for 1 hour,then were treated with 200μmol/L AOPP-BSA for 24 hours,to detect the levels of SDF-1α in supernatant by ELISA.AOPP:Advanced oxidation protein products;BSA:Bovine serum albumin**P<0.01 vs control; #P<0.05,##P<0.01 vs AOPPBSA
Group SDF-1α(ng/ml )Control 317.14±56.82 AOPP-BSA 792.43±67.59**AOPP-BSA+0.1μmol/LU0126 650.04±71.33 AOPP-BSA+1μmol/LU0126 532.26±64.76#AOPP-BSA+10μmol/LU0126 379.20±70.68##
3 讨论
晚期氧化蛋白产物(advanced oxidation protein products,AOPP)由 Witko-sarsat于 1996年首次在尿毒症患者血浆中发现,是活化的中性粒细胞髓过氧化物酶生成的次氯酸攻击蛋白质氨基酸残基形成的各种氧化蛋白产物的总称,在体外用次氯酸或者次氯酸盐氧化人血清白蛋白可得到与体内类似的产物[5]。AOPP既是氧化应激标志物,还作为促炎症因子在多种病理生理过程中起到重要作用,Qiu GZ等[3]证实AOPP修饰蛋白可以促进脂肪细胞肿瘤坏死因子α以及白介素6 mRNA和蛋白的表达。体内研究发现静脉注射AOPP增加了糖尿病大鼠肾脏巨噬细胞的浸润,上调单核细胞趋化蛋白(monocyte chemoattractant protein-1,MCP-1)在肾脏的表达[6]。SDF-1α是一种趋化因子,可趋化T淋巴细胞、单核细胞进入血管壁[7],研究证实,SDF-1α在人动脉粥样硬化斑块中的内皮细胞和巨噬细胞中高表达[8],与MCP-1和巨噬细胞炎性蛋白1(macrophage inflammatory protein-1,MIP-1)比较,其对T细胞的趋化活性高10倍。本研究探讨AOPP-BSA对ECV304细胞SDF-1αmRNA和蛋白表达的影响,结果显示AOPPBSA可显著增加ECV304细胞SDF-1αmRNA及蛋白的表达,呈浓度依赖性。已知SDF-1α是一种高效的细胞趋化因子,而趋化因子在炎症反应中的免疫细胞迁移和定位过程中起到重要作用,所以本研究结果再次证实AOPP具有促炎症作用。
多个试验表明AOPP在动脉粥样硬化性心血管疾病中起重要作用[2,4,9]。本实验结果显示 AOPPBSA呈浓度依赖性地增强趋化因子SDF-1αmRNA和蛋白在ECV304细胞的表达,50μmol/l AOPP-BSA与ECV304细胞作用后,SDF-1αmRNA和蛋白的表达与对照组比较既有显著升高,随着AOPP浓度增加,SDF-1αmRNA和蛋白的表达进行性升高。众所周知,动脉粥样硬化以慢性炎症为主要特征,结果说明AOPP与动脉粥样硬化的发生发展有密切关系。本研究证实AOPP促进ECV304细胞SDF-1α的表达,可能是其参与动脉粥样硬化的途径之一。
细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通路(Ras→Raf→ MEK1/2→ ERK1/2)是经典的丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号转导途径,普遍认为ERK1/2通路活化介导细胞的增殖效应。研究发现ERK通路还参与应激刺激、细菌产物、炎症介质等引起的细胞反应,表明ERK1/2通路的激活与炎症反应也有着密切关系[10]。本研究也证实具有促炎症作用的氧化蛋白产物AOPP-BSA能够激活ERK1/2通路,并且表现出浓度和时间依赖性,随着AOPPBSA浓度的增加,磷酸化 ERK1/2蛋白量增加,AOPP-BSA刺激15 min后ERK1/2磷酸化水平就显著升高,之后逐渐下降,120 min时仍明显高于对照组。另外,AOPP-BSA刺激后内皮细胞表达 SDF-1α增加,这一作用可被ERK1/2特异性阻断剂 U0126抑制,0.1μmol/L,1μmol/L,10μmol/L的抑制剂对AOPP-BSA处理后SDF-1α表达量的抑制逐渐增强,上述实验结果表明AOPP-BSA促进内皮细胞SDF-1α表达的信号通过细胞内ERK1/2通路转导。
综上,AOPP促进 ECV304细胞 SDF-1α的表达,具有促炎症作用,可能是氧化应激促进动脉粥样硬化发病机制的途径之一。这一作用通过ERK通路介导,针对ERK为靶点的阻断治疗是否能够减缓动脉粥样硬化的进展尚需进一步研究。
[1] Skvarilova M,Bulava A,Stejskal D,et al.Increased level of advanced oxidation protein products(AOPP)as amarker of oxidative stress in patients with acute coronary syndrome[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2005,149(1):83-87.
[2] Guo Z J,Niu H X,Hou F F,et al.Advanced oxidation protein products activate vascular endothelial cellsviaa RAGE-mediated signaling pathway[J].Antioxid Redox Signal,2008,10(10):1699-1712.
[3] Zhou Q G,Zhou M,Lou A J,et al.Advanced oxidation protein products induce inflammatory response and insulin resistance in cultured adipocytesviainduction of endoplasmic reticulum stress[J].Cell physiol biochem,2010,26(4-5):775-786.
[4] Mo ZC,Xiao J,Liu H X,etal.AOPPs inhibits cholesterol efflux by down-regulating ABCA1 expression in a JAK/STAT signaling pathway-dependent manner[J].J Atheroscler Thromb,2011,18(9):796-807.
[5] Witko-Sarsat V,FriedlanderM,Capeillere-Blandin C,etal.Advanced oxidation protein products as a novelmarker of oxidative stress in uremia[J].Kidney Int,1996,49(5):1304-1313.
[6] Shi X Y,Hou F F,Niu H X,et al.Advanced oxidation protein products promote inflammation in diabetic kidney through activation of renal nicotinamide adenine dinucleotide phosphate oxidase[J].Endocrin,2008,149(4):1829-1839.
[7] Zeiffer U,Schober A,Lietz M,et al.Neointimal smooth muscle cells display a proinflammatory phenotype resulting in increased leukocyte recruitment mediated by P-selectin and chemokines[J].Circ Res,2004,94(6):776-784.
[8] WeiD,Wand G,Tang C,et al.Upregulation of SDF-1 is associated with atherosclerosis lesions induced by LDL concentration polarization[J].Ann Biomed Eng,2012,40(5):1018-1027.
[9] Guo Z J,Hou F F,Liu SX,et al.Picrorhiza scrophulariiflora improvesaccelerated atherosclerosis through inhibition of redox-sensitive inflammation[J].Int J Cardiol,2009,136(3):315-324.
[10] Chu X,Ci X,He J,et al.A novel anti-inflammatory role for ginkgolide B in asthmaviainhibition of the ERK/MAPK signaling pathway[J].Molecules,2011,16(9):7634-7648.
