单管一步甲基化可变位点分析技术
2013-03-11岳阳阳赵贵森张倩鲁涤翟仙敦莫耀南
岳阳阳,赵贵森,张倩,鲁涤,翟仙敦,莫耀南
(1.河南科技大学法医学院,河南洛阳 471003;2.中国政法大学证据科学教育部重点实验室,北京 100088)
单管一步甲基化可变位点分析技术
岳阳阳1,2,赵贵森1,2,张倩1,鲁涤2,翟仙敦1,莫耀南1
(1.河南科技大学法医学院,河南洛阳 471003;2.中国政法大学证据科学教育部重点实验室,北京 100088)
目的建立单管一步甲基化可变位点(methylation variable position,MVP)分析技术——单管消化后PCR链融解曲线分析(post-digestion PCR-melting curve analysis,PDP-MCA)。方法以文献报道的差异甲基化区(differentially methylated region,DMR)为模型,在MVP两侧设计一组解链温度各不相同的引物。应用FastDigest甲基化敏感性限制酶(methylation-sensitive restriction enzyme,MSRE),在同一反应管内顺次进行DNA的酶切、复合扩增和MCA检测,生成MCA图谱。同时用该方法和传统的MSRE-PCR MCA技术检测相同样品(外周静脉血、精液、阴道液各5份),比较两种方法检测结果,验证其可行性,并分析比较不同样品的MCA/HRM图谱。结果解链温度相差2℃以上的片段,MCA峰分离良好,复合扩增后可以用MCA技术检测。应用单管PDP-MCA技术,可以集酶切、扩增和检测三步于一管,在2h内得到与传统方法一致的特异性图谱和数据,并实现样品的快速分类鉴别。结论单管PDP-MCA技术可以实现多个MVP的单管、闭管检测,具有简便、快速、易于自动化等优点,可用于样品DNA甲基化差异的检测。
法医遗传学;DNA甲基化;链融解曲线;甲基化敏感性限制酶;甲基化可变位点
DNA甲基化是DNA的一种新型分子标记,与SNP等反映个体间差异的遗传标记不同,主要表现为个体内细胞间的差异。甲基化可变位点(methylation variable position,MVP)被视为表观遗传学水平上的“SNP”[1],即DNA链上表现出不同甲基化状态的CpG位点,这种差异存在于正常的细胞类型之间以及细胞的不同发育阶段。基因组内广泛存在的MVP为解决法医学问题提供了一种全新的途径,国内外学者正在探索利用DNA甲基化标记解决同卵双生子鉴别、年龄推断、斑痕类型鉴别、人造DNA鉴伪等问题[2-8]。细胞类型的差异导致了不同组织间的特异性甲基化模式即组织特异性差异甲基化区(differentially methylated region,DMR),因而通过分析检材的甲基化特征,就可推断其组织细胞类型。
在筛选高鉴别能力标记的同时,还需建立适合法医学检材特点、足够便捷、能与当代DNA分析技术相匹配的检测方法。常用的应用性MVP分析技术大多操作繁琐、耗时费力,难以达到自动化、标准化的要求[9-10]。本研究旨在把常用的FastDigest内切酶[11]、链融解曲线分析(melting curve analysis,MCA)[12-13]与传统的甲基化敏感性限制酶PCR(methylation-sensitive restriction enzyme PCR,MSRE-PCR)技术[14-15]结合起来,建立一种能在单管内连续进行酶切、扩增和MCA检测的简便方法——单管消化后PCR链融解曲线分析(post-digestion PCR-melting curve analysis,PDPMCA)技术,以期实现多个MVP的单管、闭管、复合、快速检测,为DNA甲基化标记在法医学中的应用寻求合适的方法。
1 材料与方法
1.1 仪器与试剂
Rotor-Gene Q 5Plex HRM荧光定量PCR仪(德国QIAGEN公司),FLA6000微量紫外可见分光光度计(杭州晶飞科技有限公司),TGL-16B高速台式离心机(上海安亭科学仪器厂)。
限制酶FastDigest®HhaⅠ、FastDigest®HpaⅡ、普通HhaⅠ、普通HpaⅡ和热启动Taq DNA聚合酶(加拿大Fermentas公司),20×Eva Green荧光染料(美国Biotium公司),甜菜碱、二甲基亚砜(美国Sigma公司)。
1.2 样品
按知情同意原则收集健康成人外周静脉血、精液、阴道液各5份。常规的蛋白酶K消化、酚-氯仿法提取基因组DNA,紫外分光光度法定量,-20℃保存备用。
1.3 引物
根据文献[16-19]报道的DMR为模型,从Genebank中获取4个具有组织特异性的差异甲基化序列MAGE-1、14-3-3σ、MCJ、TIMP,用pDRAW32软件搜索其中可为限制酶FastDigest®HhaⅠ和HpaⅡ识别的MVP数。运用Primer Premier 5.0软件设计引物,使扩增片段内至少有1个MVP,4个片段的解链温度(melting temperature,Tm)梯度增加。另外设置一个扩增参照片段AC,不含HhaⅠ和HpaⅡ识别的MVP,且Tm低于上述4个片段(表1)。引物由上海捷瑞生物工程有限公司合成。
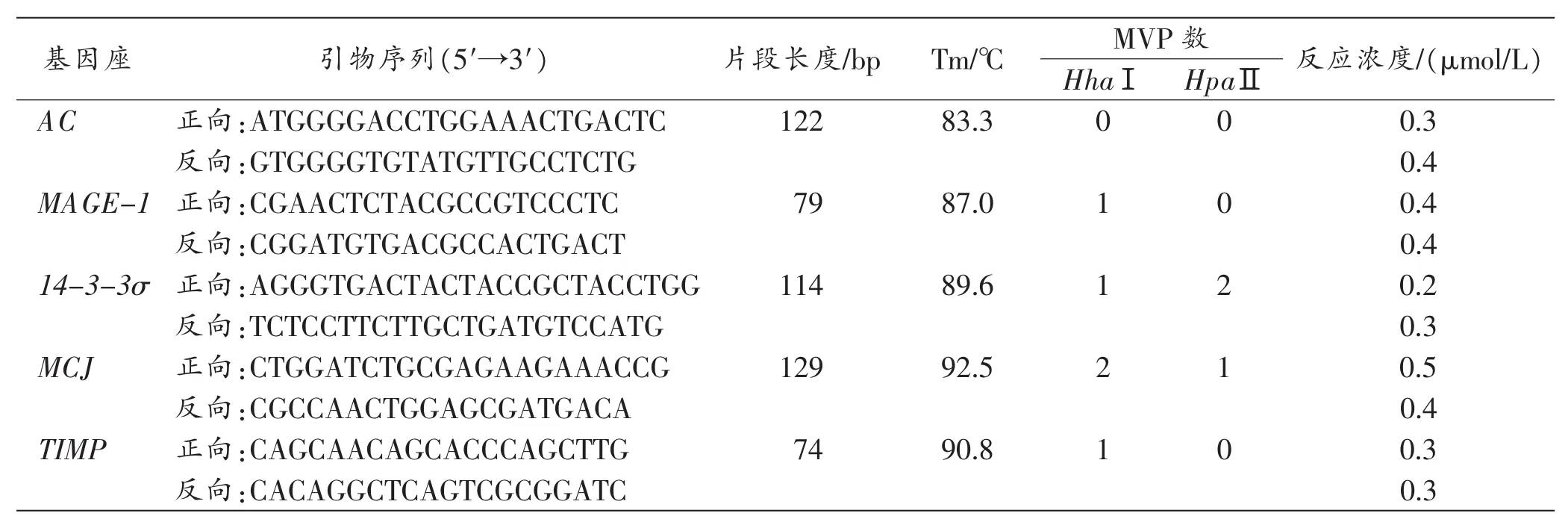
表1 扩增片段与引物信息
1.4 多重PCR-MCA确定引物组合
常规PCR法确定各基因座最佳的引物浓度、反应体系和循环参数。在此基础上进行组合、优化,形成两套复合扩增体系(A组合为AC、MAGE-1、14-3-3σ 和MCJ,B组合为AC、MAGE-1、MCJ和TIMP),分别检验其复合扩增后直接进行多重MCA检测的可行性。
反应体系20μL:含热启动Taq DNA聚合酶1.5U,引物组合A或B(浓度见表1),2×通用反应液10 μL(含缓冲离子、MgCl2、dNTPs、EvaGreen、甜菜碱和二甲基亚砜等),20 ng外周静脉血基因组DNA,加纯水至20 μL。在Rotor-Gene Q 5Plex HRM荧光定量PCR仪上顺次进行扩增和MCA分析。
循环参数:94℃8min;94℃30s,59℃25s,72℃30s,35个循环;72℃5min。MCA分析:从70℃开始,逐步升高温度至94℃,每步上升0.2℃,Green/HRM通道采集荧光信号。
保持上述条件不变,分别以源于其他个体的DNA和各种浓度的DNA(0.5~80 ng)为模板重复实验,检验方法的稳定性、灵敏度。
1.5 单管PDP-MCA法
反应体系20μL:含FastDigest®HhaⅠ和HpaⅡ各1 μL,引物组合(选择1.4项中适用于单管PDPMCA技术的引物组合),待测样品基因组DNA 20ng,Taq DNA聚合酶和通用反应液同1.4项,加纯水至20μL。在Rotor-Gene Q 5Plex HRM荧光定量PCR仪上顺次进行酶切、扩增和MCA分析。
循环参数:37℃保温10 min,后续步骤和重复管设置同1.4项。每批反应设置假酶切对照管(不加限制酶),以外周静脉血基因组DNA为模板,用50%甘油2μL代替限制酶,其余条件与酶切管完全相同。
保持上述条件不变,以各浓度外周静脉血基因组DNA(0.5~80ng)为模板重复实验,测试方法的灵敏度。
1.6 传统MSRE-PCR MCA法
按照产品说明书,基因组DNA用普通HhaⅠ、普通HpaⅡ酶切8 h,取相当于20 ng基因组DNA的酶切物进行复合扩增和MCA分析。除不含限制酶、略去37℃保温步骤外,PCR体系和循环参数同1.5项。
1.7 数据分析
Rotor-Gene 2.0.2.4软件分析数据生成MCA图谱,用Origin8的Peak Analyzer模块进行基线扣除和峰积分计算,Statistics模块进行峰参数的统计学描述和配对t检验。比较两种方法所得基因片段的峰面积占MCA曲线下总面积的百分比。
2 结果
2.1 多重PCR-MCA图谱
以外周静脉血基因组DNA为模板,经调整引物浓度,优化反应体系和循环参数,表1中的基因座均可以实现特异扩增(图1A、1B),并且可以分成A、B两个组合进行复合扩增(图1C、1D)。
A组合4个片段(AC、MAGE-1、14-3-3σ和MCJ)分管同步扩增时,MCA图谱均呈单一的主峰,且片段之间的MCA峰主体上互不重叠(图1A);单管复合扩增时,MCA图谱呈4个分离良好的峰,与4个片段相对应(图1C)。以源于不同个体的基因组DNA重复测定,只要模板量在1~40 ng,各片段的峰位置偏离在0.2℃以内,小于相邻峰间距的1/10。
B组合(AC、MAGE-1、MCJ和TIMP)中MCJ和TIMP的MCA峰相互交叠(图1B);单管复合扩增时,与二者相应的峰呈双头宽峰或肩峰状,且TIMP的MCA峰较分管同步扩增时右移0.5℃以上(图1D)。故B组合不适用于单管PDP-MCA技术。
2.2 单管PDP-MCA法的建立

图1 Tm差异片段的多重PCR-MCA图谱
以2.1项多重PCR-MCA检测为基础,在反应体系内引入FastDigest®HhaⅠ、FastDigest®HpaⅡ、引物A组合、启动扩增前增加一个37℃保温10min的酶切步骤,即为单管PDP-MCA法。用该技术检测并生成精液、血液和阴道液各有其特异的MCA图谱。与未加限制酶的假酶切对照管相比较,组成样品MCA图谱的各MVP峰的位置不变,但峰高、峰面积呈组织特异性变化(图2)。这种变化与传统MSRE-PCR MCA法得到的结果一致(表2),精液的MAGE-1和14-3-3σ甲基化程度低于血液和阴道液,而阴道液的MCJ甲基化程度高于精液和血液,血液、精液样品的MCJ峰高均小于0.1(图2)。除14-3-3σ基因座外,各样品用两种方法的检测结果比较,差异均无统计学意义(P>0.05,表2)。当前实验条件下,1 ng的基因组DNA可获得稳定的MCA图谱。加入的基因组DNA 在1~40ng,不影响图谱的特异性。
在可进行高分辨率融解曲线(high resolution melting,HRM)的仪器上,用HRM模式进行MCA分析,除生成MCA图谱外,得到的数据还可以用仪器配备的HRM软件处理,得到标准和差异HRM图谱,便于比较样品间的差异(图3)。
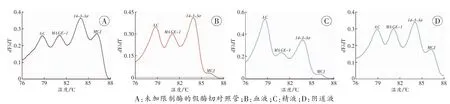
图2 不同组织来源样品的单管PDP-MCA图谱
表2 单管PDP-MCA法与传统MSRE-PCR MCA法结果比较(n=5,±s,%)

表2 单管PDP-MCA法与传统MSRE-PCR MCA法结果比较(n=5,±s,%)
注:表中数值为各基因片段的峰面积占MCA曲线下总面积的百分数
MCAPDP-MCAMSRE-PCR MCA对照15.67±2.3014.79±1.1018.40±1.4519.90±0.6044.56±1.6944.53±0.6018.51±1.4317.14±0.99血液25.72±1.4524.14±1.7526.07±0.6126.57±4.5943.21±2.4943.12±2.510.67±0.401.01±0.55精液42.59±1.6941.52±2.3417.11±1.6818.19±1.8334.65±3.6631.20±1.311.44±0.623.55±0.73阴道液19.23±1.8221.60±0.9326.57±1.6227.65±2.8243.41±3.1638.82±0.625.44±1.476.32±0.78样品ACMAGE-114-3-3σMCJ PDP-MCAMSRE-PCR MCAPDP-MCAMSRE-PCR MCAPDP-MCAMSRE-PCR
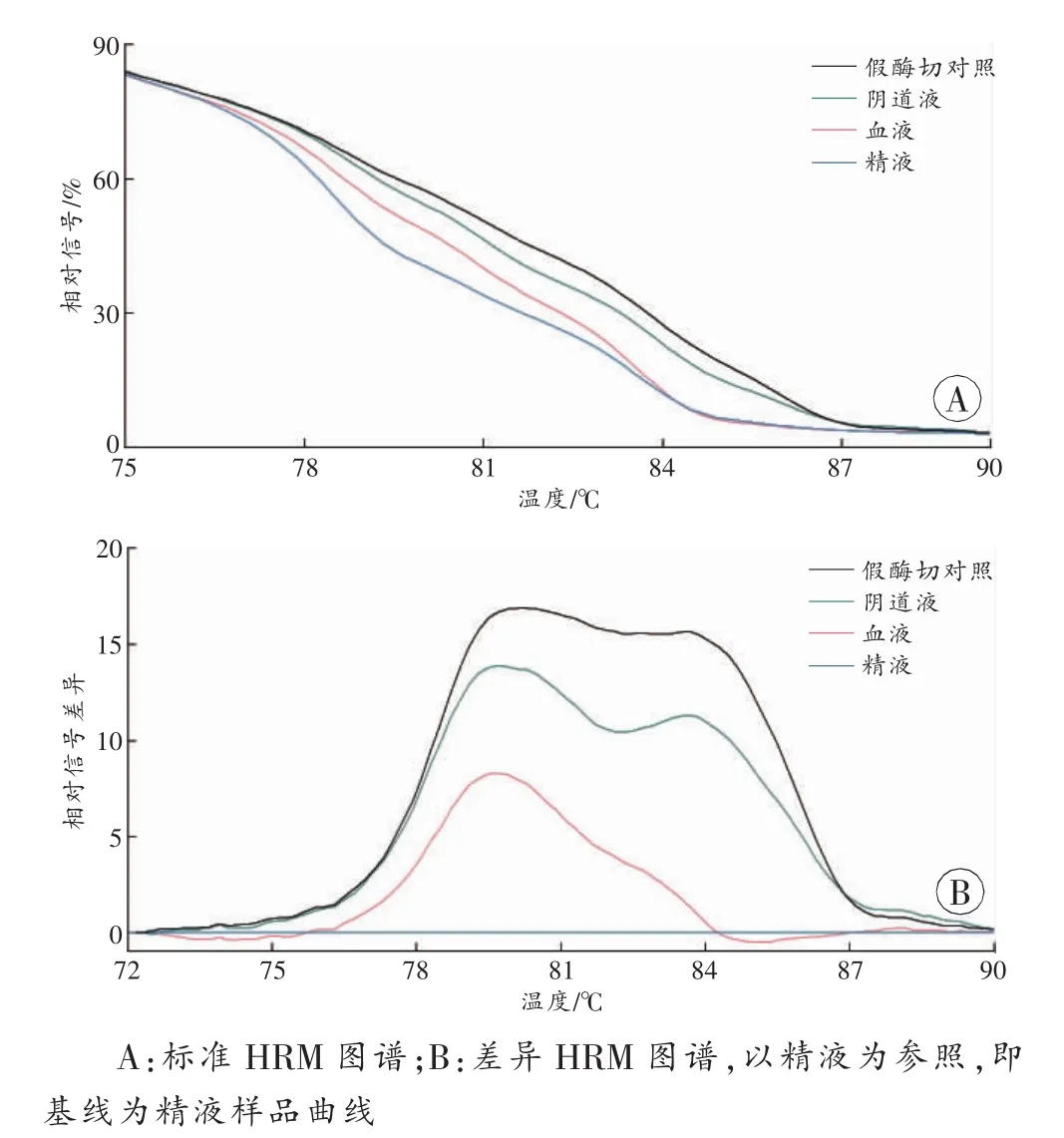
图3 样品特异性的HRM图谱
3 讨论
3.1 原理
FastDigest内切酶是一种新型的限制酶,具有高效、快速、模板和体系适应性强等优点,在PCR缓冲体系内也可以实现靶位点的有效切割[11]。直接把这种限制酶加入PCR体系,只需在常规扩增前37℃保温10min,即可替代传统的酶切步骤。实现酶切和扩增两个反应在同一体系、同一管内的连续进行。
MCA是一种根据融链曲线的特征来鉴别DNA片段的电泳替代技术。与根据长度差异性来分离检测的电泳方法不同,MCA是一种基于解链温度差异的均相闭管分析技术[13]。PCR体系内如含有EvaGreen等双链DNA荧光染料,在定量PCR仪上完成扩增后,只需在梯度升温的同时采集荧光信号,就可得到特异性的MCA图谱,即时提供靶片段的有无、产量及纯度等类似电泳检测的信息。复合扩增时,只要多个片段之间的解链温度互不重叠,可以同时获得各片段的信息并进行相互比较[12]。
同时采用FastDigest内切酶和复合MCA技术,就可以把传统MSRE-PCR MCA的酶切、扩增和产物分析3个步骤集成于一个反应管内,实现多个MVP的单步闭管快速检测。
3.2 可行性
为了验证上述原理或设计思路的可行性,本研究以文献[16-19]报道的DMR为模型,成功建立了单管PDPMCA法。
从DMR中筛选含有MVP的可扩增片段,是建立该技术的前提。本研究运用两种最常见的MSRE酶(HhaⅠ和HpaⅡ)设计并合成4个片段的引物(表1)进行实验验证,成功实现了运用引物A组合4个片段的单管PDP-MCA检测。综合上述序列分析和实验验证的结果,应用MSRE-PCR MCA法来进行MVP分析是可行的。同时,考虑到还有多种可用的MSRE酶及引物改进的可能性,多数DMR都可以找到符合设计要求的MVP,即该技术具有一定的实际应用前景。
FastDigest内切酶的应用是本研究的另一重要改进。为了验证其在PCR体系内的切割效果,本研究比较了单管PDP-MCA法和传统MSRE-PCR MCA法对同一组基因组样品的检测结果。两种方法的MCA图谱及峰积分数据(表2)均有良好的一致性,所反映的组织细胞甲基化特征也与文献[16-19]报道相同。
只有在14-3-3σ基因座上,两种方法的差异有统计学意义(P<0.05),可能系阴道液(样本收集困难,检材质量偏低)DNA样品的纯度较低所致,有待进一步分析确认。改进后的方法总体上可以达到传统的检测效果,实现MVP的简便快速分析,用于组织细胞之间甲基化差异的比较(图2~3)。
应用本研究建立的单管PDP-MCA技术进行检测,血液、精液和阴道液各有其特征性的图谱(图2~3),说明本技术具有解决法医学斑痕类型鉴别等实际问题的潜力。本课题组正在对更多的斑痕特异性MVP进行优选组合,以期建立一种符合法医学应用要求的斑痕单管PDP-MCA鉴别技术。
3.3 优势与问题
与传统的MSRE-PCR MCA法及其他基于DNA修饰的甲基化分析方法相比较,单管PDP-MCA技术的突出优势是简便快速。该技术只需配制一次反应体系即可实现DNA样品的甲基化分析,不需反复移液、换管及电泳操作,结束后可直接得到多种数字化的图谱和相应的数据。在大幅降低操作量的同时,也降低了出错和污染的机会,并使整个检测过程有可能实现自动化和标准化。同时,检测时间大为缩短。
当然,要作为一种实用的方法,单管PDP-MCA法在诸多方面尚需继续完善优化。首先,受可利用温度范围的限制,即使采用分辨率高的HRM技术,单色荧光MCA检测可以复合的片段数目理论上很难超过10个。有必要继续探讨利用各种荧光探针或探针染料组合的多色MCA技术,以增加单次检测的信息量[20]。其次,单管PDP-MCA的反应体系要兼顾酶切、扩增和荧光MCA检测3个方面的要求,应继续探讨优化各缓冲组分及反应组分的类型和浓度,引入对酶切效果进行控制的片段,以确立真正高效、灵敏、可靠的实用性方案。
需要指出的是,单管PDP-MCA法进行的是复合扩增、复合MCA和终点检测,MCA峰与相应MVP的甲基化水平之间有相关性,但并非定量关系。样品MCA图谱的特异性是由所检测的MVP共同决定的,其特征体现在图谱内各MVP峰之间的比例关系。未经标准化的参数,在样品间并没有可比性。因此,在设置反应时,须使用热启动聚合酶,并注意控制PCR循环次数,防止引物二聚体等非特异性产物的形成,以保持MVP片段的融链峰与其甲基化水平之间的相关性。
在分析利用数据,对样品图谱的特征进行数字化描述或建立判别标准时,对于MCA图谱,可以采用峰高比、峰面积比、峰面积百分比等,适用于没有HRM功能的定量PCR仪,须借助其他软件对MCA数据作进一步处理。在有HRM功能的定量PCR仪上,可用HRM代替MCA,直接得到标准和差异HRM图谱,既直观呈现样品间的差异(图3),又可直接以若干特征温度点的标准荧光信号值为参量进行判别分析。
本研究用FastDigest内切酶和MCA技术对传统的MSRE-PCR MCA法进行改良,初步建立了一种简便、快速、易于自动化和标准化的DNA甲基化分析技术。对于DNA样品,该技术可以在2 h内完成多个MVP的综合评估,即时生成样品特异性的MCA-HRM图谱。适用于各种根据DNA甲基化差异对样品进行归类或鉴别的研究与应用。
[1]Rakyan VK,Down TA,Balding DJ,et al.Epigenomewide association studies for common human diseases[J]. Nat Rev Genet,2011,12(8):529-541.
[2]赵书民,张素华,陈金中,等.同卵双生子外周血DNA甲基化谱的差异[J].法医学杂志,2011,27(4):260-264.
[3]Bocklandt S,Lin W,Sehl ME,et al.Epigenetic predictor of age[J].PLoS One,2011,6(6):e14821.
[4]Lee HY,Park MJ,Choi A,et al.Potential forensic application of DNA methylation profiling to body fluid identification[J].Int J Legal Med,2012,126(1):55-62.
[5]Frumkin D,Wasserstrom A,Davidson A,et al.Authentication of forensic DNA samples[J].Forensic Sci Int Genet,2010,4(2):95-103.
[6]Zhao G,Yang Q,Huang D,et al.Study on the application of parent-of-origin specific DNA methylation markers to forensic genetics[J].Forensic Sci Int,2005,154(2-3):122-127.
[7]王正,叶懿,侯一平.表观遗传学在法医学应用探讨[J].中国法医学杂志,2011,26(1):36-38.
[8]关亚卿,李淑瑾,丛斌,等.DNA甲基化在法医DNA分析中的应用[J].中国法医学杂志,2011,26(5):380-382,386.
[9]Harrison A,Parle-McDermott A.DNA methylation:a timeline of methods and applications[J].Front Genet,2011,2:74.
[10]赵书民,李成涛.DNA甲基化在法医学中的应用前景及其检测方法新进展[J].法医学杂志,2009,25(4):290-295.
[11]von Kanel T,Gerber D,Schaller A,et al.Quantitative 1-step DNA methylation analysis with native genomic DNA as template[J].Clin Chem,2010,56(7):1098-1106.
[12]Seipp MT,Pattison D,Durtschi JD,et al.Quadruplex genotyping of F5,F2,and MTHFR variants in a single closed tube byhigh-resolution amplicon melting[J].Clin Chem,2008,54(1):108-115.
[13]Vossen RH,Aten E,Roos A,et al.High-resolution melting analysis(HRMA):more than just sequence variant screening[J].Hum Mutat,2009,30(6):860-866.
[14]Singer-Sam J,Grant M,LeBon JM,et al.Use of a HpaⅡ-polymerase chain reaction assay to study DNA methylation in the Pgk-1 CpG island of mouse embryos at the time of X-chromosome inactivation[J]. Mol Cell Biol,1990,10(9):4987-4989.
[15]Melnikov AA,Gartenhaus RB,Levenson AS,et al. MSRE-PCR for analysis of gene-specific DNA methylation[J].Nucleic Acids Res,2005,33(10):e93.
[16]Strathdee G,Sim A,Brown R.Control of gene expression by CpG island methylation in normal cells[J]. Biochem Soc Trans,2004,32(Pt 6):913-915.
[17]De Smet C,Lurquin C,Lethé B,et al.DNA methylation is the primary silencing mechanism for a set of germ line-and tumor-specific genes with a CpG-rich promoter[J].Mol Cell Biol,1999,19(11):7327-7335.
[18]Strathdee G,Davies BR,Vass JK,et al.Cell typespecific methylation of an intronic CpG island controls expression of the MCJ gene[J].Carcinogenesis,2004,25(5):693-701.
[19]Oshiro MM,Futscher BW,Lisberg A,et al.Epigenetic regulation of the cell type-specific gene 14-3-3sigma[J].Neoplasia,2005,7(9):799-808.
[20]Juskowiak B.Nucleic acid-based fluorescent probes and their analytical potential[J].Anal Bioanal Chem,2011,399(9):3157-3176.
One-step Methylation Variable Position Analysis Technology in Single-tube
YUE Yang-yang1,2,ZHAO Gui-sen1,2,ZHANG Qian1,LU Di2,ZHAI Xian-dun1,MO Yao-nan1
(1.School of Forensic Medicine,Henan University of Science and Technology,Luoyang 471003,China;2.Key Laboratory of Evidence Science,China University of Political Science and Law,Ministry of Education,Beijing 100088,China)
ObjectiveTo develop the single-tube one-step methylation variable position(MVP)analysis technology——single-tube post-digestion PCR-melting curve analysis(PDP-MCA).MethodsBased on differentially methylated region(DMR)reported previously as the model,a set of primers with different melting temperatures of products in the two sides of MVP were designed.By using the FastDigest methylation-sensitive restriction enzyme(MSRE),DNA digestion,multiplex amplification,MCA detection and MCA profiles were performed in a single reaction tube.Same samples(peripheral venous blood,semen, and vaginal fluid,5 samples each type)were tested by single-tube one step MVP and traditional MSREPCR MCA technology.To verify the feasibility of this method,the results were compared with that of the traditional technology.The MCA/HRM profiles of different samples were analyzed and compared.ResultsWhen the melting temperature of the fragments had a differential of 2℃,the MCA melting peaks separated well,and MCA detection after multiplex amplification was successful.The single-tube PDP-MCA assay was developed,which integrated multiple reactions(digestion,amplification and detection)into one tube.By this method,the sample-specific profiles and data were analyzed in 2h,which is similar to that of the traditional method.The rapid classifications of the samples were also realized.ConclusionMultiplex MVPs can be analyzed in a single closed-tube.The single-tube PDP-MCA technology is a simple,fast,and automatable method.It can be used for detection of DNA methylation variations.
forensic genetics;DNA methylation;melting curve;methylation-sensitive restriction enzyme; methylation variable position
DF795.2
10.3969/j.issn.1004-5619.2013.06.005
1004-5619(2013)06-0419-06
2012-04-26)
(本文编辑:柳燕)
《法医学杂志》常用主题词(六)

检索词主题词英文串联质谱法串联质谱法tandem mass spectrometry气相色谱-质谱法/气液体色谱法-质量光谱测定法/色谱法,气液质量光谱测定法/色谱法,气质量光谱测定法/质量光谱测定法-气相色谱法气相色谱-质谱法gas chromatography-mass spectrometry气相色谱法色谱法,气相chromatography,gas色谱法,高速液相/色谱法,高效液相/色谱法,高压液相色谱法,高压液相chromatography,high pressure liquid色谱法,液相/液相色谱法色谱法,液相chromatography,liquid间质性肺疾病/肺炎,间质性/肺炎,间质肺疾病,间质性lung diseases,interstitial肺疾病,阻塞性肺疾病,阻塞性lung diseases,obstructive慢性阻塞性肺疾病/慢性阻塞肺疾病肺疾病,慢性阻塞性pulmonary disease,chronic obstructive创伤性膈疝疝,横膈,创伤性hernia,diaphragmatic,traumatic膈疝疝,横膈hernia,diaphragmatic腹内疝疝,腹部hernia,abdominal动脉瘤样骨囊肿骨囊肿,动脉瘤样bone cysts,aneurysmal胃癌胃肿瘤stomach neoplasms骨髓移植/骨髓细胞移植/移植,骨髓/移植,骨髓细胞/移植术,骨髓骨髓移植bone marrow transplantation
证据科学教育部重点实验室(中国政法大学)开放基金资助项目(08KFKT002)
岳阳阳(1988—),男,陕西兴平人,硕士研究生,主要从事法医分子遗传学研究
赵贵森,男,副教授,主要从事法医遗传学研究;E-mail:lyfy@haust.edu.cn
