盐湖开发对柴达木盆地盐湖湖水细菌的多样性影响
2013-03-04周延,王芳,王琳
周 延,王 芳,王 琳
(1 北京化工大学生命科学与技术学院制药工程系,北京100029;2 中国水利水电科学研究院水资源研究所,北京100044)
“柴达木”是蒙古语 “盐泽”之意,现有湖泊33个。各国学者对盐环境微生物尤其是嗜盐菌的各个方面进行了大量的研究,发现了许多新的微生物类群。近年来证实了盐环境中独特微生物群系的存在,且大多群系是依赖于盐环境且只有不到0.01%~10%的微生物可以得到纯培养[1-3],其中大部分微生物在盐环境破坏后将无法生存[4]。
与淡水湖相比,盐湖生态系统组成相对简单和单一,以微生物为主要生物类群,特别是其特有的微生物系统对盐湖湖水的物理化学环境有着非常强的依赖关系,湖水组成一旦变化,必然引起微生物系统的变化,其中不能适应这种变化的微生物将面临消失的危险。另一方面,盐湖受到来自人类活动和自然环境因素变化的双重威胁,这些威胁甚至大于对淡水湖泊的威胁,因为人们通常认为盐湖没有内陆的各种淡水水体那么重要和有价值,可以不采取保护措施,以至于不少盐湖在过去的开发中,水位大幅下降和盐度上升,甚至有些湖泊,如团结湖,已经成为排放盐田老卤的地方。盐湖如何保护,保护什么?这一问题现在仍没有被重视。
对我国西北部盐环境微生物进行的大量研究工作充分证明了青海盐环境中存在丰富的微生物多样性、存在较多的新的微生物类群,并且潜藏着能产生较强生物活性的微生物资源[5-9]。在此基础上,本研究应用PCR-DGGE、普通PCR和培养法结合对柴达木盆地中的7个盐湖、3个咸水湖、2个淡水湖及盐田的湖水细菌多样性进行了调查,旨在总结其微生物类群的分布规律,并试图就盐度对细菌种群的影响进行深入探讨,以期对盐湖生态资源的保护有所参考。
1 材料和方法
1.1 样品采集与总DNA提取
湖水样品采自青海省柴达木盆地淡水湖:可鲁克湖和小苏干湖;咸水湖:尕海湖、托素湖、大苏干湖;盐湖:都兰湖,柯柯盐湖,大柴旦湖,南霍布逊湖,小柴旦湖,东台吉乃尔湖,达布逊湖,察尔汗盐田,南霍布逊盐田。
500 m L湖水样品经0.22μ滤膜过滤,滤膜加入纯水震荡均匀,离心后用天根细菌基因组提取试剂盒提取DNA。
1.2 PCR-DGGE扩增
PCR-DGGE 16S r DNA引物[10-11]:

样品DNA经PCR扩增后浓缩进行DGGE电泳,用以比较不同样品中菌群分布和差异。
1.3 普通PCR扩增
普通PCR 16S r DNA扩增引物[12-15]:


普通PCR扩增得到的16S r DNA扩增片段用琼脂糖凝胶电泳纯化后连接p MD19-T载体,连接产物转化为E.coli DH5α,每个样品随机选取40个转化菌落进行测序,用以了解样品中主要菌群类型。
1.4 培养法
培养基[16]:①CM培养基(/L):Casamino acids 7.50 g,Yeast extract 10.00 g,Na3-citrate 3.00 g,KCl 2.00 g,MgSO4·7H2O 20.00 g,FeSO4·7 H2O 0.05 g,NaCl 200.00 g,p H=7.2;②HM培养基(/L):NaCl 100.0 g,KCl 2.0,MgSO4·7H2O 1.0 g,CaCl2·2H2O 0.36 g,Na HCO30.06 g,Yeast extract 10.0 g,Glucose 1.0 g,p H=7.2~7.4;③APA培养基(/L):NaCl 20.0 g,KH2PO42.0 g,MgSO4·7 H2O 1.0 g,Na2CO310.0 g,Yeast extract 5.0 g,Glucose 1.0 g,p H=9~10。
采用3种基础培养基在用于相应样品时进行适当盐度调整。水样经经0.22μ滤膜过滤,将滤膜加入液体培养基震荡均匀后,梯度稀释涂布平板。37℃培养3~15 d,划线至获得单菌落。菌株用甘油管法保存[16]。
2 结果与讨论
2.1 盐田细菌多样性情况
应用PCR-DGGE法测试了淡水湖(可鲁克湖,小苏干湖)、咸淡水湖 (尕海,托素湖,大苏干湖)、盐湖 (都兰湖,柯柯盐湖,大柴旦湖,南霍布逊湖,小柴旦湖,东台吉乃尔湖,达布逊湖)和察尔汗盐田、南霍布逊盐田的样品。共得到不同位置的谱带32个,根据DGGE原理,表明在所测样本中至少存在32个不同种属的微生物。各盐湖的PCR-DGGE电泳谱图见图1。培养法和普通PCR转化后测得的菌属代表了柴达木各湖泊的主要细菌种属,鉴定出的各样点细菌可大致归属于12个属的105个物种 (已另具文 “柴达木盆地盐环境湖泊中盐度对细菌多样性影响的研究”,文章在投),其中包括了稀有的放线菌类群,如Kocuria等,这些菌属在以往的研究中曾被报道[5-9]。其中Brevibacillus,Paenibacillus,Bacillus,Streptomyces属中检到的菌种数占所有检出菌种数的84%,是盐湖中存在的主要菌属。对湖水的培养法和普通PCR法的研究结果显示,柴达木盆地盐湖内存在丰富的微生物群系。
从东台吉乃尔湖和南霍布逊湖的周边盐田和盐厂样品的细菌菌群分布 (表1)可以看到,在所检盐田只得到5个属的细菌,盐田细菌群属种比盐湖少50%以上。DGGE谱图上,盐田样品的谱带数(表2)也显示盐田微生物种群的减少。从主要菌属的缺失来看,盐田菌群与盐湖已经发生明显变化,盐田微生物种群的分布狭窄。
2.2 盐湖细菌多样性与水体特性的关系
为了进一步了解湖水中细菌多样性与湖水特征的关系,在托素湖与大苏干湖分别选取了4个取样点进行了实验。托素湖与大苏干湖的共同点是二者均通过地表径流与淡水湖相连,因而从淡水入口到远端形成了不同的湖水盐度 (图2),如果4个样品中微生物存在差异,则这个差异只可能是由于湖水差异造成的。

图1 PCR-DGGE电泳谱带示意图

表1 盐湖周边盐田的菌群变化

表2 盐田DGGE谱带结果
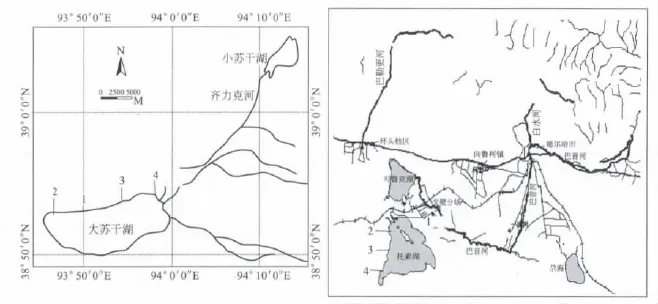
图2 大苏干湖和托素湖取样点示意图

表3 局部环境对湖泊微生物群落的影响
从样品的DGGE结果(表3)来看,湖中取自远离淡水入口处的样品 (大苏干湖1#样与2#样,托素湖3#样与4#样)的DGGE谱带显示更明显的咸水湖特征。两湖的1#与2#、3#与4#取样点的盐度相近,其DGGE谱图也几乎相同。盐度不同的样品(如1#,3#样)DGGE谱带则有一定差异。托素湖和大苏干湖4个湖水样品的DGGE谱带差异的主要原因应该是湖水差异导致的,更确切地说,在这里是湖水盐度的变化带来的。
由于盐度对菌群分布的决定作用造成了在湖中依盐度变化,形成了微生物的过渡形分布,带来了托素湖和大苏干湖不同位置取得样品的DGGE谱图的差异性。这说明湖水特性,尤其是湖水的盐度,对细菌种属的分布有较大影响。
2.3 盐湖微生物盐度的临界条件探讨
在本次研究所调查的盐湖中,大柴旦湖、小柴旦湖、柯柯盐湖、东台吉乃尔湖、达布逊湖均为硫酸镁亚型盐湖,其水中主体矿物组成特性相近。在这几个盐湖中,湖水的物理化学因子的影响,尤其是矿化度 (盐分浓度)和p H值,是湖水中微生物的种类和数量不同的主因。而矿化度和p H值呈现一定的相关性,即矿化度高的湖泊一般为酸性或微酸性湖泊,矿化度较低的湖泊为碱性或微碱性湖泊。

表4 硫酸镁亚型盐湖比较
同为硫酸镁亚型的大柴旦盐湖、柯柯盐湖、东台吉乃尔湖、小柴旦湖和达布逊湖,其矿化度、p H值和菌种个数和主菌数见表4和图3。尕海的矿化度较低,菌种数为26,主菌属数为4——即Brevibacillus,Paenibacillus,Bacillus,Streptomyces属的菌株。这些硫酸镁亚型湖泊与低矿化度的尕海相比,随着水体的矿化度升高,优势细菌种数变化不大。但是,当矿化度从大柴旦湖的274.438 g/L升高到小柴旦湖的339.074 g/L,鉴定得到的菌种数从13变为9;当矿化度到达布逊湖的470.18 g/L后,菌种数为5,低于尕海菌种数的20%,且主菌属数变为2,有两个属的菌消失了。因此,矿化度在350~450 g/L可能为盐浓度影响较大的过渡区,一旦矿化度高于450 g/L,盐湖微生物一些主要菌属开始消失,盐湖生态将发生质的变化。
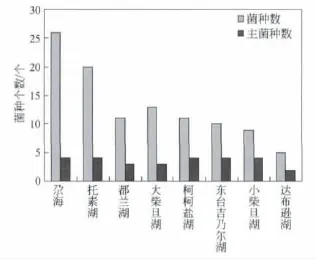
图3 盐湖鉴定结果比较
对于矿化度在270~350 g/L内的盐湖,330 g/L的东台吉乃尔湖与339 g/L的小柴旦湖DGGE谱带数骤减引起我们的关注。表明在这里存在引起微生物某些变化的突出因素。据文献[17]报道,硫酸镁亚行卤水在330~360 g/L严重结盐,且Na+/Mg2+比高于0.5时结盐严重,研究涉及的几个湖此系数均高于0.5。因此认为盐湖卤水结盐可能是引起湖水中微生物种群减少的重要因素。考虑到盐湖供水流量的变化,可以考虑以330 g/L作为硫酸镁亚行盐湖生态稳定的阀值。
综上所述,盐湖和咸淡水湖中的研究表明,在盐湖生态系统中,盐度和p H值是决定生物物种多样性及其个体丰度的关键因素。认为330 g/L可以考虑作为硫酸镁亚型盐湖生态变化控制的参考临界值。
3 结 论
本文应用PCR-DGGE法测试了柴达木盆地的12个湖泊和察尔汗盐田、南霍布逊盐田的样品,结果显示盐田细菌属种比盐湖少50%以上。盐田菌群与盐湖已经发生明显变化,盐田开采如果不加以控制,势必造成盐湖生态的不可逆变化。
托素湖和大苏干湖不同位置取得样品的DGGE谱图的差异性证明了湖水特性,尤其是湖水的盐分浓度,对细菌种属的分布有较大影响。该结果提示,盐度可以作为对盐湖菌群保护的重要指标之一。对同为硫酸镁亚型的盐湖和咸淡水湖中的研究表明,在盐湖生态系统中,盐度和p H值是决定生物物种多样性的关键因素。并提出将330 g/L作为硫酸镁亚型盐湖生态变化控制的参考临界值。
[1] 柴丽红,崔晓龙,彭谦,等.青海两盐湖细菌多样性研究[J].微生物学报,2004,44(3):271-275.
[2]Whitman W B,Coleman D C,Wiebe W J.Prokaryotes:The unseen majority[J].Proceedings of the National Academy of Sciences,1998,93:6578-6583.
[3]Dunber J,Barns S M,Ticknor L O,et al.Empirical and theoretical bacterial diversity infour Arizona soil[J].Applied &Environmental Microbiology,2002,68:3035-3045.
[4]Torsvik V,Ovreas T F.Prokaryotic diversity magnitude,dynamics,and controlling factors[J].Science,2002,296:1064-1066.
[5] 柴丽红,王涛,李沁元,等.应用DGGE法对青海相邻两盐湖中细菌多样性的快速检测[J].生物学杂志,2003,20(1):13-15.
[6] 李文均,徐平,徐丽华,等.极端环境中的放线菌资源 [J].微生物学通报,2003,30(4):125-127.
[7] 蔡艳,薛泉宏,陈占全,等.青海湖水及湖滨盐化土壤放线菌的分类及耐盐性[J].微生物学杂志,2005,25(4):100-101.
[8] 米琴,张玉琴,陈义光,等.青海盐环境下革兰氏阳性中度嗜盐细菌的分离及其生物学特性 [J].陕西师范大学学报:自然科学版,2005,33(3):87-90.
[9] 叶央芳,严小军,黄晓春,等.青海盐湖嗜盐微生物类群及F16菌株生长特性和抗菌、抗肿瘤活性 [J].应用生态学报,2006,17(10):1996-1998.
[10]Weisburg W G,Barns S M,Pelletier D A,et al.16S ribosomal DNA amplification for phylogenetic study[J].Journal of Bacteriology,1991,173:697-703.
[11]Baker G C,Smith J J,Cowan D A.Review and re-analysis of Domain-specific 16S primers[J].Journal of Microbiological Methods,2003,55(3):541-555.
[12]Amann R I,Ludwig W,Sehleifer K H.Phylogenetie identification and in situ detection of individual microbial cells without cultivation[J].Microbiological Reviews,1995,59:143-169.
[13]Muyzer G,Waal E D De,Uitterlinden A G.Profiling ofcomplex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction—amplified genes coding for 16S r RNA[J].Applied Environmental Microbiology,1993,59:695-700.
[14]Ferris M J,Muyzer G,Ward D M.Denaturing gradient gel electrophoresis profiles of 16S r RNA·defined populations inhabiting a hot spring microbial mat community[J].Applied Environmental Microbiology,1996,62(2):340-346.
[15] 萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯S.分子克隆实验指南[M].北京:科学出版社,1992.
[16] 顾晓颖,李冠,吴敏.巴里坤湖和马纳斯湖嗜盐菌的分离及功能酶的筛选[J].生物技术,2007,17(26):26-30.
[17] 于升松.察尔汗盐湖首采区钾卤水动态及其预测 [M].北京:科学出版社,2000.
