表达在HEK293细胞上的BKCa通道基本特性与动力学调控研究*
2013-03-04谭晓秋程秀丽曾晓荣曹济民
谭晓秋,程 俊,程秀丽,李 畅,毛 亮,曾晓荣,曹济民,杨 艳△
(1.泸州医学院医学电生理省部共建教育部重点实验室,四川泸州646000;2.中国医学科学院/北京协和医学院基础医学研究所,北京100005)
大电导钙激活钾通道(large-conductance calcium-activated potassium channels,BKCa)是血管平滑肌重要的钾离子通道之一,携带了70%~80%的外向电流,在调节血管张力、血流量和血压活动中起重要作用。了解作为调节血管张力的靶点及内源性活性物质配体的BKCa通道的特性,对于深入研究通道调控机制及临床治疗药物筛选等有重要意义[1-4]。BKCa通道受细胞内Ca2+浓度和膜电位二者的调节[5]。当肌紧张性增高时,Ca2+内流激活肌浆网释放细胞内钙,再加上膜的去极化共同激活BKCa通道,使K+外流,膜电位向超极化方向变化而使血管舒张,从而对抗张力增高引起的去极化及收缩作用,使细胞恢复到下一次兴奋前的备用状态。BKCa通道就是通过环形负反馈机制来控制平滑肌细胞肌源性张力和静息膜电位去极化的程度。而BKCa通道的高电导性及在平滑肌细胞上的高密度表达决定了它对血管张力的调节尤显重要[6-9]。目前对于BKCa通道的研究更是深入基因和分析水平,而离子通道药物作用的动力学调控更是研究的热点之一[4,6]。但是天然细胞由于通道不单一、表达密度不确定等特点,在研究动力学调控方面,异源表达越来越受人们青睐。本研究以HEK293细胞系为载体,构建稳定表达人BKCa通道细胞系,研究其基本电生理学特征和建立动力学调控模型,为进一步广泛深入的研究药物动力学作用机制奠定基础。
1 材料与方法
1.1 材料 含有人血管平滑肌BKCa通道α亚单位的表达质粒pcDNA3.1-BKα由丹麦NeuroSearch公司Philip K.Ahring教授馈赠,β1亚单位的表达质粒pIRES-β1由本实验室构建。改良Eagle高糖培养基(DMEM)购自Invitrogen公司。
1.2 方法
1.2.1 HEK293细胞培养及转染和筛选 HEK293细胞使用DMEM高糖培养基(含10%FBS)在5%CO2的培养箱中进行培养和传代。细胞密度80%左右使用脂质体(lipofectamine 2000,Invitrogen)转染法,将4μg的质粒转染到3.5mm的培养皿中。使用0.8mg/mL G418进行筛选,得到稳定表达pcDNA3.1-BKα和(或)β1的 HEK293细胞系用于进一步实验。
1.2.2 全细胞膜片钳实验 选取电极阻抗3~5mΩ进行。浴液为:NaCl 137.00mmol/L,KCl 5.90mmol/L,MgCl21.20 mmol/L,CaCl21.8mmol/L,葡萄糖 14.00mmol/L,4-羟乙基哌嗪乙磺酸(HEPES)10.00mmol/L(pH 7.4);电极液:KCl 128.00mmol/L,NaCl 12.00mmol/L,MgCl24.00mmol/L,HEPES 10.00mmol/L,乙二醇-双-(2-氨基乙醚)四乙酸(EGTA)0.05mmol/L(pH 7.2)。钳制电位为-80mV,刺激方案包括阶跃刺激方案:-80mV~+90mV,时程400ms。
1.2.3 单通道膜片钳实验 本实验采用的单通道膜片钳记录方式包括细胞贴附式、内面向外式和外面向外式,浴液和电极液使用对称性高钾溶液,电极阻抗12~15mΩ。电极液和浴液根据细胞膜的方式选择,保持细胞内液:天门冬氨酸钾(KAsp)100.00mmol/L,KCl 40.00mmol/L,HEPES 10.00/L mmol(pH 7.2),EGTA 1.00mmol/L;细 胞 外 液:K-Asp 40.00mmol/L,KCl 100.00mmol/L,HEPES-K 10.00mmol/L (pH 7.4),EGTA 2.00mmol/L。
1.2.4 内面向外式宏观电流(macro-insideout)检测 选择离子通道表达密度较高的细胞,使用电极阻抗为3~5mΩ,形成内面向外式膜片,使用宏观电流记录方案,观察局部膜片电流,研究其动力学调控。电极液:K-Asp 40.00mmol/L,KCl 100.00mmol/L,HEPES 10.00mmol/L (pH 7.2),EGTA 2.00mmol/L;浴液:K-Asp 100.00mmol/L,KCl 40.00mmol/L,HEPES 10.00mmol/L (pH 7.4),EGTA 1.00mmol/L。
1.3 统计学处理 采用SPSS14.0统计学软件进行统计学分析,数据采用Clampfit10.1进行处理。计量资料采用±s表示,以P<0.05为差异有统计学意义。
2 结 果
2.1 HEK293细胞上BKCa的基本电生理学特性 转染在HEK293细胞系的BKCa电流基本电生理学特性,全细胞构型下,转染BKCa通道α亚单位的HEK293细胞能够记录到一较大外向电流,I-V曲线呈现外向整流特性,能够被BKCa特异性阻断剂IbTX(200nmol/L)所阻断(图1),表明所记录到的外向电流主要为BKCa所携带。在单通道构型下,细胞贴附式和内面向外式均能记录到电流幅度随着电压增加而增大的单通道电流,开放概率呈现明显的电压依赖性。在cell-attached和inside-out构型下,BKCa通道具有明显的电压依赖性(图2);cell-attached和inside-out BKCa单通道斜率电导分别为(212.64±4.86)pS(n=12)和(216.38±3.55)pS(n=10),二者之间差异无统计学意义(图3);在inside-out构型下(+40mV膜电位)BKCa通道钙离子依赖性的典型电流记录图,见图4;BKCa通道IbTX敏感性,在outside-out构型下,BKCa通道能够被200nmol/L IbTX阻断(图5)。在外面向外式膜片构型下,200nmol/L IbTX几乎完全阻断该单通道电流,进一步证明该电流为BKCa电流。同时,通过图3的I-V曲线可以看,I-V曲线通过0点,反转电位为0mV,这与对称性高钾时的平衡电位一致,表明为钾离子选择性电流。

图1 表达在HEK 293细胞系上的BK通道全细胞电流

图2 BKCa通道电压依赖性电流图
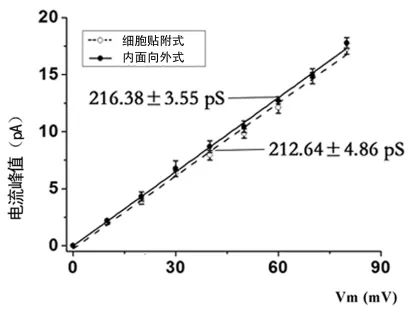
图3 BKCa单通道斜率电导比较电流图

图4 BKCa通道钙离子依赖性的典型电流图
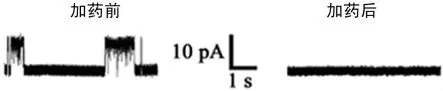
图5 BKCa通道被bTX阻断电流图
2.2 HEK293细胞上BKCa动力学调控模型研究 本研究采用两种方式研究BKCa动力学调控模型(图6),一种为内面向外式单通道膜片钳,一种为内面向外式宏观电流(图6A)。在内面向外式单通道下,共转染BKCa通道α和(或)β1亚单位发现,β1的表达一方面增加了通道的开放该概率,另一方面可以明显增加通道的开放时程(即平均开放时间,见图6A彩色)。通过增加通道表达密度,使用内面向外式宏观电流记录方式研究通道电压依赖性、Ca2+敏感性和通道动力学。在内外向外式宏观电流记录中可以分析通道从关闭向开放(C→O)和开放向关闭(O→C)之间转变的动力学特征(图6B)。从-80mV去极化到+150mV通道完全开放,通过拟合得到时间常数为Tau=1.76ms,而当通道由+150mV超极化到-80mV时,通道关闭。在此过程中产生尾电流,可以反映通道从开放向关闭转换的过程,通过拟合得到本例的时间常数Tau=0.27ms。通过在阶跃(step)刺激方案得到的内面向外式宏观电流(图6C),随着去极化电压的增加,电流幅度增加。计算得到不同电压下的电导值(G),以G/Gmax-Vm作图,曲线经Boltzmann方程拟合,得到通道的半数最大激活电压(V1/2),本实验在细胞内游离钙浓度([Ca2+]free)为 0.01μmol/L 的是 V1/2为(86.0±9.9)mV,见图6D。
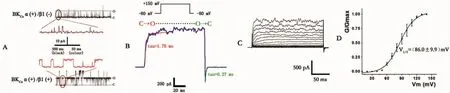
图6 表达在HEK293细胞系上的BKCa通道动力学特性
3 讨 论
3.1 BKCa通道在HEK293细胞中的表达 作为血管平滑肌细胞膜上表达最为丰富的BKCa通道,一直以来是从事血管活动调控研究的热点和重点。BKCa通道是很多临床降血压药物中的作用靶点之一,包括一些常见的活血化淤中药也可以通过激活该通道而发挥调控血压的作用[10-13]。随着研究的深入,仅仅利用急性酶分离的细胞从事BKCa通道调控研究是远远不够的,尤其是血管平滑肌细胞培养之后常常发生表型的改变,BKCa通道的表达和功能也发生变化。因此,将通道克隆到工具细胞进行研究是常见的研究方法之一。尤其是一些针对BKCa通道功能结构域和位点突变以及动力学研究。本实验通过构建和筛选稳定的单克隆细胞株并通过电生理学和分子生物学的方法进行鉴定。表达在HEK293细胞上BKCa通道电生理学特性与文献和本研究报道的急性酶分离天然细胞是一致的,主要包括大电导特性[本实验内面向外式构型下的电导值为(216.38±3.55)pS]、电压依赖性、Ca2+敏感性和IbTX敏感性。通过多种技术和手段证明本实验构建的细胞株能够很好的用于BKCa通道功能调控研究。
3.2 BKCa通道动力学调控 目前,对于BKCa通道的功能调控研究已比较的深入,但是从文献报道看不同药物表现出不同的作用特点,主要表现在动力学的差异[12]。所谓的通道动力学主要是指通道开放和关闭状态相互转变过程中的机制。这是一个非常复杂的过程。膜片钳技术是研究离子通道动力学调控的最有效的技术,一方面可以通过单通道记录技术研究某一单个的离子通道的开放和关闭的动力学特点(图6A),另一方面也可通过全细胞记录研究整个细胞的离子通道宏观动力学,二者互为补充。BKCa通道由α和β1亚单位组成,β1亚单位是通道发挥正常功能的组成部分,研究表明β1亚单位的功能异常与高血压的发生存在密切关系[14-15]。本课题前期研究提示,在高血压患者存在β1亚单位水平的下调[16]。本研究通过共表达α和β1亚单位可以看出,β1亚单位通过增加通道的开放时程而使通道的开放增加。另外,由于很多物质对BKCa通道的作用位点是在细胞内(如Ca2+),因此单通道记录上多采用内面向外式膜片钳。由于传统全细胞膜片钳技术胞内换液非常困难而且稳定性较差,因而全细胞膜片钳在研究BKCa通道胞内作用物质动力学机制上表现出一定的不足之处。本实验通过增加BKCa通道在HEK293细胞上的表达密度,同时实验过程中增大记录电极的口径(本实验为3~5mΩ,而不是常用的单通道阻抗12~15mΩ),这样在一个膜片上就有几十或者上百个离子通道表达,从而记录到与全细胞类似的电流,称之为macro-insideout current(图6C)。在此基础上,可以很方便地进行细胞内物质作用研究,比如改变不同的钙离子浓度。该记录方式还有一个有单通道记录相同的优点就是记录更加稳定,对防震的要求比传统全细胞低。因此,该记录方式可以很好的研究通道的开关动力学、电压依赖性和钙离子敏感性。但是,该记录方式适用于一些直接作用于通道内侧的物质进行研究,而对于直接细胞外作用或者与细胞膜上的受体结合而间接作用于通道的物质不适宜选用此种方法。
综上所述,本实验构建的稳定表达BKCa通道的HEK293细胞系及在此基础上建立的动力学模型可以很好的用于部分BKCa通道功能研究。
[1]Ledoux J,Werner ME,Brayden JE,et al.Calcium-activated Potassium channels and the regulation of vascular tone[J].Physiology(Bethesda),2006,21(1):69-78.
[2]Ko EA,Han J,Jung ID,et al.Physiological roles of K+channels in vascular smooth muscle cells[J].J Smooth Muscle Res,2008,44(2):65-81.
[3]Li P,Zeng X,Yang Y,et al.Role of Calcium mobilization in the regulation of spontaneous transient outward currents in porcine coronary artery myocytes[J].Sci China C Life Sci,2007,50(5):660-668.
[4]Eichhorn B,Dobrev D.Vascular large conductance calcium-activated Potassium channels:functional role and therapeutic potential[J].Naunyn Schmiedebergs Arch Pharmacol,2007,376(3):145-155.
[5]Latorre R,Brauchi S.Large conductance Ca2+-activated K+(BK)Channel:activation by Ca2+and voltage[J].Biol Res,2006,39(3):385-401.
[6]Wu SN.Large-conductance Ca2+-activated K+channels:physiological role and pharmacology[J].Curr Med Chem,2003,10(8):649-661.
[7]Jaggar JH,Porter VA,Lederer WJ,et al.Calcium Sparks in smooth muscle[J].Am J Physiol Cell Physiol,2000,278(2):C235-256.
[8]Wray S,Burdyga T,Noble K.Calcium signalling in smooth muscle[J].Cell Calcium,2005,38(3/4):397-407.
[9]Karaki H,Ozaki H,Hori M,et al.Calcium movements,distribution,and functions in smooth muscle[J].Pharmacol Rev,1997,49(2):157-230.
[10]Tan X,Yang Y,Cheng J,et al.Unique action of Sodium tanshinone II-A sulfonate(DS-201)on the Ca(2+)dependent BK(Ca)activation in mouse cerebral arterial smooth muscle cells[J].Eur J Pharmacol,2011,656(1/2/3):27-32.
[11]Yang Y,Cai F,Li PY,et al.Activation of high conductance Ca2+-activated K+channels by Sodium tanshinoneIIA sulfonate(DS-201)in porcine coronary artery smooth muscle cells[J].Eur J Pharmacol,2008,598(1/2/3):9-15.
[12]Wu SN,Chen CC,Li HF,et al.Stimulation of the BK(Ca)Channel in cultured smooth muscle cells of human trachea by magnolol[J].Thorax,2002,57(1):67-74.
[13]Liu XR,Tan XQ,Yang Y,et al.Propofol increases the Ca2+sensitivity of BKCain the cerebral arterial smooth muscle cells of mice[J].Acta Pharmacol Sin,2012,33(1):19-26.
[14]Plüger S,Faulhaber J,Fürstenau M,et al.Mice with disrupted BK Channel beta1subunit gene feature abnormal Ca2+spark/STOC coupling and elevated blood pressure[J].Circ Res,2000,87(11):E53-60.
[15]Brenner R,Peréz GJ,Bonev AD,et al.Vasoregulation by the beta1subunit of the calcium-activated Potassium Channel[J].Nature,2000,407(6806):870-876.
[16]Yang Y,Li PY,Cheng J,et al.Function of BKCachannels is reduced in human vascular smooth muscle cells from Han Chinese patients with hypertension[J].Hypertension,2013,61(2):519-525.
