阿奇霉素对哮喘大鼠瘦素表达及气道炎症的影响
2013-03-04朱述阳嵇桂娟卢立国闫明华段存玲张文辉
朱述阳,嵇桂娟,卢立国,闫明华,段存玲,张文辉,卞 宏
(1.徐州医学院附属医院呼吸内科,江苏徐州221006;2.江苏省沭阳县人民医院呼吸科 223600)
哮喘是多种细胞和细胞组分共同参与的气道慢性炎症性疾病。气道平滑肌细胞(airway smooth muscle cells,ASMC)在哮喘的发病机制中的作用被越来越多的研究发现[1]。研究表明肥胖患者哮喘发病率增加,且症状严重,对治疗不敏感,肥胖哮喘小鼠气道炎症和反应性明显高于非肥胖哮喘小鼠[2]。瘦素是由脂肪细胞分泌的一种蛋白质,其受体在肺组织中有广泛的表达,其能够独立于肥胖而调节气道炎症反应[3]。大环内酯类抗菌药物在支气管哮喘中治疗作用得到越来越多研究证实[4]。
1 材料与方法
1.1 试剂和仪器 卵清清蛋白(ovalbumin,OVA,美国Sigma公司),阿奇霉素(天津市生物化学制药厂,批号:国药准字H20020293),DMEM培养基(Gibco公司),20%小牛血清(杭州四季青公司),瘦素酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(北京中杉金桥生物技术有限公司),一抗(兔抗大鼠leptin IgG,1∶100稀释,武汉博士德生物有限公司),二抗(羊抗兔IgG,1∶200稀释,北京中杉金桥生物技术有限公司),4-羟乙基哌嗪乙磺酸{[4-(2-hydroxyerhyl)-1-piperazinyl]ethanesulfonic acid,HEPES},100U/mL 青 霉素、链霉素等。
1.2 大鼠肥胖模型的建立 参照文献[5]建立大鼠肥胖模型,选择雌性4周龄SD大鼠48只,SPF级,体质量(76~81)g,由徐州医学院实验动物中心提供。适应性饲养1周后,将48只大鼠随机分为体质量正常组24只,喂食基础饲料,每100g提供能量1 697.1kJ;体质量肥胖组24只,喂食高能饲料,每100 g提供能量1 951.7kJ,其中35%的能量由脂肪提供。两组均不锈钢笼单笼饲养,12h光照/12h黑暗,室温22~25℃,湿度40%~70%,自由饮蒸馏水,人为控制大鼠摄食量,并记录每日摄食量和撒食量,每周称重,喂养7周。以超过正常大鼠体质量1/3为肥胖标准。
1.3 大鼠哮喘模型的建立 将体质量正常组再分为正常对照组、正常哮喘组和正常干预组。体质量肥胖组再分为肥胖对照组、肥胖哮喘组和肥胖干预组,每组8只。参照文献[6]并加以改进制备大鼠哮喘模型:正常哮喘组、正常干预组、肥胖哮喘组和肥胖干预组大鼠于喂养7周后,第1天腹腔注射含有1mg OVA和20μg氢氧化铝的生理盐水0.5mL,并于第8天重复注射1次。自第15天开始给予1%OVA雾化吸入,每天1次,每次30min,持续3d;正常干预组和肥胖干预组在每次雾化前30min腹腔注射阿奇霉素,剂量按1.75mg·kg-1·d-1,溶解于0.5mL生理盐水中;正常哮喘组、肥胖哮喘组以生理盐水代替。正常对照组、肥胖对照组以生理盐水代替OVA致敏和激发。
1.4 ASMC的培养及鉴定 肥胖模型以及哮喘模型复制成功后,处死大鼠,迅速无菌分离大鼠的气道平滑肌组织,采用组织贴块法培养原代ASMC,胰酶消化法传代并自然纯化,实验用4~6代。取第4代培养的大鼠ASMC,制成单细胞悬液接种于96孔培养板,37℃,5%CO2培养24h,正常哮喘组、正常干预组、肥胖哮喘组和肥胖干预组分别给予含致敏老鼠血清的培养液,正常对照组和肥胖对照组给予含0.1%胎牛血清的培养液继续培养48h,正常干预组和肥胖干预组给予达氏修正依氏培养基(dulbecco′s modified eagle′s medium,DMEM)稀释的阿奇霉素(10-5M)。培养的正常对照组ASMC经形态学观察和免疫组织化学染色法测α肌动蛋白(α-actin)的表达进行细胞的鉴定。
1.5 标本采集及处理 取心脏血2mL,分离血清分装,-80℃保存备用。用PBS灌洗左肺,反复3次,回收率在80%以上视为成功。计数支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)白细胞总数和中性粒细胞数目,4℃下,2 500r/min离心15min,取上清液,-80℃保存备用。取右肺组织,迅速放入液氮冷冻后,保存在-80℃冰箱中用于Western blot测定,取左肺组织,4%多聚甲醛溶液固定,常规石蜡包埋、切片、HE染色。ASMC干预培养24h后,取上清液离心后-20℃低温保存备用。
1.6 血清、BALF及细胞上清液中瘦素浓度测定 参照试剂盒说明书操作,测吸光度值(A450nm),通过标准曲线计算血清、BALF及细胞上清液中瘦素的浓度。
1.7 肺组织中瘦素蛋白含量测定 1mg肺组织中加入6μL尿素裂解缓冲液,置冰上1h,每15min涡旋1次,4℃下,10 000r/min离心1h,取上清液,以牛血清清蛋白为标准品测定蛋白浓度。150μg蛋白加入十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液,置沸水中加热5min。经10%SDS-PAGE电泳分离后,以半干转移法转至硝酸纤维膜上。室温封闭1h,加入一抗,4℃过夜,再加入二抗,室温孵育2h,显色1~2h后终止。以大鼠β肌动蛋白(β-actin)作内参照。以目的蛋白与β-actin吸光度值的比值进行半定量分析。
1.8 大鼠ASMC内瘦素蛋白含量测定 将细胞制成单细胞悬液后,按细胞数1×107接种于6孔细胞培养板中,37℃、50 mL/L CO2培养24h,待细胞生长融合后收集蛋白,Western blot分别检测细胞内瘦素蛋白的含量。
1.9 统计学处理 应用SPSS13.0软件进行统计分析,计量资料以±s表示。采用单因素方差分析比较各组均数总的差异,q检验进行两两比较,以P<0.05为差异有统计学意义。
2 结 果
2.1 阿奇霉素对肥胖哮喘模型大鼠肺组织病理变化的影响正常对照组和肥胖对照组大鼠肺组织可见黏膜上皮细胞完整,管腔中无黏液分泌,管壁无炎症细胞浸润;正常哮喘组和肥胖哮喘组大鼠肺组织显示黏膜上皮局部脱落,黏膜下水肿,黏液腺增生,杯状细胞增多,管壁各层均可见炎症细胞浸润;正常干预组和肥胖干预组大鼠肺组织炎症细胞浸润减轻,见图1。

图1 6组大鼠肺组织病理表现影像(免疫组织化学染色,×400)
2.2 ASMC的鉴定 培养的ASMC呈梭形,平行生长,束状排列,密集与稀疏处相互交错呈“峰谷”状。免疫细胞化学检测法表明,抗平滑肌α-actin抗体呈阳性染色即胞质内可见大量绿色荧光,证实所养细胞为ASMC。见图2~3。
2.3 6组大鼠BALF中白细胞总数和中性粒细胞数 正常干预组、肥胖干预组BALF中白细胞总数、中性粒细胞计数明显低于正常哮喘组及肥胖哮喘组(P<0.05)。正常哮喘组和肥胖哮喘组分别较正常对照组和肥胖对照组均有所升高,肥胖哮喘组较正常哮喘组升高(P<0.05)。见表1。

图2 培养的第4代ASMC影像(倒置显微镜,×100)

图3 ASMC抗α-actin免疫荧光细胞化学影像(倒置显微镜,×400)
表1 各组大鼠BALF中白细胞总数和中性粒细胞计数的比较(±s,×104/mL)
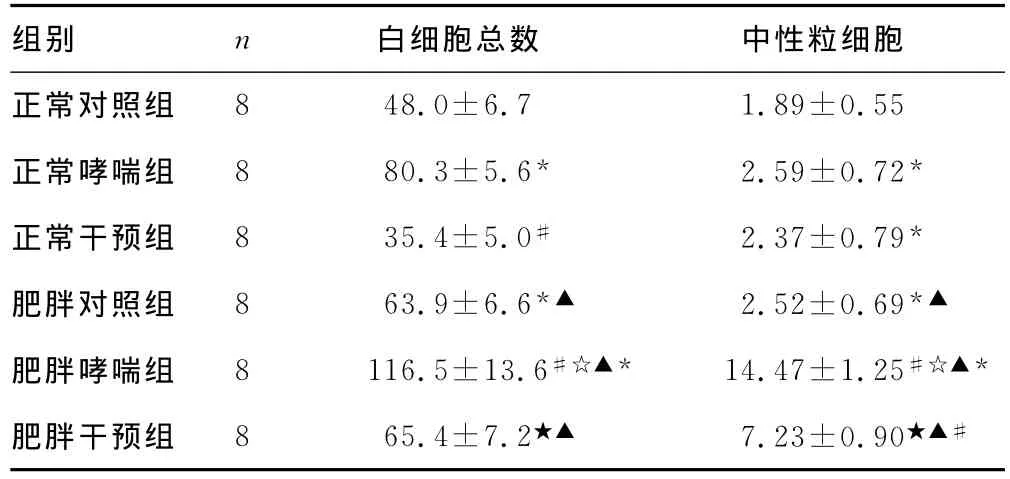
表1 各组大鼠BALF中白细胞总数和中性粒细胞计数的比较(±s,×104/mL)
*:P<0.05,与正常对照组比较;#:P<0.05,与正常哮喘组比较;▲:P<0.05,与正常干预组比较;☆:P<0.05,与肥胖对照组比较;★:P<0.05,与肥胖哮喘组比较。
组别 n 白细胞总数 中性粒细胞正常对照组8 48.0±6.7 1.89±0.55正常哮喘组 8 80.3±5.6* 2.59±0.72*正常干预组 8 35.4±5.0# 2.37±0.79*肥胖对照组 8 63.9±6.6*▲ 2.52±0.69*▲肥胖哮喘组 8 116.5±13.6#☆▲* 14.47±1.25#☆▲*肥胖干预组 8 65.4±7.2★▲ 7.23±0.90★▲#
2.4 各组大鼠肺组织瘦素蛋白表达、血清、BALF及细胞上清液中瘦素浓度的比较 血清和BALF及培养的ASMC上清液中瘦素浓度,肥胖哮喘组瘦素表达高于正常哮喘组,同时正常哮喘组和肥胖哮喘组分别高于正常对照组和肥胖对照组(P<0.05),正常干预组和肥胖干预组瘦素表达明显低于正常哮喘组和肥胖哮喘组(P<0.05)。见表2~3和图4~5。
表2 6组大鼠血清、BALF和细胞上清液中瘦素浓度的比较(±s,pg/mL)
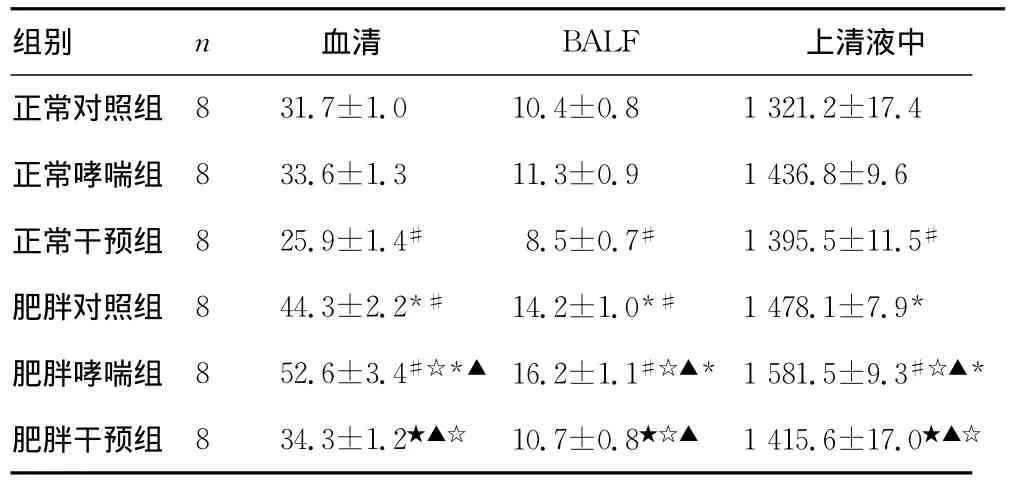
表2 6组大鼠血清、BALF和细胞上清液中瘦素浓度的比较(±s,pg/mL)
*:P<0.05,与正常对照组比较;#:P<0.05,与正常哮喘组比较;▲:P<0.05,与正常干预组比较;☆:P<0.05,与肥胖对照组比较;★:P<0.05,与肥胖哮喘组比较。
组别 n 血清 BALF 上清液中正常对照组8 31.7±1.0 10.4±0.8 1 321.2±17.4正常哮喘组 8 33.6±1.3 11.3±0.9 1 436.8±9.6正常干预组 8 25.9±1.4# 8.5±0.7# 1 395.5±11.5#肥胖对照组 8 44.3±2.2*# 14.2±1.0*# 1 478.1±7.9*肥胖哮喘组 8 52.6±3.4#☆*▲ 16.2±1.1#☆▲* 1 581.5±9.3#☆▲*肥胖干预组 8 34.3±1.2★▲☆ 10.7±0.8★☆▲ 1 415.6±17.0★▲☆
表3 6组大鼠肺组织及ASMC瘦素蛋白的表达(±s)

表3 6组大鼠肺组织及ASMC瘦素蛋白的表达(±s)
*:P<0.05,与正常对照组比较;#:P<0.05,与正常哮喘组比较;▲:P<0.05,与正常干预组比较;☆:P<0.05,与肥胖对照组比较;★;P<0.05,与肥胖哮喘组比较。
组别 n 肺组织ASMC正常对照组8 0.28±0.06 0.45±0.02正常哮喘组 8 0.47±0.02 0.57±0.07正常干预组 8 0.31±0.03# 0.49±0.06#肥胖对照组 8 0.41±0.05* 0.53±0.03*肥胖哮喘组 8 0.62±0.05#☆*▲ 0.72±0.05#☆*▲肥胖干预组 8 0.47±0.05★*▲ 0.56±0.05★*▲

图4 Western blot检测各组大鼠肺组织瘦素(Leptin)蛋白的表达(哮喘组大鼠Leptin蛋白表达增加,阿奇霉素干预后Leptin蛋白表达减少)

图5 Western blot检测大鼠ASMC内瘦素(leptin)蛋白的表达
3 讨 论
流行病学调查提示肥胖和超重可增加哮喘发生的危险性,《全球哮喘防治创议(GINA)》将肥胖列为支气管哮喘的独立危险因素。肥胖对哮喘的影响表现为脂肪组织可以分泌多种促炎因子如Leptin、肿瘤坏死因子-α、白细胞介素-6、肿瘤坏死因子-β1和C-反应蛋白,这些炎症因子都可以加重哮喘炎症的发生[7]。本研究结果显示,肥胖哮喘组BALF中白细胞总数及中性粒细胞数较单纯哮喘组增高,且HE切片显示前者炎症反应明显加重,气道及血管周围大量炎症细胞浸润更为明显,进一步支持肥胖加重了哮喘大鼠的肺部炎症反应。
肥胖患者脂肪组织分泌的炎症因子中,瘦素是这些致炎因子中的核心成员,瘦素在肥胖患者体内明显增加,而且是重要的炎症调节因子,其生物学效应是通过与相应的瘦素受体结合后发挥的。小鼠和人的肺泡和支气管上皮细胞均存在瘦素受体[8]。既往对哮喘的研究结果亦发现瘦素导致多种细胞因子、炎症介质增加以及气道反应性升高[9]。本研究结果发现,瘦素升高的大鼠肺组织表现出更为严重的炎症细胞浸润,这表明瘦素在哮喘的发生和发展中起重要作用;血清和BALF以及培养的大鼠ASMC中瘦素浓度均较肥胖对照组显著升高;而体质量正常哮喘组大鼠较正常对照组也有升高的趋势。研究表明瘦素能够促进哮喘气道炎症的发展,而气道炎症又引起瘦素产生的增加[10]。本研究表明,肥胖哮喘大鼠体内瘦素表达水平明显增加。
大环内酯类抗生素(macrolide antibiotics,MA)作用广泛,除具有良好的抗菌活性外,还表现出较强的非特异性抗炎平喘、免疫调节等非抗菌作用[11]。目前,已有MA作用于气道炎症性疾病的研究[12]。阿奇霉素是新型大环内酯类抗生素,抗菌谱广,半衰期长达2~3d,有明显的抗生素后反应。Beigelman等[13-14]研究发现,阿奇霉素可减轻纤维囊性变小鼠中性粒细胞的浸润并抑制多种细胞因子的释放,如白细胞介素-8、肿瘤坏死因子-α等,具有类激素样抗炎活性。Beigelman等[14]研究发现阿奇霉素可以减轻非感染的哮喘小鼠气道炎症反应,抑制了BALF内炎症细胞因子和趋化因子的表达,如白细胞介素-13、白介素-5等;减轻了黏液细胞的化生。有研究表明瘦素可以调节血小板衍化生长因子诱导的人ASMC的迁移和增殖以及白细胞介素-13诱导的嗜酸性粒细胞趋化因子的产生[15]。阿奇霉素可以抑制ASMC的增殖,还可以松弛ASMC的紧张性[16-17]。本研究也发现,阿奇霉素干预后,肥胖哮喘大鼠BALF和血清中细胞总数和中性粒细胞数减少,瘦素表达与正常对照组比较明显减低,大鼠气道炎症反应减轻。同时本研究发现,阿奇霉素减少了细胞上清液中瘦素的表达。
本研究发现,肥胖哮喘大鼠瘦素表达增加,阿奇霉素干预后瘦素表达减少,从而为肥胖相关的难治性哮喘提供理论依据,但阿奇霉素是否可以用于哮喘等炎症性疾病的治疗,缓解肥胖哮喘的临床症状,有待进一步研究。
[1]Omar T,Yassine A,Reynold A,et al.Is airway smooth muscle the“Missing Link”modulating airway inflammation in asthma[J].Chest,2008,133(1):236-242.
[2]Shore SA.Obesity and asthma:possible mechanisms[J].J Allergy Clin Immunol,2008,121(5):1087-1093.
[3]Beuther DA,Weiss ST,Sutherland ER.Obesity and asthma[J].Am J Respir Crit Care Med,2006,174(2):112-119.
[4]Hahn DL.Macrolide therapy in asthma:limited treatment,long-term improvement[J].Eur Respir J,2009,33(1):171-181.
[5]Mito N,Kitada C,Hosoda T,et al.Effect of diet-induced obesity on ovalbumin-specific immune response in a murine asthma model[J].Metabolism,2002,51(10):1241-1246.
[6]Palmans E,Pauwels RA,Kips JC.Repeated allergen exposure changes collagen composition in airways of sensitised Brown Norway rats[J].J Eur Respir J,2002,20(2):280-285.
[7]Mclachlan CR,Poulton R,Car G,et al.Adiposity,asthma,and airway inflammation[J].J Allergy Clin Immunol,2007,119(3):634-639.
[8]Johnston RA,Theman TA,Terry RD,et al.Pulmonary responses to acute ozone exposure in fasted mice:effect of leptin administration[J].J Appl Physiol,2007,102(1):149-156.
[9]Johnston RA,Theman TA,Terry RD,et al.Pulmonary responses to acute ozone exposure in fasted mice:effect of leptin administration[J].J Appl Physiol,2007,102(1):149-156.
[10]Cao J,Chen JH,Zhu SY.Effects of leptin on airway-inflammation and the expression of Th1/Th2cytokines in asthma rats[J].Chin J Tuberc Resp Dis,2009,32(3):171-176.
[11]Idris SF,Chilvers ER,Haworth C,et al.Azithromycin therapy for neutrophilic airways disease:myth or magic[J].Thorax,2009,64(3):186-189.
[12]Legssyer R,Huaux F,Lebacq J.Azithromycin reduces spontaneous and induced inflammation in Della F508 cystic fibrosis mice[J].Respir Res,2006,7:134.
[13]Beigelman A,Gunsten S,Mikols CL,et al.Azithromycin attenuates airway inflammation in a noninfectious mouse model of allergic asthma[J].Chest,2009,136(2):498-506.
[14]Bruno A,Pace E,Chanez P,et al.Leptin and leptin receptor expression in asthma[J].J Allergy Clin Immunol,2009,124(2):230-237.
[15]Nair P,Radford K,Fanat A,et al.The effects of leptin on airway smooth muscle responses[J].Am J Respir Cell Mol Biol,2008,39(4):475-481.
[16]Vanaudenaerde BM,Wuyts WA,Geudens N,et al.Macrolides inhibit IL17-induced IL8and 8-isoprostane release from human airway smooth muscle cells[J].Am J Transplant,2007,7(1):76-82.
[17]Zuyderduyn S,Sukkar MB,Fust A.Treating asthma means treating airway smooth muscle cells[J].Eur Respir J,2008,32(2):265-274.
