城市生活垃圾可生物降解组分动态水解研究
2013-03-04何品晶张宗兴
何品晶,张宗兴,吴 铎,吕 凡
(1.同济大学 环境科学与工程学院,上海200092;2.同济大学 固体废物处理与资源化研究所,上海200092)
随着社会经济的快速发展,我国城市生活垃圾的产量不断提高,2009年我国城市生活垃圾总清运量达1.57亿t[1],引起人们的广泛关注.我国城市生活垃圾中,餐厨垃圾、果蔬垃圾等可生物降解组分(OFMSW)仍是其中最主要的组成部分[2],这些组分具有含水率高(70%~80%),低位热值较低(3 300~4 600kJ·kg-1),结构强度低等特点[3-4].而厌氧消化技术在处理此类废物方面具有可回收能源气体甲烷、产物可以用作有机肥料或土壤改良剂、二次污染少、温室气体排放量小等优势[2-5].因此,采用厌氧消化技术处理城市生活垃圾可生物降解组分是一种相对理想的处理方式.
有机物的厌氧消化包括水解、酸化、乙酸化和甲烷化4个阶段[6].Park等人[7]的研究表明,在废物的厌氧降解过程中,颗粒态生物质的水解是限制整体反应速率的重要因素.因此,提高水解速率对于加快OFMSW的厌氧消化处理效率有重要意义.影响水解速率的因素包括物料的粒径、混合程度以及水解环境中的微生物量等.Palmowski和 Müller[8]研究了破碎预处理对于有机废物的水解和降解速率的影响,证明了破碎可以加快有机物特别是不易降解有机物的水解速率,但破碎预处理会增加运行能耗.反应器中底物的混合程度对于有机废物的水解程度和速率也有很大影响[9],通常将在水解过程中通过反应器整体翻转或通过内部搅拌以促进反应器内混合效果的工艺称为“动态水解工艺”,而没有混合的工艺称为“静态水解工艺”.反应器翻转和内部搅拌都可以提高物料的混合程度,从而增加底物与微生物的反应接触面积,加快底物的水解速率;相对于内部搅拌,反应器翻转不需要内部的搅拌设备,对于物料的容杂率更高,且更易于检修维护.Chen等人[10]的研究证明,在两相厌氧消化过程中,将甲烷化出水循环至水解反应器可以提高水解效率.郝丽萍等人[11]的研究发现,水解效率与循环至水解反应器中的甲烷化出水循环量呈正相关,且甲烷化出水循环量的增加有利于提高水解环境中的微生物量.因此,采用甲烷化出水环境下动态水解工艺来处理OFMSW有望提高水解效率,但需评估破碎预处理的必要性,以及对动态水解工艺的运行参数进行优化,并评估其运行能耗.
本文通过动态水解批式实验,研究破碎、翻转和甲烷化出水对于OFMSW水解过程的影响,探明处理过程的调控规律,达到过程低能耗和高水解程度的平衡.
1 材料与方法
1.1 实验材料
城市生活垃圾取自夏季上海某居民小区的垃圾混合收集点.共取样2次,每次(50±2)kg.取回的样品经四分法和人工分拣后,其中的可生物降解组分(餐厨果蔬垃圾及少量园林垃圾和纸巾)置于-4°C冰箱中冷冻保存.其TS(总固体质量)为12.3%,VS(挥发性固体含量)占TS的88.5%.甲烷化出水来源于实验室的UASB反应器,此反应器的初始接种微生物为上海某造纸厂的厌氧IC反应器的颗粒污泥,在(35±2)°C条件下以COD(化学需氧量)比为2∶1的葡萄糖和乙酸钠混合溶液进行培养,COD负荷为2g·(L·d)-1,调节进水碱度为2 500mg·L-1(以CaCO3计).稳定运行100d以上.甲烷化出水的TOC(总有机碳)质量浓度<200mg·L-1,pH值为7.8±0.5.
1.2 实验设计
1.2.1 破碎及水解缓冲液的影响研究
动态水解批式实验在2L带旋盖聚乙烯瓶中进行,共进行96h,底物分为未破碎OFMSW(人工分拣后原始样品,记为MSW)和破碎后的OFMSW(将城市生活垃圾可生物降解组分样品用小型破碎机破碎至浆状,记为HMSW),分别用甲烷化出水(模拟两相厌氧消化甲烷化反应器循环回流,记为ME)和蒸馏水(作为空白参比,记为 W)作为水解缓冲液本底环境(缓冲液),共建立4个工况,分别记为MSWW,HMSW-W,MSW-ME和 HMSW-ME.每个工况的总体积为600mL,含固率用缓冲液调至10%,固定于转速为20r·min-1的翻转摇床(实验室自制)上,分别于第6,24,30,48,72,96h取液体样2mL,监测水解液pH和TOC.翻转摇床额定功率180W,最大转速72r·min-1,共可同时翻转12个2L带旋盖聚乙烯瓶.另添加一个工况,不进行翻转,作为操作方式空白参比工况,记为S-MSW-ME,以甲烷化出水作为缓冲液,在第24,48,72,96h取液体样,同样测定TOC.96h完毕后,以3 000r·min-1离心,测定残余固体质量.
1.2.2 缓冲液置换频率的影响研究
取未破碎的城市生活垃圾组分样品置于2L带旋盖聚乙烯瓶中,添加甲烷化出水调节含固率至10%,总体积为600mL.固定于转速为20r·min-1的翻转摇床,监测水解液pH,TOC,TN(总氮),VFAs(有机酸)和α-淀粉酶活性变化.每12,24和48 h分别进行置换操作,共建立3个工况,分别记为MSW-12h,MSW-24h和 MSW-48h.共分别置换2次,各自运行3个周期,总运行时间分别为36,72和144h.进行缓冲液置换操作时,以3 000r·min-1离心,弃去上清液,测定残余固体质量,之后再添加与初始状态相同体积的甲烷化出水,并继续进行翻转.
1.3 分析方法
pH用数字pH计(pHS-2F,上海精密科学仪器有限公司)进行测定.液体样品稀释50倍后,用0.45 μm滤膜过滤后测定总有机碳、总氮(TOC-V,SHIMADZU, 日 本 ) 和 有 机 酸 (HPLC,SHIMADZU,日本).由3.5-二硝基水杨酸(DNS)比色法分析测定(752紫外光栅分光光度计,上海精密科学仪器有限公司)α-淀粉酶活性.固体样品的总固体质量由70°C烘箱烘48h后测得,挥发性固体含量经马弗炉600°C灼烧2h后测得,残余固体质量由电子分析天平(HANGPING FA2004型,上海精科天平仪器厂)测得.
2 结果和分析
2.1 破碎、翻转、水解缓冲液的影响
图1显示的是96hOFMSW不翻转的静态水解和进行翻转的动态水解不同缓冲液未破碎和破碎预处理工况下的累积TOC质量浓度.在实验开始24 h之内,甲烷化出水缓冲液的两个工况的累积TOC质量浓度已达峰值,分别为15.2g·L-1(HMSWME)和13.6g·L-1(MSW-ME).而蒸馏水作为缓冲液时,TOC质量浓度到48h才达到峰值,分别为14.9g·L-1(HMSW-W)和14.0g·L-1(MSWW),说明甲烷化出水可以更快地启动OFMSW的水解过程.破碎工况和未破碎工况的TOC峰值相差不大.有研究表明,在pH不受控制的情况下,大量水解产生的VFAs会使水解过程受到抑制;同时水解产物被微生物继续降解转化为气体以及被微生物利用进行自我合成,会导致水解液TOC质量浓度在达到峰值之后逐渐降低[12-13].

图1 96hOFMSW静态水解和动态水解不同缓冲液未破碎和破碎预处理工况下的累积TOC质量浓度Fig.1 Temporal TOC evaluation in 96hstatic and dynamic hydrolysis of OFMSW with or without homogenization pretreatment under different buffers
图2中显示的是96hOFMSW动态水解不同缓冲液未破碎和破碎预处理工况下的pH值.可以看出,各工况pH值在24h内均迅速下降至最低值,分别为4.99(HMSW-ME)、4.60(HMSW-W)、4.97(MSW-ME)和4.33(MSW-W);虽然由于有机酸被部分利用而使得pH值缓慢回升,但最终pH值都保持在6.5以下.且总体上看,甲烷化出水工况下pH值比蒸馏水工况下pH值要高,说明了甲烷化出水工况有较强的缓冲能力.
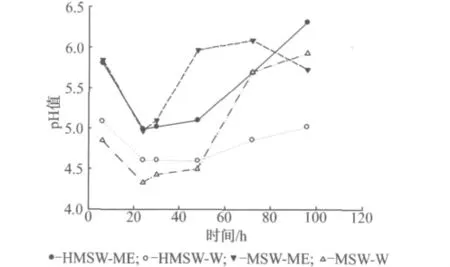
图2 96hOFMSW动态水解不同缓冲液未破碎和破碎预处理工况下的pH值Fig.2 pH evaluation in 96hdynamic hydrolysis of OFMSW with or without homogenization pretreatment under different buffers
2.2 缓冲液置换频率的影响
在96h的水解实验中,TOC迅速累积可能导致了水解过程的产物抑制,使得OFMSW的水解不能顺利进行.缓冲液置换操作既能及时利用水解液,又可使得产物抑制得到解除.因此,选择合适的置换操作频率对于动态水解工艺的高效运行是有益的.同时由于OFMSW中含有大量糖类物质,因此选择α-淀粉酶活性来表征水解液中微生物的活性.
图3显示的是以12,24和48h为缓冲液置换间隔操作工况下的TOC质量浓度.缓冲液置换后,含有大量TOC和很高活性水解酶的水解液被甲烷化出水替换.可以发现,第1次置换后,液相TOC质量浓度为第1次置换前的50%左右,第2次置换之后,液相TOC质量浓度为第1次置换前的20%左右.每次置换操作后6h内,各工况的TOC质量浓度都有很大程度的提高,但6h后,各工况累积TOC质量浓度便基本不再增长,说明可降解组分的水解受到了抑制.第2次置换12h后,24h和48h置换操作工况的TOC质量浓度都有了一定程度的提高,可降解组分的水解又开始进行.从总体来看,12,24和48 h置换工况下的累积TOC质量浓度峰值都出现在6 h,分别为9.857,9.850和9.865g·L-1.
水解液中有机酸组分主要由乳酸和VFAs(乙酸、丙酸、异丁酸、正丁酸、异戊酸、正戊酸等)组成.张波等人[14]的研究表明,在未调控pH的情况下,乳酸浓度可以占餐厨垃圾水解液TOC质量浓度的40%.经实验测定,各工况VFAs的质量浓度大约占水解液TOC质量浓度的8%~15%,最高可达1.5g·L-1(以碳计).Killilea[15]的研究表明,当 VFAs的质量浓度在100~200mg·L-1时,就要对厌氧过程进行严格监控,以防止其抑制有机物的水解和后续的甲烷化过程.尤其对于OFMSW这类可溶性有机物含量高的废物,当VFAs的产生速率大于甲烷的产生速率时,更容易由于VFAs积累而造成产物抑制.综上所述,可以认为实验中有机酸的产生对可降解组分的水解造成了一定程度的抑制.
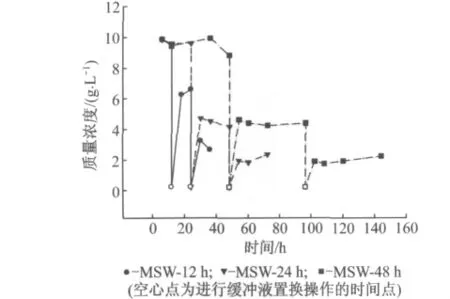
图3 12,24,48h为缓冲液置换间隔操作工况下的累积TOC质量浓度Fig.3 Temporal TOC evaluation in scenarios with hydrolysate replacement frequencies of 12,24 and 48h

图4 12,24,48h为缓冲液置换间隔操作工况下的TN质量浓度Fig.4 TN evaluation in scenarios with hydrolysate replacement frequencies of 12,24and 48h
图4显示的是以12,24和48h为缓冲液置换间隔操作工况下的TN质量浓度.可以看出,不同工况下的累积TN峰值都出现在第1次置换操作之前(即12,24,48h),分别为619,754和756mg·L-1.根据文献报道,分子态氨对微生物的毒性较高,根据氨的解离常数(9.33,25°C)计算,当环境中氨氮质量浓度达到1.2g·L-1左右时,若pH为碱性水解液中的分子态氨会对水解造成抑制[6,16].而在本实验的TN质量浓度峰值都出现在酸性pH条件下(pH<6.0),基本无分子态氨形成.且由于缓冲液置换操作,实验水解环境中的氨氮质量浓度远小于文献中的抑制浓度,因此氨氮造成抑制的可能性很小.
图5显示的是12,24,48h为缓冲液置换间隔操作工况下水解液的pH值.TOC累积和pH下降之间存在正相关.由于每次置换之后水解液的TOC质量浓度均显著下降,因此水解液pH也随着缓冲液置换而升高.第1次置换后,12h置换间隔工况的pH值低于24h和48h置换间隔工况,并且继续下降.而其他2个工况的pH相似均为7.0左右,但置换频率48h的工况置换24h之后pH再次下降,即降解继续进行,在置换前已与置换频率12h工况的水解液pH接近.第2次置换之后12h内,3个工况的pH都保持在7.5左右;12h后pH会再次下降,但下降速率小于置换后前6h的下降速率.
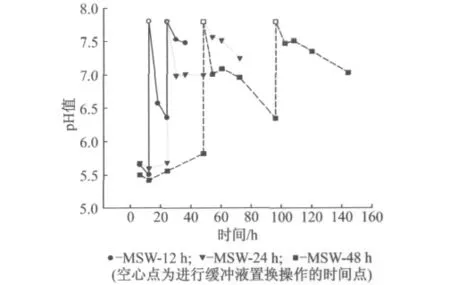
图5 12,24,48h为缓冲液置换间隔操作工况下的pH值Fig.5 pH evaluation in scenarios with hydrolysate replacement frequencies of 12,24and 48h
图6显示的是上述各工况下水解液的α-淀粉酶活性(以麦芽糖计).缓冲液置换之前,水解液的α-淀粉酶活性保持不变甚至逐渐下降,可能是由于可降解组分中淀粉含量减少,同时微生物活性受到抑制的缘故.缓冲液置换之后,各工况下的水解液α-淀粉酶活性均显著降低,随后又不同程度地回升.这一现象证明了残余固体的可降解性降低,且此时有机酸的释放速率降低,含量降至TOC质量浓度的10%以下,即不再造成之前的产物抑制.

图6 12,24,48h为缓冲液置换间隔操作工况下的α-淀粉酶活性(以麦芽糖计)Fig.6 α-amylase activity in scenarios with hydrolysate replacement frequencies of 12,24and 48h(calculated by Maltose)
3 讨论
固体减重率可作为评价水解效果的重要指标[17].表1是96h动态水解各工况下残余固体质量的结果对比,甲烷化出水条件下未破碎OFMSW的水解工况残余质量最低,96h之内的减重率达到了42.7%,比不进行翻转的对照工况提高了91.5%,从另一方面说明翻转操作提高了水解效率.结合之前TOC质量浓度的变化趋势,可以推测,虽然对物料进行破碎和采用甲烷化出水作为缓冲液均有助于水解过程的进行,但破碎之后水解产物尤其是有机酸的过快释放反而会对水解过程造成产物抑制.同时,破碎操作需要额外地增加能耗.因此,在OFMSW动态水解工艺中,并不推荐进行破碎操作.

表1 96hOFMSW动态水解不同缓冲液未破碎和破碎预处理工况下残余固体质量的对比(干重)Tab.1 Comparison of weight loss rate(dry weight)in 96hdynamic hydrolysis with and without homogenization pretreatment under different buffers
表2是12,24,48h为缓冲液置换间隔操作工况下的每次置换前后固体质量的对比.经过2次置换,总共3个周期的操作,每12h置换的工况,最终的减重率为42.5%,相应地每24h和48h置换工况的减重率分别为47.7%和59.8%,较每12h置换的工况提高了11.5%和40.7%.表3是12,24,48h为置换间隔操作工况下翻转能耗的对比,从表中可以看出,每24h和48h置换的工况能耗分别比每12h置换的工况高100%和300%.结合表2和表3,从能耗角度来看,即使能获得较高的最终减重率,选取24h和48h作为缓冲液置换时间的间隔也是不恰当的.
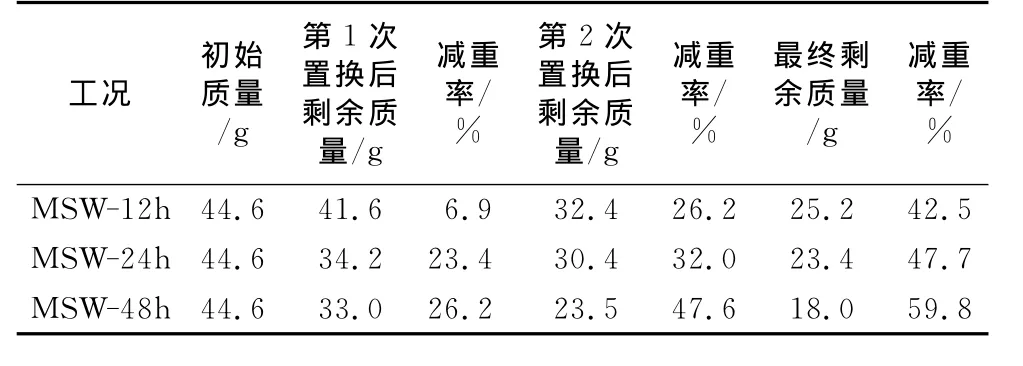
表2 12,24,48h为缓冲液置换间隔操作工况下的置换前后固体质量的对比(干重)Tab.2 Comparison of the residual mass(dry weight)in scenarios with hydrolysate replacement frequencies of 12,24and 48h
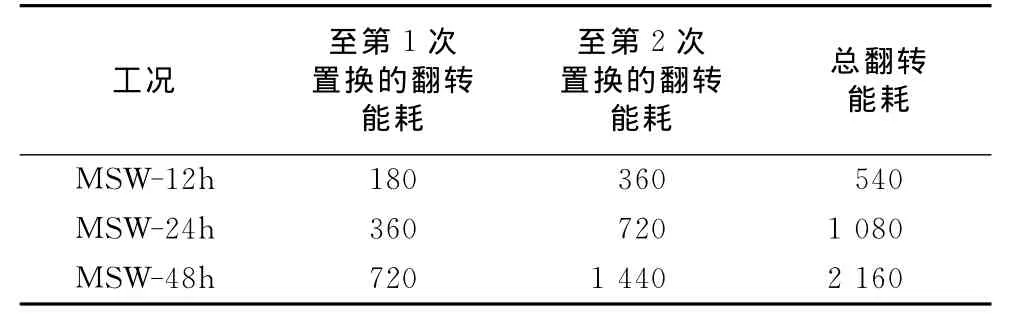
表3 12,24,48h为缓冲液置换间隔操作工况下翻转能耗的对比Tab.3 Comparison of energy consumption in scenarios with hydrolysate replacement frequencies of 12,24and 48h kJ
在水解过程中,水解液中高浓度的有机酸会对水解过程 造 成 产 物 抑 制[12-13,18].在 本 实 验 中 第 1 次缓冲液置换操作前TOC质量浓度的不再上升和淀粉酶活性的下降也证明了这一点.在水解的同时,水解液中的部分有机物在缺氧的环境下被降解为气体,降低了后续进入甲烷化过程可回收能源的有机碳量.因此,增加缓冲液置换频率、降低每个置换周期的时间对于更高效的资源化利用同样是有利的.
本实验的动态水解是在旋盖聚乙烯塑料瓶中进行的,塑料瓶内部并无任何辅助混合装置,仅靠反应器整体在翻转摇床中进行翻转混合.动态水解工艺在反应器的设计上十分简单,能获得很好的混合效果,并且在批式处理中容易实现固液分离,具有良好的应用前景.
4 结论
动态翻转混合对OFMSW的水解有明显的促进作用.由于其中存在的微生物和较高的缓冲能力,甲烷化出水适合作为OFMSW的动态水解缓冲液.对OFMSW进行破碎理论上能促进水解,但会使得有机酸过快释放,易对OFMSW的水解过程造成抑制.因此,不推荐破碎预处理.动态水解液的TOC质量浓度在水解6h之后达到峰值,随后缓慢下降.缓冲液置换操作一定程度上可解除高浓度有机酸的产物抑制,比较不同置换频率工况,虽然每24h和48h的置换工况比起每12h的置换工况所得到的OFMSW减重率分别高出11.5%和40.7%,但能耗也相应增加了100%和300%.增加水解时间的同时,液相的有机碳会转化为气相的CO2和CH4,使得进入甲烷化相的有机碳减少,不利于有机碳的资源利用.因此,缓冲液置换频率在12h左右为最佳.动态水解工艺能显著提高OFMSW的水解效率,其反应器的设计简单,因此具有良好的应用前景.
[1] 中华人民共和国国家统计局.中国城市建设统计年鉴2009[M].北京:中国计划出版社,2010.National Bureau of Statistics of People’s Repubic of China.China urban construction statistical yearbook 2009 [M].Beijing:China Planning Press,2010.
[2] 吕凡,何品晶,邵立明,等.易腐性有机垃圾的产生与处理技术途径比较[J].环境污染治理技术与设备,2003,4(8):46.LÜFan,HE Pinjing,SHAO Liming,et al.Generation and treatment technologies of putrescible wastes[J].Techniques and Equipment for Environmental Pollution Control,2003,4(8):46.
[3] Ludwig C,Hellweg S,Stucki S. Municipal solid waste management[M].Berlin:Springer-Verlag,2002.
[4] 何品晶,邵立明.固体废物管理[M].北京:高等教育出版社,2004.HE Pinjing,SHAO Liming.Solid waste management[M].Beijing:Higher Education Press,2004.
[5] Rao M S,Singh S P,Singh A K,et al.Bioenergy conversion studies of the organic fraction of MSW:assessment of ultimate bioenergy production potential of municipal garbage[J].Applied Energy,2000,66(1):75.
[6] Mata-Alvarez J,Mace S,Llabres P.Anaerobic digestion of organic solid wastes:an overview of research achievements and perspectives[J].Bioresource Technology,2000,74(1):3.
[7] Park C,Lee C,Kim S,et al.Upgrading of anaerobic digestion by incorporating two different hydrolysis processes[J].Journal of Bioscience and Bioengineering,2005,100(2):164.
[8] Palmowski L M,Müller J A.Anaerobic degradation of organic materials:significance of the substrate surface area[J].Water Science and Technology,2003:231.
[9] Stroot P G,Mcmahon K D,Mackie R I,et al.Anaerobic codigestion of municipal solid waste and biosolids under various mixing conditions—I.digester performance [J]. Water Research,2001,35(7):1804.
[10] Chen L,Jiang W Z,Kitamura Y,et al.Enhancement of hydrolysis and acidification of solid organic waste by a rotational drum fermentation system with methanogenic leachate recirculation[J].Bioresource Technology,2007,98(11):2194.
[11] 郝丽萍,吕凡,何品晶,等.甲烷化出水循环量对固体废物厌氧水解的影响[J].环境科学,2008,29(9):2637.HAO Liping,LU Fan,HE Pinjing,et al.Impact of liquid volume of recycled methanogenic effluent on anaerobic hydrolysis[J].Environmental Science,2008,29(9):2637.
[12] 何品晶,潘修疆,吕凡,等.pH值对有机垃圾厌氧水解和酸化速率的影响[J].中国环境科学,2006,26(1):57.HE Pinjing,Pan Xiujiang,LU Fan,et al.The influence of pH value on anaerobic hydrolysis and acidogenesis rates of biodegradable organic waste[J].China Environmental Science,2006,26(1):57.
[13] Zhang B,Zhang L L,Zhang S C,et al.The influence of pH on hydrolysis and acidogenesis of kitchen wastes in two-phase anaerobic digestion[J].Environmental Technology,2005,26(3):329.
[14] 张波,何品晶,邵立明.城市生活垃圾的厌氧消化处理现状和研究进展[J].环境科学,2007,28(4):881.ZHANG Bo,HE Pinjing,SHAO Liming.Effect of pH and fermentation time on yield and optical purity of lactic acid from kitchen wastes fermentation[J].Environmental Science,2007,28(4):881.
[15] Killilea J E,Colleran E,Scahill C.Establishing procedures for design,operation and maintenance of sewage sludge anaerobic treatment plants[J].Water Science and Technology,2000,41(3):305.
[16] Chen Y,Cheng J J,Creamer K S.Inhibition of anaerobic digestion process:a review[J].Bioresource Technology,2008,99(10):4044.
[17] Hartmann H,Ahring B K.Strategies for the anaerobic digestion of the organic fraction of municipal solid waste:an overview[J].Water Science and Technology,2006,53(8):7.
[18] Siegert I,Banks C.The effect of volatile fatty acid additions on the anaerobic digestion of cellulose and glucose in batch reactors[J].Process Biochemistry,2005,40(11):3412.
