1 028例医疗器械不良事件报告的回顾性分析
2013-03-04曹韵波高林贵阳市药品不良反应监测中心贵阳市550002
曹韵波,高林贵阳市药品不良反应监测中心,贵阳市, 550002
【 Writers 】Cao Yunbo, Gao Lin Guiyang center for ADR monitoring, Guiyang, 550002
1 028例医疗器械不良事件报告的回顾性分析
【作 者】曹韵波,高林贵阳市药品不良反应监测中心,贵阳市, 550002
目的 对1 028例医疗器械不良事件发生的特点及规律进行统计分析,为医疗器械不良事件监测工作提供建议。方法 采用回顾性分析方法,对贵阳市2012年收集的1 028例医疗器械不良事件报告进行综合分析。结果 宫内节育器引起的严重不良事件所占比例较高。基层用户上报意识有待提高。医疗器械不良事件报告质量有待提高。结论 加强宫内节育器的监测。从开展有针对性的宣传培训、建立健全医疗器械不良事件监测网络两方面提高不良事件监测工作水平。
医疗器械;不良事件;分析;监测
医疗器械不良事件监测是持续、系统地对已上市医疗器械发生的可疑不良事件进行发现、报告、评价和控制的过程[1],是对上市医疗器械安全性监测管理的重要手段和措施。我国医疗器械不良事件监测工作起步较晚、基础薄弱,监测体系的构建也刚起步不久,全国大部分地区尚处于初期的监测框架建设阶段[2]。2012年我市开始启用新开通的“国家药品不良反应监测系统”,要求生产企业、经营企业和医疗机构注册为基层用户开展在线上报监测工作,全市监测工作得到了有效推动,全年共收集可疑医疗器械不良事件1 028例。为了解我市医疗器械不良事件监测的整体情况,进一步夯实医疗器械不良事件监测工作,发现监测工作中存在的问题,并为尚处于初级监测阶段的省(市)提供不良事件监测的信息和改进思路,现就贵阳市药品不良反应监测中心收到的1 028例有效可疑医疗器械不良事件监测报告进行回顾性分析。
1 资料与方法
1.1资料与来源
2012年贵阳市共收到可疑医疗器械不良事件报告1 060例,由“国家药品不良反应监测系统”导出数据,经审核评价,符合要求的有效报告为1 028例。
1.2分析方法
通过回顾性分析方法,对不良事件涉及的报告来源、患者特征、医疗器械分类和数量、不良事件主要表现、不良事件的发生原因进行统计和分析。
2 结果
2.1基层用户注册及上报情况
2012年贵阳市医疗器械不良事件监测注册基层用户共2 422家。其中医疗器械生产企业30家,经营企业1 264家,使用单位1 128家。在全部注册基层用户中,提交过报告的单位数量为391家,占总注册用户数的16.14%;另外,三类性质基层用户上报单位数占注册数的比例均未突破20%,反映了超过80%的基层用户尚未突破零报告(表1)。
2.2报告来源
2012年贵阳市1 028例可疑医疗器械不良事件报告中,使用单位上报785份,占报告总数的76.36%;经营企业上报237份,占报告总数的23.05%;生产企业上报6份,占报告总数的0.58%。

表1 基层用户注册和上报情况统计Tab.1 Statistic of registration and reporting of grassroots users
2.3患者年龄
涉及患者年龄分布方面,(21~30)岁年龄段患者比例最高,占17.8% ,其次为大于60岁年龄段,占17.6%(表2)。可以看出,医疗器械在使用发生不良事件时,患者主要集中分布在(21~30)岁的青年和60岁以上的高龄人群身上。

表2 1 028例可疑医疗器械不良事件报告年龄统计表Tab.2 Statistic of age of 1 028 adverse events of medical device reports
2.4器械分类
1 028例医疗器械不良事件报告中,涉及I类医疗器械的有252例,占24.51%,II类医疗器械有431例,占41.93%,Ⅲ类医疗器械有345份,占33.56%。II类与Ⅲ类医疗器械比重均较往年有一定提高,表明对我市对高风险医疗器械的监测力度有所提高。
2.5操作人员
操作人员是专业人员有769名,占总数的74.80%;患者自己操作的有181名,占总数的17.60%;操作人员是其他的有37名,占总数的3.59%;操作人员是非专业人员的有20名,占总数的1.94%;未填写操作人员的报告有21份,占总数的2.04%。
2.6事件后果
从1 028例报告的事件后果来分析,选择“其他”的有912例,选择“需要内外科治疗避免永久损伤”的有110例,选择“可能导致机体功能结构永久性损伤”的有5例,选择“危及生命”的有1例,无“死亡”病例。其中“需要内外科治疗避免永久损伤”的医疗器械主要为宫内节育器、接骨板、中频治疗仪,“可能导致机体功能结构永久性损伤”的医疗器械主要为鼻咬骨钳和一次性使用输液器。
2.7初步原因分析
通过汇总统计发现,在1 028例医疗器械不良事件中,由于产品质量问题、患者自身原因或操作不当引发的不良事件占到全部的44.5%。其中,由产品质量问题引发的不良事件有28例,由于患者个体差异产生过敏反应的事件有410例,患者对医疗器械产生排异反应的有11例,由于医疗器械操作不当引起的事件有8例。
2.8发生不良事件的医疗器械产品及不良事件主要表现
此次分析的1 028例不良事件报告中,医用高分子材料及制品、植入材料和人工器官、普通诊察器械、注射穿刺器械、医用卫生材料等种类发生数量较多,现就其产品类别、不良事件主要表现等问题做了详细统计。
2.8.1 报告前十位的医疗器械
1 028例可疑医疗器械不良事件报告前十位的医疗器械产品中,III类医疗器械占50.23%,II类占27.98%,I类占21.79%,涉及II、III类医疗器械的报告是构成主体,这与医疗器械风险程度的高低基本吻合。
其中排前三位的分别是一次性使用输液器、理疗贴、一次性使用无菌注射器,共占所有报告数量的21.5%,这与它们在临床上的使用范围广,用量大有直接的关系(表3)。
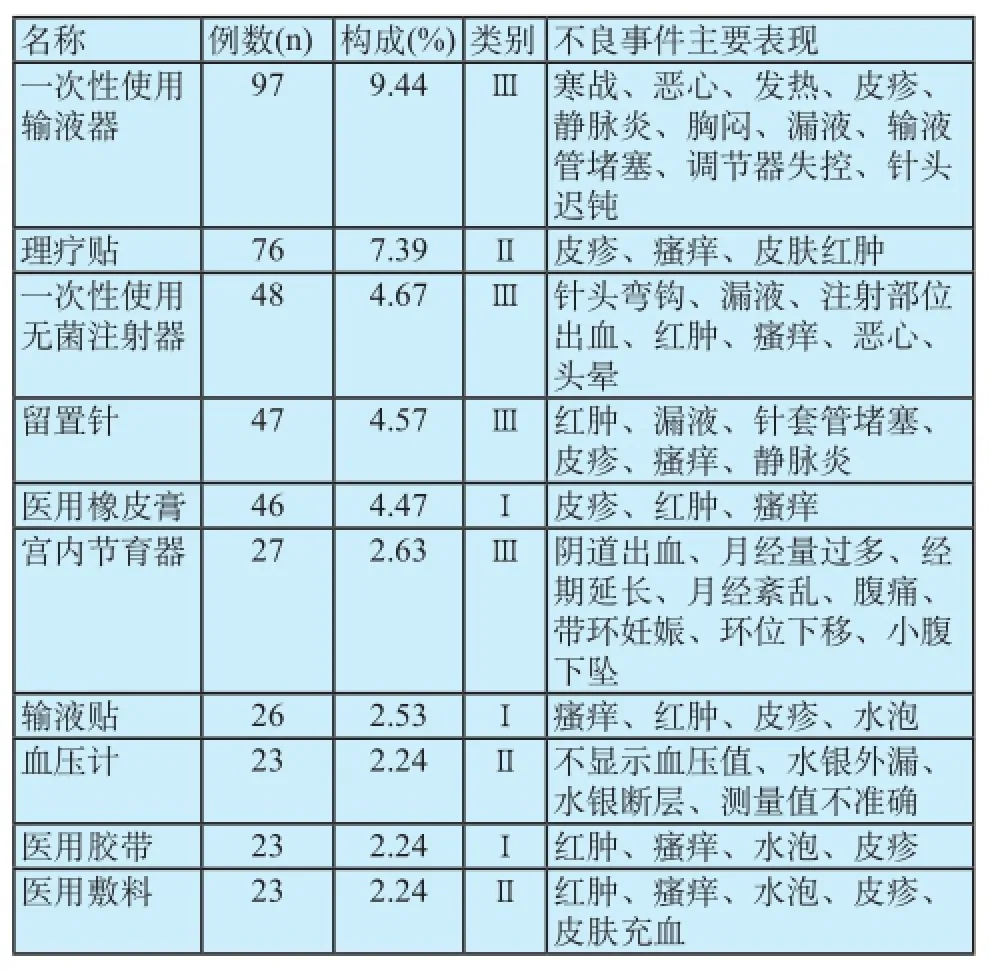
表3 不良事件数量前十位的医疗器械Tab.3 Medical device with adverse events
2.8.2 严重伤害前五位的医疗器械
在116例事件后果为严重伤害的前五位医疗器械产品中,Ⅰ类医疗器械没有涉及,Ⅱ类医疗器械占27.08%,Ⅲ类医疗器械占72.92%,涉及Ⅱ、Ⅲ类医疗器械的报告仍然是构成主体。
其中宫内节育器导致的严重伤害不良事件22例,占严重伤害前五位数量的45.83%,并占所有报告数量的2.14%;同时在严重伤害的医疗器械中仅有该品种上报例数达到两位数,其主要表现是阴道出血、月经紊乱、腹痛、带环妊娠、小腹下坠(表4)。
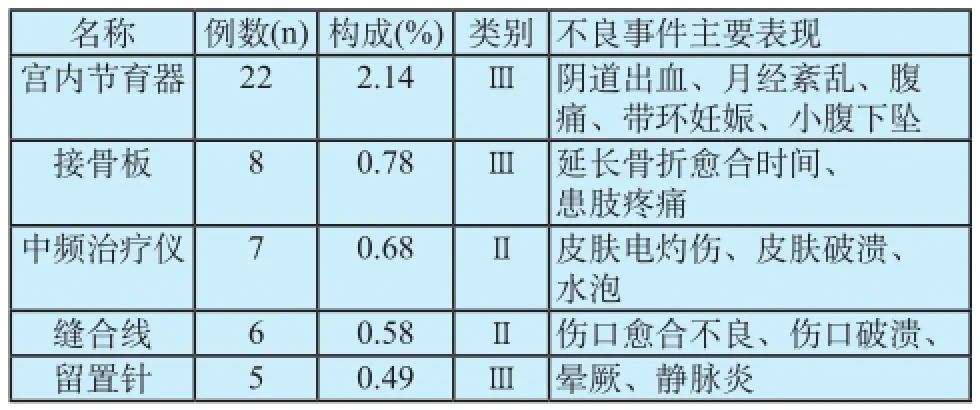
表4 严重伤害不良事件前五位的医疗器械Tab.4 Medical device with adverse events of serious degree
2.8.3 重点监测品种
根据国家食品药品监督管理局2011和2012年公布的14个医疗器械重点监测品种,我市涉及医疗器械重点监测的14个品种报告共占报告总数的6.42%,重点监测品种上报的覆盖率为64.2%,含5个零报告品种,其中有3个品种报告数量达到两位数;涉及严重伤害的重点品种报告例数共为27例,仅有TCu380A宫内节育器报告例数达两位数(表5)。
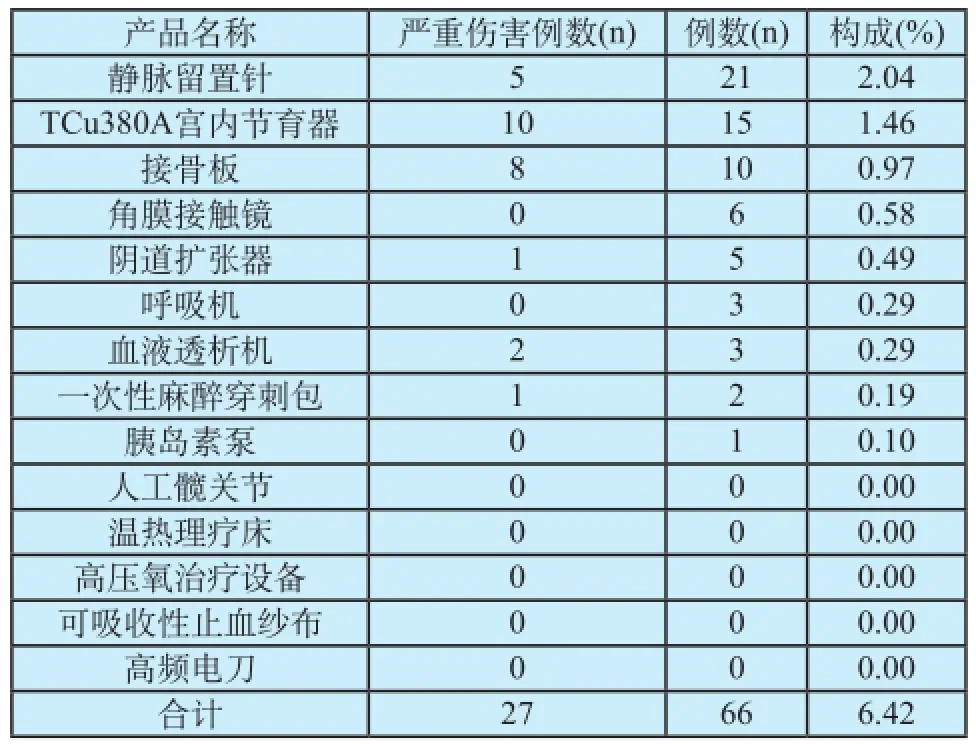
表5 重点监测品种上报情况统计Tab.5 Statistic of medical device of key species
2.9报告表信息缺失情况统计
通过对1 028例可疑医疗器械不良事件报告表信息缺失情况统计,结果显示事件发生日期、注册证号、事件后果、产品名称、生产企业名称、事件初步处理情况、报告人姓名、主要伤害填写全部完整;患者年龄、性别、预期治疗的疾病或作用、发现或者知悉日期、医疗器械实际使用场所、操作人类别、初步原因分析、事件报告状态基本填写完整(>95%)。
在事件陈述部分中,对受害者影响和采取治疗措施时间存在缺失,对关联性评价带来一定影响;其它信息,如患者电话、商品名、型号规格、产品编号、产品批号、有效期和生产日期等缺失项较多,反映出不良事件涉及产品的可追溯性有待提高[3]。目前,报表整体存在填写不全,产品信息缺失较多,事件过程描述不够完整等缺陷(表6)。

表6 1028例可疑医疗器械不良事件报告信息缺失情况统计表Tab.6 Information missing of 1028 adverse events of medical device reports
3 讨论
3.1一般情况分析
贵阳市常住人口432万,2012年共上报可疑医疗器械不良事件报告1 028份,相对2011年的129份同比增长696.89%。同时,我市2012年每百万人口平均报告数为237份,相对2011年的30份同比增长690%,从监测报告数量上取得了明显的进步。
但各类基层用户上报率较低,报告质量相对不高,这些体现出我市目前医疗器械不良事件监测工作存在整体效率不高,监测效果不理想的情况,也反映了各类基层用户医疗器械不良事件监测工作力度上的不足。
3.2严重伤害报告分析
通过统计得知,报告排名前十的器械中宫内节育器排在第六位,且位于严重伤害前五位医疗器械的第一,同时在重点监测品种中TCu380A宫内节育器的严重伤害事件数量最多,挖掘出一个关键信号,即宫内节育器引起的严重伤害不良事件所占比例较高,需引起重点关注。该品种为Ⅲ类医疗器械,同时具备了临床上使用频率高,用量大,伤害程度较严重的特点,下一步亟需开展针该品种的有关培训,加强宫内节育器的监测。
3.3关注重点监测品种,提升医疗机构监测工作能力
由重点监测品种统计(表5)可见,贵阳市各级医疗机构重点监测品种的上报情况不够理想,总体存在上报数量小,品种覆盖面不高,严重伤害报告少的状况。原因主要是我市医疗器械不良事件监测工作起步比较晚,多数医疗机构还没有建立系统的医疗器械不良事件监测队伍和机制,专业人才比较匮乏,大部分医护人员缺乏对重点监测品种临床不良事件主要表现相关知识的了解。
由于医疗器械严重报告主要是来自大型医疗机构,重点监测品种也主要集中在医疗机构进行使用。可见,医疗机构不仅需完成一般上报的任务,还需同时承担重点监测品种和严重伤害报告的主要上报责任,这和医疗资源的分布是相适应的。下一步亟需在医疗机构内部建立有效的监测制度,开展重点监测品种知识的相关培训,明确各重点监测品种所在科室联络人进行负责,建立奖惩机制,强化认识,保证重点监测品种不良事件报告能得到有效收集,并及时进行归纳和总结,进一步指导临床安全用械。
3.4加强宣传培训力度
基层用户,尤其是医务工作者关于医疗器械不良事件及其监测的认知水平较低,是影响报告行为的主要因素[4]。针对我市目前医疗器械不良事件监测工作的整体情况,各类基层用户监测工作业务水平均有待提高的客观要求,结合我市实际情况,下一步亟需针对生产企业、经营企业、医疗机构逐步开展分层次、分类培训、侧重品种类型的培训,使之认识到报表每项内容的重要性,漏报或信息不完整的后果。同时采取各种形式进行宣传,尤其要把重点放在医疗机构,发放医疗器械不良事件监测知识手册,制作专题知识宣传栏,不断提高监测人员的上报意识,变被动为主动,提高基层用户监测工作效能。
3.5建立健全监测网络,实现数量和质量双提升
2012年2月贵阳市药品不良反应监测中心组建成立,同时我市从2012年开始使用“国家药品不良反应监测系统”,这标志着贵阳市医疗器械不良事件监测迈入了一个新的阶段,有利于基层用户监测网络的延伸,并方便了监测机构对监测资源的整合管理。虽然注册基层用户已突破两千家,但各类基层用户上报单位数占注册数的比例偏低,大部分基层用户尚未突破零报告,且存在报告质量普遍不高的情况,反映了从虚拟监测网络的构建到实体三级监测网络的形成还需要一个较漫长的过程。
目前,建立健全医疗器械不良事件监测网络,完善监测队伍,形成良性机制是我市进一步开展医疗器械不良事件监测工作的迫切要求,必须不断将监测网络由“虚”转“实”,使各类基层用户与医疗器械监管机构形成合力,才能不断提高广大基层用户的上报率和报告质量,真正把监测工作落到实处。
3.6为全国医疗器械不良事件监测提供经验与借鉴
医疗器械不良事件监测工作在我省(市)起步较晚,作为医疗器械不良事件报告主体的医疗机构,目前存在重药轻械的思想,且大部分还未建立系统的监测机制;经营企业主要经营品种为Ⅰ、Ⅱ类医疗器械,并存在缺乏上报经验,无回访制度等问题;生产企业以Ⅰ、Ⅱ类低风险器械产品为主,存在着数量规模小、产品科技含量低、监管意识不强等问题。这些都决定了我市医疗器械不良事件监测工作的地域特殊性,并制约着监测工作的提升和信息渠道的通畅。贵阳市作为贵州的省会城市,具有代表性,其监测状况是贵州省整体监测现状的缩影,同时与西部地区普遍较落后的监测状况有类似之处,监测工作当前仍面临许多问题和挑战。通过分析我市2012年医疗器械不良事件监测的整体情况,可以为全国尚处初级监测阶段的省(市)提供不良事件监测的经验和改进思路,提高监测人员对医疗器械不良事件风险的认识,以便指导今后的实际监测工作。
[1] 国家食品药品监督管理局, 中华人民共和国卫生部. 医疗器械不良事件监测和再评价管理办法(试行)[EB/OL]. http://www.sda. gov.cn/WS01/CL0059/34994. html2008-12-29/2013-5-29.
[2] 王兰明. 医疗器械不良事件监测—现状与展望[J]. 中国医疗器械杂志, 2004, 28(4): 282-289.
[3] 杨兆慧, 孟永成. 2006年可疑医疗器械不良事件报告质量分析[J]. 中国药物警戒, 2007, 4(4): 222-225.
[4] 刘爱萍, 张黎明, 闫炜, 等. 医务工作者报告医疗器械不良事件的影响因素[J]. 中国医疗器械杂志, 2008, 32(1): 47-49.
A Retrospective Analysis of 1 028 Adverse Events of Medical Device Reports
ObjectiveTo provide suggestion for MDAEs monitoring with analyzing the features of the 1 028 reports of MDAEs.MethodsWith retrospective case study, this paper analyzed 1 028 MDAE reports in Guiyang during 2012.ResultsThe intrauterine device (IUD) caused the higher proportion of adverse events with serious degree. Monitoring consciousness of grassroots users needs to be improved. The quality of the reports should be enhanced.ConclusionsMore attention should be paid to monitoring on IUD. The level of MDAEs monitoring should be improved through carrying out targeted training and publicity, establishing and improving MDAEs monitoring network.
medical device, adverse events, analysis, monitoring
F203
A
10.3969/j.issn.1671-7104.2013.06.018
【 Writers 】Cao Yunbo, Gao Lin Guiyang center for ADR monitoring, Guiyang, 550002
1671-7104(2013)06-0447-04
2013-05-31
曹韵波,助理工程师,E-mail: caoyunboasdf@163.com
高林,副主任药师,E-mail: gaolin113@sina.com
