6-羟基山萘酚-3-O-β-葡萄糖苷抑制脱氧核糖氧化损伤的机理
2013-03-03王媛凯张立伟
王媛凯,支 鹏,张立伟,*
(1.山西大学分子科学研究所,山西 太原 030006;2.天津大学药物科学与技术学院,天津 300072)
6-羟基山萘酚-3-O-β-葡萄糖苷抑制脱氧核糖氧化损伤的机理
王媛凯1,支 鹏2,张立伟1,*
(1.山西大学分子科学研究所,山西 太原 030006;2.天津大学药物科学与技术学院,天津 300072)
目的:研究6-羟基山萘酚-3-O-β-葡萄糖苷(6-HK-3-O-G)抑制Fenton反应和对羟自由基清除的能力,并对其抑制Fenton反应的机理进行初步探讨。方法:利用脱氧核糖氧化损伤的实验检测模型和DPPH自由基的清除实验。结果:6-HK-3-O-G对羟自由基具有较强的清除能力;对Fenton反应引起的2-脱氧核糖氧化损伤具有保护作用,其保护作用机理与6-HK-3-O-G直接对Fenton反应所产生的羟自由基的清除作用有关,但更主要的可能是由于6-HK-3-O-G与Fe2+的络合作用,阻断了Fenton反应的进行。结论:6-HK-3-O-G具有强的抗氧化活性,在生理条件下,6-HK-3-O-G与Fe2+的络合作用可能是其抑制Fenton反应的关键因素。
6-羟基山萘酚-3-O-β-葡萄糖苷(6-HK-3-O-G);Fenton反应;2-脱氧核糖;DPPH自由基
羟自由基是氧自由基中最活泼、毒性最强的一种,可使细胞发生氧化损伤而引发多种疾病。Fenton 反应是体内产生羟自由基的主要机理之一,也是引起细胞损伤而导致心脑血管、老年性痴呆等疾病的重要因素之一[1-4]。生物体内普遍存在的VC 、Fe2+、Cu2+,可使细胞在有氧代谢过程中发生Fenton反应而产生羟自由基[5]。而红花为传统用于治疗心脑血管疾病的常用中药,其所含的红花黄色素是红花的主要药效部位,具有抗氧化[6-7]、保护心肌[8]等作用。6-羟基山萘酚-3-O-β-葡萄糖苷(6-HK-3-O-G)是红花黄色素的主要活性成分之一[9],目前有关6-HK-3-O-G抗氧化和抗氧化机理的研究尚未见报道。本实验利用Fenton反应所造成的脱氧核糖氧化损伤模型和DPPH自由 基的清除实验,研究6-HK-3-O-G抑制Fenton反应的能力和对羟自由基的清除能力,并对其抑制Fenton反应的机理进行初步探讨,旨在为红花的药理作用机制提供科学依据。
1 材料与方法
1.1 材料与试剂
2-硫代巴比妥酸(TBA) 上海国药集团化学试剂有限公司;2-脱氧核糖 上海生物科技有限公司;6-HK-3-O-G(纯度≥95%) 本研究室自制[10];抗坏血酸、H2O2(30%) 天津基准化学试剂有限公司;三氯乙酸(TCA) 天津市天力试剂有限公司;乙二胺四乙酸二钠(EDTA)北京化工厂;1,1-二苯基-2-三硝基苯肼(DPPH)上海索莱宝生物技术有限公司;硫酸亚铁铵 天津市恒兴化学试剂制造有限公司。
1.2 仪器与设备
Agilent 1200型高效液相色谱仪 美国安捷伦公司;色谱柱Venusil XBP-C18(4.6mm×250mm,5μm) 天津博纳艾杰尔科技有限公司;Cary-50Bio型紫外-可见分光光度计 美国Varian公司。
1.3 方法
1.3.1 2-脱氧核糖氧化损伤能力测定
6-HK-3-O-G对2-脱氧核糖氧化损伤保护作用实验按文献[11]方法、步骤进行。在10mL试管中依次加入10mmol/L磷酸盐缓冲液7.5mL(pH7.2,二次蒸馏水配制),0.3mL Fe2+(用0.1mol/L盐酸配制),0.3mL 6-HK-3-O-G(用甲醇配制)或EDTA(二次蒸馏水配制),浓度为0.2mmol/L的2-脱氧核糖和抗坏血酸(二次蒸馏水配制)各0.3mL,再加入2mmol/L的H2O20.3mL启动反应,各实验组均在37℃条件下孵育10min,然后再加入0.5mL 质量浓度为10g/100mL 的TCA终止反应,最后加入0.5mL 1g/100mL的TBA(用40mmol/L NaOH配制),并置80℃加热15min,用冰水迅速冷却后测波长532nm处吸光度。蒸馏水代替药物作为对照组,蒸馏水代替2-脱氧核糖作为空白。6-HK-3-O-G对2-脱氧核糖氧化损伤的抑制率用式(1)计算。

1.3.2 DPPH自 由 基 清除能力测定
在5mL试管中依次加入0.3mL 1.0mmol/L的DPPH无水乙醇溶液、2.4mL无水乙醇和0.3mL 2mmol/L 6-HK-3-O-G(或0.3mL 2mmol/L 6-HK-3-O-G与Fe2+的混合溶液),迅速混合后放置30min,然后在波长524nm处测定吸光度。
1.3.3 紫外-可见光谱测定
在10mL试管中加入9.7mL KBP缓冲液(20mmol/L,pH7.2,二次蒸馏水配制)和0.3mL浓度为0.5mmol/L的6-HK-3-O-G,混合均匀,取2.5mL至石英杯中,然后每隔2min滴加5μL Fe2+溶液(浓度为10mmol/L,用0.1mol/L盐酸配制)一次,迅速混合均匀,测定吸光度(直至吸收光谱没明显变化为止)。
1.3.4 HPLC测定
在10mL试管中加入9.7mL KBP缓冲液(20mmol/L,pH7.2,二次蒸馏水配制)和0.3mL浓度为0.5mmol/L的6-HK-3-O-G(用甲醇配制),混合均匀。取2.5mL溶液作为待测液1;另取2.5mL溶液加入10μL Fe2+溶液(浓度为10mmol/L,用0.1mol/L盐酸配制),混合均匀,作为待测液2。待测液静置5min后,测定HPLC谱。色谱测定条件为:Venusil XBP-C18(4.6mm×250mm,5μm)色谱柱,以CH3OH(A)和H2O(0.2mol/L NaClO4-0.2‰HClO4)(B)为流动相,梯度洗脱,t=0时,V(A):V(B)=26:74;t=120min时,V(A):V(B)=35:65,流速1mL/min,柱温25℃,检测波长350nm,进样量20μL。
2 结果与分析
2.1 6-HK-3-O-G对2-脱氧核糖氧化损伤的保护作用
6-HK-3-O-G对2-脱氧核糖氧化损伤的保护作用可用Fenton反应所致的2-脱氧核糖氧化损伤实验进行评估。

O-G对2-脱氧核糖氧化损伤的抑制率Fig.1 Inhibitory rate of 6-HK-3-图1 6-HK-3-O-G on oxidative damage to 2-deoxyribose
羟自由基可氧化损伤2-脱氧核糖生成产物丙二醛,TBA与丙二醛反应可生成在波长532nm处有吸收的发色基团。因此,当体系产生的羟自由基越多,2-脱氧核糖的损伤就会越严重,532nm波长处的吸光度就会越大[12]。若6-HK-3-O-G对体系的羟自由基具有清除作用或可阻断Fenton 反应产生羟自由基,那么就会抑制Fenton反应对2-脱氧核糖的氧化损伤,体系在532nm波长处的吸光度就会减小。由图1可见,当6-HK-3-O-G浓度在0~40μmol/L范围内时,随着浓度的增加6-HK-3-O-G对2-脱氧核糖氧化损伤的抑制率增强,当浓度达到40μmol/L时,抑制率可达93%。6-HK-3-O-G在低浓度时(0~40μmol/L)对2-脱氧核糖氧化损伤的抑制率的线性回归方程为(图1):y=0.0993x+0.1117。由方程可知,6-HK-3-O-G的IC50为3.91μmol/L(抑制2-脱氧核糖氧化损伤达到50%时所需浓度),说明6-HK-3-O-G对由Fenton反应引起的2-脱氧核糖氧化损伤具有较强的保护作用。6-HK-3-O-G的保护作用的机理可能有两个方面,其一可能是6-HK-3-O-G对体系产生的羟自由基具有直接清除作用[13],第二可能是由于6-HK-3-O-G阻断了Fenton 反应,使产生的羟自由基浓度降低[14]。
2.2 6-HK-3-O-G与Fe2+络合前后对羟自由基的清除能力DPPH是用于羟自由基清除剂筛选的理想模型[15-16],清除剂对DPPH自由基清除能力的大小,体现了对羟自由基清除能力的大小[17-18]。一般认为有效的酚类DPPH清除剂的清除能力主要来源于游离酚羟基,清除剂所含游离酚羟基数量多则对DPPH自由基清除的能力强。由图2可知,游离的6-HK-3-O-G对DPPH自由基具有清除作用,而6-HK-3-O-G与Fe2+混合物的清除能力降低。6-HK-3-O-G与Fe2+混合物对DPPH自由基的清除能力降低的原因可能是由于6-HK-3-O-G与Fe2+形成了络合物,导致6-HK-3-O-G结构中游离酚羟基数量减少,因而清除能力降低。

图2 6-HK-3-O-G与Fe2+络合前后对DPPH自由基清除能力的比较Fig.2 DPPH radical scavenging capacity of 6-HK-3-O-G and 6-HK-3-O-G-Fe2+complex
2.3 6-HK-3-O-G与Fe2+络合的紫外光谱测定
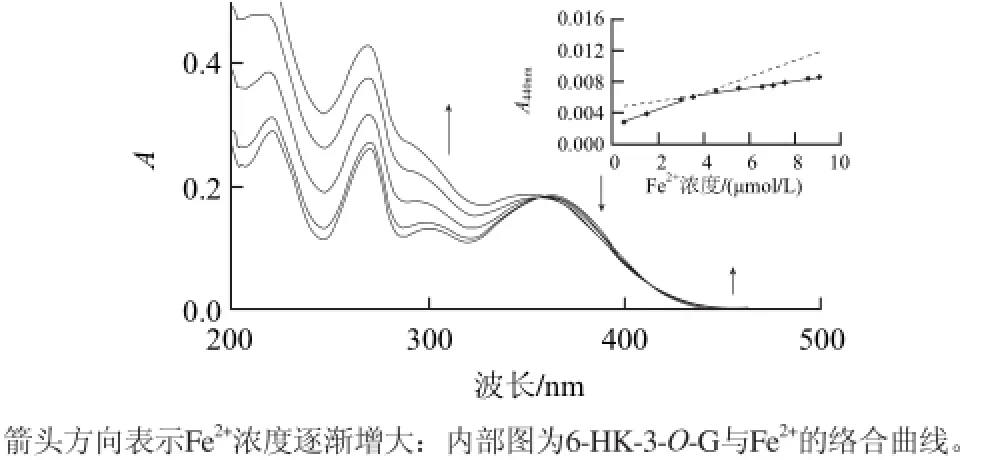
图3 6-HK-3-O-G与Fe2+络合的紫外光谱滴定曲线Fig.3 UV titration curve of 6-HK-3-O-G and Fe2+(Inset shows the chelation curve of 6-HK-3-O-G with Fe2+)
紫外吸收光谱常用于判断有机化合物与金属离子形成配合物与否,一般具有紫外吸收的有机分子与金属离子形成配合物后,可引起有机分子紫外吸收光谱的变化,如吸收峰的位移、吸收峰强度变化、代表新物种产生的等吸收点的出现等[19]。Fe2+的滴定6-HK-3-O-G的紫外吸收光谱变化情况如图3所示,6-HK-3-O-G在波长220、270、363nm观察到3个吸收带,一般归因于共轭3环系统π-π电子跃迁,随着Fe2+的加入,6-HK-3-O-G在波长220nm和270nm为中心的的吸收峰强度增加,在波长357nm和415nm间区域的吸光强度减少,在波长415nm以后的吸收峰增加,吸收峰在波长360nm处的吸收峰蓝移,波长357nm和415nm处出现两个等吸收点,表明有6-HK-3-O G-Fe2+络合物的形成。6-HK-3-O-G与Fe2+结合的光谱变化可能归结为与Fe2+络合后,共轭环系统π电子的进一步离域所至。滴定曲线(图3内部图)表明6-HK-3-O-GFe2+络合物物质的量比为2:1。通过分析在波长357nm与415nm之间的峰值的光谱变化获得了同样的化学计量数。
2.4 HPLC测定6-HK-3-O-G与6-HK-3-O-G-Fe2+络合物
在HPLC色谱分析中,可以根据色谱峰的保留时间的差异区分不同的物种,色谱保留时间不同可以认为是不同的化合物。6-HK-3-O-G与Fe2+混合前后的色谱(图4)显示,6-HK-3-O-G的保留时间为31.812min,6-HK-3-O-G与Fe2+混合后色谱保留时间提前为30.469min。结果说明6-HK-3-O-G与Fe2+形成新的化合物,即6-HK-3-O-G与Fe2+形成了络合物,该结果与紫外吸收光谱分析结果一致。

图4 6-HK-3-O-G与6-HK-3-O-G-Fe2+的色谱图Fig.4 Chromatogram of 6-HK-3-O-G and 6-HK-3-O-G-Fe2+complex
2.5 6-HK-3-O-G阻断Fenton反应机制

图5 脱氧核糖的氧化损伤与Fe2+浓度的关系Fig.5 Relationship of oxidative damage to deoxyribose with various concentrations of Fe2+
由Fenton反应过程可知,2-脱氧核糖的氧化损伤主要来源于Fenton 反应产生的羟自由基。实验1.3.1节和1.3.2节结果表明,6-HK-3-O-G可以抑制Fenton反应对2-脱氧核糖的氧化损伤,并对羟自由基具有清除作用。依据Fenton反应机理推测6-HK-3-O-G对2-脱氧核糖氧化损伤的保护作用的机理可能有两个方面,其一可能是6-HK-3-O-G对体系产生的羟自由基具有直接清除作用,第二可能是由于6-HK-3-O-G阻断了Fenton反应,使产生的羟自由基浓度降低。
为了进一步阐明6-HK-3-O-G的作用机理,比较了6-HK-3-O-G存在(6-HK-3-O-G与Fe2+先混合孵育,然后再加入测定体系)或不存在情况下,2-脱氧核糖的氧化损伤与Fe2+浓度变化的关系。图5显示,6-HK3-O-G不存在时,随着Fe2+浓度增加氧化损伤程度增加,相反,当6-HK-3-O-G与Fe2+预先混合孵育,然后再加入测定体系时, Fe2+的浓度达到很高时2-脱氧核糖损伤都能被有效抑制。该结果说明,6-HK-3-O-G可通过与Fe2+形成络合物进而阻断Fenton反应。
由于6-HK-3-O-G本身具有直接清除羟自由基的能力,为了进一步确定6-HK-3-O-G抑制Fenton反应的氧化损伤机理,又进行图6所示实验[20]。图6实验结果表明,当体系中仅有Fe2+的强络合剂EDTA存在时,2-脱氧核糖的氧化损伤不能被有效抑制(图6,曲线1),说明体系中仍然有羟自由基的生成;当体系中既有Fe2+的强络合剂EDTA,又有6-HK-3-O-G存在时,2-脱氧核糖氧化氧化损伤降低了75%(图6,曲线2),该结果主要是由于6-HK-3-O-G对羟自由基的清除,因为EDTA对Fe2+的络合能力较6-HK-3-O-G强,所以,体系中不能有效形成6-HK-3-O-G-Fe2+络合物;当体系中存在6-HK-3-O-G,而不存在EDTA时,2-脱氧核糖的氧化损伤抑制率在90%以上(图6,曲线3),该结果证明6-HK-3-O-G在抑制Fenton反应对2-脱氧核糖氧化损伤过程中,6对Fe2+络合起着关键作用。

图6 EDTA对6-HK-3-O-G阻止2-脱氧核糖氧化损伤能力的影响Fig.6 Influence of EDTA on the protective effect of 6-HK-3-O-G against oxidative damage to deoxyribose
3 结 论
红花主要活性成分6-HK-3-O-G具有较强的清除羟自由基能力,可以抑制由Fenton反应引起的2-脱氧核糖氧化损伤作用,并且,在其抑制Fenton反应过程中,6-HK-3-O-G对Fe2+络合起着关键作用;红花所体现的抗氧化、保护心肌等药理活性作用,可能与其主要活性成分6-HK-3-O-G的抗氧化作用有关。
[1] PARAVICINI T M, TOUYZ R M. NADPH oxidase, reactive oxygen species, and hypertension clinical implications and therapeutic possibilities[J]. Diabetes Care, 2008, 31(2): 170-180.
[2] 方允中, 杨胜, 伍国耀. 自由基、抗氧化剂、营养素与健康的关系[J]. 营养学报, 2003, 25(4): 337-343.
[3] 李勇, 孔令青, 高洪, 等. 自由基与疾病研究进展[J]. 动物医学进展, 2008, 29(4): 85-88.
[4] 张玉锦, 洪小茜. 活性氧与心血管疾病关系的研究[J]. 医学综述, 2002, 8(4): 212-213.
[5] SUTTON H C, WINTERBOURN C C. On the participation of higher oxidation states of iron and copper in Fenton reactions[J]. Free Rad Biol Med, 1989, 6(1): 53-60.
[6] 金鸣, 李金荣, 吴伟. 红花黄色素抗氧化作用的研究[J]. 中国中药杂志, 2004, 29(5): 447-449.
[7] 李中原, 涂秀华. 红花黄色素的药理研究进展[J]. 中药新药与临床药理, 2005, 16(2): 153-156.
[8] 王天, 傅风华, 韩冰, 等. 羟基红花黄色素A对实验性心肌梗死大鼠的保护作用及机制[J]. 中草药, 2007, 38(12): 1853-1856.
[9] 兰艺凤, 周璐, 张立伟. HPLC法同时测定红花中的5种黄酮成分[J].食品科学, 2011, 32(12): 283-286.
[10] KAZUMA K, TAKAHASHI T, SATO K, et al. Quinochalones and flavonoids from fresh florets in different cultivars of Carthamus tinctorius L. [J]. Biosci Biotechnol Biochem, 2000, 64(8): 1588-1599.
[11] GUO Maolin, PEREZ C A, WEI Yibin, et al. Iron-binding properties of plant phenolics and cranberry’s bio-effects[J]. Dalton Transactions, 2007, 36(43): 4951-4961.
[12] 王爱国, 罗广华. 羟自由基启动下的脱氧核糖脱氧核糖降解及其产物的TBA反应[J]. 生物化学与生物物理进展, 1993, 20(2): 150-152.
[13] OGATA M, HOSHI M, SHIMOTOHNO K, et al. Antioxidant activity of magnolol honokiol, and related phenolic compounds[J]. J Am Oil Chem Soc, 1997, 74(5): 557-562.
[14] KHOKHAR S, RICHARD K O A. Iron-binding characteristics of phenolic compounds: some tentative structure-activity relations[J]. J Am Oil Chem Soc, 1997, 74(5): 557-562.
[15] 许申鸿, 杭瑚. 一种筛选自由基清除剂的简便方法[J]. 中草药, 2000, 31(2): 96-97.
[16] KONO Y, KASHINE S, YONEYAMA T, et al. Iron chelation by chlorogenic acid as a natural antioxidant[J]. Biosci Biotechnol Biochem, 1998, 62(1): 22-27.
[17] 彭长连, 陈少薇, 林植芳, 等. 用清除有机自由基DPPH 法评价植物抗氧化能力[J]. 生物化学与生物物理进展, 2000, 27(6): 658-661.
[18] YOKOZAW A T, DONG E, NATAGAW A T, et al. in vitro and in vivo studies on the radical scavenging activity of tea[J]. J Agric Food Chem, 1998, 46(6): 2143-2150.
[19] 刘莺, 白燕, 朱添祥, 等. 紫外分光光度法测定Cu (Ⅱ)与含硒氨基酸络合物的组成[J]. 光谱实验室, 2005, 22(2): 426-427.
[20] PEREZ C A, WEI Yibin, GUO Maolin. Iron-binding and anti-Fenton properties of baicalein and baicalin[J]. Journal of Inorganic Biochemistry, 2008, 103(3): 326-332.
Mechanism Underlying Protective Effect of 6-Hydroxykaempferol-3-O-β-glucoside Deoxyribose against Oxidative Damage to Deoxyribose
WANG Yuan-kai1,ZHI Peng2,ZHANG Li-wei1,*
(1. Institute of Molecular Science, Shanxi University, Taiyuan 030006, China;2. School of Pharmaceutical Science and Technology, Tianjin University, Tianjin 300072, China)
Objective∶ To evaluate the capability of 6-hydroxykaempferol-3-O-β-glucoside (6-HK-3-O-G) for inhibiting Fenton reaction and scavenging hydroxyl free radicals, and to explore the inhibitory mechanism on Fenton reaction. Methods∶ A model to test oxidative damage to deoxyribose and a reaction system to test DPPH free radical scavenging activity were created. Results∶ 6-HK-3-O-G not only had strong scavenging activity against hydroxyl free radical, but also could protect 2-deoxyribose against oxidative damage caused by Fenton reaction. The underlying mechanisms were related to the direct scavenging of hydroxyl free radical generated from Fenton reaction but seemed to be mainly due to the chelation of 6-HK-3-O-G with Fe2+, thereby blocking Fenton reaction. Conclusion∶ 6-HK-3-O-G has strong anti-oxidation activity, and the chelation of 6-HK-3-O-G with Fe2+may play a vital role for its inhibiting Fenton chemistry under physiological conditions.
6-hydroxykaempferol-3-O-β-glucoside (6-HK-3-O-G);fenton reaction;2-deoxyribose;DPPH free radical
R286.75
A
1002-6630(2013)03-0029-04
2011-12-08
科技部“十二五”重大新药创制科技重大专项(2011ZX09201-201-06);山西省回国留学人员科研资助项目(2009003)
王媛凯(1985—),女,硕士研究生,研究方向为天然产物。E-mail:2005290045@email. sxu.cn
*通信作者:张立伟(1963—),男,教授,博士,研究方向为天然产物。E-mail:lwzhang@sxu.edu.cn
