CyclinD1、p27及PTEN蛋白在口腔鳞状细胞癌中的表达
2013-02-27杨丽丽徐佳瑛祝桂祥陈启林
杨丽丽 徐佳瑛 吴 伟 祝桂祥 陈启林
鳞状细胞癌是临床上较为常见的恶性肿瘤之一,其中口腔黏膜部位发生的鳞状细胞癌较为多见,与其他部位发生的鳞状细胞癌相比,OSCC更易发生转移,明显降低了患者的生活质量。据相关研究显示,与OSCC发生密切相关的基因是PTEN,PTEN是1种抑癌基因,主要位于10号染色体上,具有磷酸激酶活性[1]。PTEN基因的缺失及表达异常会促进肿瘤的发生,此外,细胞周期中CyclinD1、p27蛋白对细胞的生长也具有一定的调控作用。目前,临床上对OSCC患者CyclinD1、p27及 PTEN蛋白表达情况的研究较少[2]。本研究分析OSCC及正常口腔黏膜患者 CyclinD1、p27及PTEN蛋白的表达情况,旨在探究三者表达的相关性及与组织分化程度的关系,现将结果报告如下。
1 材料与方法
1.1 一般资料
选取2011年10月-2012年10月我院收治的口腔鳞状细胞癌患者50例作为观察组;另选取正常口腔黏膜患者50例作为对照组。对照组男性27例,女性23例,年龄17~66岁,平均为(40.5±1.9)岁。观察组男性26例,女性24例,年龄18~65岁,平均为(43.6±1.2)岁。其中口腔鳞癌患者高分化22例、中分化18例、低分化10例。两组患者在年龄、性别等方面比较无显著性差异(P>0.05),具有可比性。
1.2 方法
采取免疫组织化学SP法,检测正常口腔黏膜及口腔鳞癌组织中CyclinD1、p27及PTEN蛋白的表达情况。主要试剂有鼠抗人PTEN,由北京中杉金桥生物技术有限公司生产的工作型;鼠抗人PIP3,是由武汉博士德生物技术有限公司生产的浓缩型;鼠抗人CyclinD1是由福州迈新生物技术开发公司生产的浓缩型;3种试剂的工作浓度均为1∶100。将标本进行常规石蜡包埋,4 μm切片,经脱蜡、水化、微波修复、SP法免疫组织染色、DAB显色等处理。SP法检测试剂盒为链霉素抗生物素蛋白一过氧化物酶(SP)试剂盒,显色液为DAB显色液。
1.3 观察指标
观察并比较两组患者CyclinD1、p27及PTEN蛋白的表达情况,并观察口腔鳞状细胞癌中CyclinD1、p27及PTEN蛋白表达与组织分化程度的关系。胞质内若出现明显的黄色或棕褐色颗粒即为CyclinD1、p27及PTEN蛋白表达阳性细胞。随机选择10个高倍视野,计数1 000个细胞,计算阳性细胞百分率。<10%为“-”,10% ~50% 为“+”,51% ~75%为“++”,>75%为“+++”。“-”为阴性表达;“+”、“++”、“+++”均为阳性表达[3-5]。
1.4 统计学方法
应用SPSS 15.0软件进行统计学分析,计数资料采用χ2检验,P<0.05为有统计学意义。
2 结果
2.1 正常口腔黏膜及口腔鳞癌组织中CyclinD1蛋白表达情况
正常口腔黏膜组织中CyclinD1蛋白主要呈阴性表达,阴性表达率明显高于观察组;而口腔鳞状细胞癌组织中CyclinD1蛋白以弱阳性表达为主,阳性表达率明显高于正常口腔黏膜组织,P<0.05,具有统计学意义,见表1。
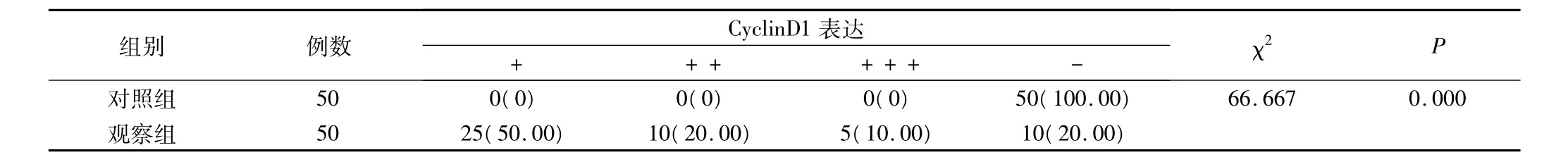
表1 两组CyclinD1蛋白表达情况(例,%)
2.2 两组p27蛋白表达情况
与对照组相比,观察组p27蛋白阳性表达率明显较高,P <0.05,具有统计学意义,见表 2。

表2 两组p27蛋白表达情况(例,%)
2.3 两组PTEN蛋白表达情况
对照组PTEN蛋白以弱阳性表达为主,阳性表达率明显高于观察组,P<0.05,有统计学意义,见表3。
2.4 口腔鳞状细胞癌组织中CyclinD1、p27及PTEN蛋白表达与其组织分化程度的关系
低分化者p27、PTEN蛋白表达阳性率较高分化者低,而低分化者CyclinD1蛋白表达阳性率较高分化者高,P <0.05,具有统计学意义,见表4。
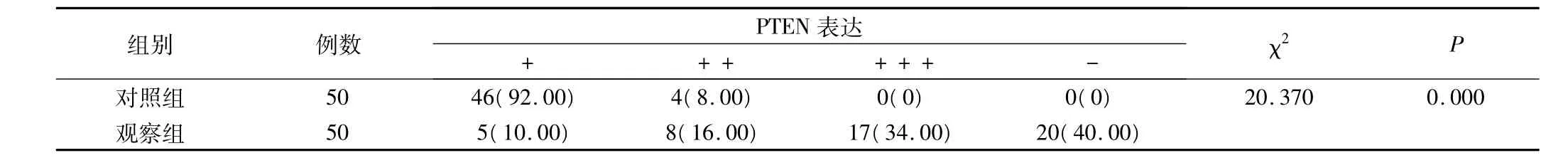
表3 两组PTEN蛋白表达情况(例,%)

表4 CyclinD1、p27及PTEN蛋白与口腔鳞状细胞癌组织分化程度的关系(例,%)
3 讨论
口腔鳞状细胞癌是口腔科发病率较高的恶性肿瘤,在口腔癌症中的发病率较高,居80%以上,该类患者临床上的生存率较低,且预后情况也较差。近年来,随着外科诊断技术的不断进步及分子生物学的不断发展,口腔鳞状细胞癌的早期诊断率不断提高,从分子学上水平上对OSCC发生机制的阐述也不断完善[6]。目前,临床上对口腔鳞癌的研究重点主要在于分子生物学研究,旨在探寻有效的分子生物学指标,从而对口腔鳞癌进行诊断筛选。
多数国内外关于OSCC的研究显示,抑癌基因(PTEN)在OSCC的发展过程中具有较为重要的作用,可通过诱导细胞的凋亡,从而抑制癌细胞的生长繁殖,同时还能抑制端粒酶的活性,从而抑制原癌基因的表达[7-8]。恶性肿瘤的发生发展与PTEN存在较为紧密的关系,其中关于子宫内膜癌、神经胶质癌、前列腺癌、乳腺癌等恶性肿瘤方面的研究报道较多,而关于口腔鳞癌PTEN的报道较少,经不断的研究发现,PTEN的改变多发生在蛋白水平上,而基因水平上的改变不明显。PTEN基因参与机体的正常发育,该基因功能的缺失对于癌症的发展具有明显的促进作用[9]。PTEN是目前唯一一个发现的具有磷酸酶活性的抑癌基因,主要位于人体10q23.3,编码的蛋白质主要分布于细胞质内,在OSCC的发展过程中的阳性表达率呈不断变化的趋势。OSCC的癌变过程依次为正常口腔黏膜、上皮单纯增生、上皮异常增生、口腔鳞状细胞癌,有研究显示,随着病变的不断进展,PTEN的阳性表达率不断的降低,表明癌细胞正在不断的生长,病情演变也越来越重,表明OSCC患者肿瘤的恶性转变过程与PTEN基因的异常遗传学改变有关[10]。
本研究对OSCC与正常口腔黏膜患者PTEN蛋白表达情况的检测可知,OSCC患者PTEN蛋白表达的阳性率较正常口腔黏膜组患者低;高分化组患者PTEN蛋白的阳性率较低分化高,表明PTEN与OSCC的分化程度呈显著相关性。细胞正常生长过程中细胞周期的平衡调控是由各种调控因子决定的,包括细胞周期素依赖性激酶(p27)和细胞周期D1(CyclinD1)等调控因子,其中p27对细胞的生长呈负性调控,而CyclinD1对细胞的生长则呈正性调控,OSCC患者细胞的生长与p27、CyclinD1的表达有关,p27对细胞增殖起抑制作用,CyclinD1起促进作用[11-12]。CyclinD1与细胞周期的G1期相关,可促进G1期细胞转向S期。在正常的细胞周期中CyclinD1为低表达,阳性表达率低,在细胞周期的调控中起着至关重要的作用。p27是1种新近发现的属于细胞周期素依赖激酶抑制物之一,可抑制细胞周期G1期的CyclinD CDK4/6复合物和CyclinE-CDK2复合物活性,在细胞周期与分化调控中起着重要的作用,当p27过度表达时可导致细胞周期持续的维持在G1期,阻碍细胞从G1期转向S期。有研究显示,在正常口腔黏膜组织中p27呈强阳性表达,而在口腔鳞癌患者中呈弱阳性表达[13-14]。本组结果显示,口腔鳞癌组患者p27阳性表达率较正常口腔黏膜组织高,且口腔鳞癌患者呈强阳性表达;口腔鳞癌患者中CyclinD1呈弱阳性表达,且表达的阳性率高于正常口腔黏膜患者。p27、CyclinD1的表达与口腔鳞癌分化程度相关,患者鳞癌分化程度越差,p27表达水平越低,而CyclinD1表达水平越高。p27、CyclinD1等调控因子在调节细胞的增殖过程中具有重要作用,调控因子的紊乱可导致细胞的增殖出现异常,最终诱发肿瘤的发生。综上所述,口腔鳞癌的发生和发展与PTEN基因的表达具有存在较为重要的关系,3种蛋白的表达情况与组织分化程度相关,三者的联合检测对OSCC的早期诊断具有较为重要的临床价值。
[1]陈 成,李乐平,靖昌庆,等.PTEN和p27及cyclinD1蛋白在大肠癌组织中的表达及相关性研究〔J〕.中国现代普通外科进展,2008,11(6):497.
[2]Komazawa N.Suzuki A,Sano S,et al.Tumorigenesis facilimted by Pten deficiency in the skin:Evidence of p53-Pten complex formation on the initiation phase〔J〕.Cancer Sci,2005,96(6):377.
[3]殷 操,谢思明,陈 希,等.DJ-1、张力蛋白同源10q丢失的磷酸酶基因和黏着斑激酶在口腔癌及癌前病变中的表达〔J〕.中华口腔医学杂志,2012,47(21):227.
[4]王 娟,谭 晖,苏 琦.DJ-1在肿瘤中作用的研究进展〔J〕.国际病理科学与临床杂志,2011,31(6):527.
[5]Hildebrandt MA,Yang H,Hung MC,et al.Genetic variations in the P13K/PTEN/AKT/mTOR pathway are associated with clinical outcomes in esophageal cancer patients treated with chemoradiotherapy〔J〕.J Clin Oncol,2009,27(6):857.
[6]林耿冰,贾 静,林李嵩,等.口腔鳞癌中 survivin、cyclinD1和p53基因的表达及其相关性〔J〕.细胞与分子免疫学杂志,2009,25(12):1194.
[7]Fernandes A,Falcao AS,Silva RF,et al.MAPKa are key players in mediating cytokine release and cell death induced by unconjugated bilirubin in cultured rat cortical astrocytes〔J〕.Eur J Neurosci,2007,25(4):1058.
[8]李 立,杨明明,刘 铎,等.口腔癌组织中的Apollon表达及临床意义〔J〕.实用癌症杂志,2008,23(1):41.
[9]刘友良,唐瞻贵,方晓明,等.基质金属蛋白酶-9及基质金属蛋白酶抑制剂-1在口腔鳞状细胞癌中的表达研究〔J〕.口腔医学,2010,30(2):80.
[10]王 雷,蔡 研,孙宏晨.重组人乳铁蛋白对口腔癌细胞周期及周期因子表达影响的实验研究〔J〕.口腔医学研究,2010,26(1):19.
[11]王东旭,姜海行,苏思标,等.体外共培养大鼠骨髓间充质干细胞对肝星状细胞增殖的影响:CyclinD1与p27表达调控〔J〕.中国组织工程研究与临床康复,2010,14(10):1764.
[12]沈金翠,李 灵.PTEN,Ki-67和CyclinD1在皮肤鳞状细胞癌中的表达及意义〔J〕.中国皮肤性病学杂志,2012,26(8):674.
[13]桑建中,田 芳,娄卫华,等.人喉鳞状细胞癌组织中cmyc和cyclinD1蛋白的表达〔J〕.郑州大学学报(医学版),2011,46(4):572.
[14]张秀梅,刘 超,闫纪亮,等.ATRA对甲状腺鳞癌细胞株 SW579细胞 CDK4、CyclinD1、Rb表达的影响〔J〕.山东医药,2011,51(52):7.
