甘薯β-胡萝卜素含量相关AFLP 分子标记的开发
2013-02-23马代夫谢世清
靳 容, 后 猛, 马代夫, 谢世清, 李 强
(1.江苏徐州甘薯研究中心,中国农业科学院甘薯研究所,农业部甘薯生物学与遗传育种重点实验室,江苏 徐州221131;2.云南农业大学,云南 昆明650201)
甘薯[Ipomoea batatas (L.)Lam.]是继水稻、小麦、玉米之后的中国第四大粮食作物[1]。它富含人体必需的多种营养物质,保健价值很高,尤其是红肉甘薯中含有大量的β-胡萝卜素。作为维生素A 的重要合成前体,β-胡萝卜素对预防夜盲症有良好的效果,可有效改善妇女及儿童因夜盲症导致的失明状况[2-3],具有十分重要的市场开发价值[4-5]。β-胡萝卜素由多个基因共同控制合成[6],并且与许多优良性状存在负相关[7-8],传统育种方法周期长,直接影响到富含胡萝卜素、综合性状优良品种的选育效率。
1993 年Hall 等[9]提出利用分子标记技术辅助育种,可有效提高育种效率。Ukoskit 等[10]较早地将这种方法引入甘薯育种,利用集群分离分析法(Bulked segregant analysis,BSA)[11]进行甘薯抗根腐病基因的标记分析。随着分子标记辅助育种方法在甘薯中的应用,近年来研究人员开发了一些与甘薯重要性状连锁的分子标记,尤以与抗病基因连锁的分子标记居多[12-14]。因为甘薯本身存在复杂的自交不亲和性,以及染色体组的高度杂合性,难以获得纯系[15],所以甘薯上一般利用BSA 法构建高密度遗传连锁图谱。但是由于受到其他基因的干扰,利用BSA 法获得的连锁标记的准确度受到影响[16],从而影响了甘薯遗传图谱的构建及QTL 分析。
在缺少甘薯高饱和度遗传图谱的情况下,Mcharo 等[17]早在2004 年就利用AFLP 标记建立模型,研究甘薯的干物率等性状。随后,Mcharo 等[18]和Douglas 等[19]分别利用与抗甘薯根结线虫病(Southern root-knot nematode)和病毒病害(Sweet potato virus disease,SPVD)性状连锁的分子标记建立Logistic 回归模型,定性选育抗病甘薯品种。本试验通过筛选与甘薯高β-胡萝卜素含量性状相关的AFLP 分子标记,试图建立稳定的Logistic 回归模型,在无需测定甘薯块根β-胡萝卜素含量的情况下,特别是在甘薯早代育种过程中,可以快速、准确地筛选出高β-胡萝卜素含量的甘薯材料,为高β-胡萝卜素甘薯品种(系)的选育提供参考。
1 材料与方法
1.1 植物材料
建池与引物筛选材料:徐薯25(白肉、低胡萝卜素含量甘薯品种)、徐薯22-5(红肉、高胡萝卜素含量甘薯品系),及其杂交F1代分离材料共14 份。
模型验证材料:除建池双亲(徐薯25 和徐薯22-5)外,另外选择4 个高β-胡萝卜素桔红肉甘薯品种(系)浙薯81、徐083228、徐070339、徐052701 和4 个低β-胡萝卜素白肉甘薯品种(系)徐薯22、徐薯26、徐薯28、徐053601 共计10 个品种(系)作为Logistic 回归模型验证材料。
1.2 样品处理和基因组DNA 提取
在大田甘薯苗期,取所有试验用甘薯材料的顶部新鲜嫩叶3 ~5 片,在液氮中充分冷冻研磨成粉末,装入1.5 ml 的离心管中,-80 ℃保存。按照李强等[20]方法提取基因组DNA,Nanodrop1000 微量紫外分光光度计检测提取的DNA 浓度,终浓度用1 ×TE 溶液稀释到50 ng/μl。0.8%的琼脂糖凝胶电泳检测提取的DNA。
1.3 AFLP 分析
参照李强等[21]的AFLP 扩增方法,首先用EcoR I 和Mse I 消化样品DNA,然后用T4 连接酶16 ℃连接酶切产物12 h。将酶切连接产物用带有1 个选择性碱基的引物组合进行预扩增,得到的PCR 产物再用带有3 个选择性碱基的引物对其进行AFLP 分析,PCR 反应体积20.0 μl,其组分为TaqE buffer(+KCl),1.25 U Taq DNA 聚合酶(TaqE),0.2 mmol/L dNTP mix,1 μmol/L引物,3.5 μl 稀释后的预扩增产物进行PCR 反应。本试验所用内切酶、连接酶、TaqE 及dNTP 均购自Fermentas 公司。双酶切反应、连接反应、预扩增反应和选择扩增反应均在Cycler PCR 仪(BIO-RAD)上进行。反应所用接头、预扩增以及选择扩增引物均由上海生工生物工程技术有限公司合成。
1.4 β-胡萝卜素含量的测定
采用丙酮提取比色法[22]测定甘薯样品中β-胡萝卜素的含量(略有改动)。取健壮薯块,冲洗晾晒或吸水纸擦干后,去皮纵切,四分法取样。称取薯块样品1.0 g,加入少量丙酮研磨,至提取液无色,定容至25.0 ml,3 000 r/min离心5 min,取上清液测定454 nm 波长处光密度。同一甘薯样品取样3 次,取平均值。β-胡萝卜含量按以下公式计算:
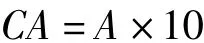
式中,CA:β-胡萝卜素含量(单位为mg/g);A:丙酮液的消光度。
1.5 Logistic 回归分析
分别根据EcoR I 和Mse I 酶切和接头序列,各设计引物序列20 条,共计400 对引物组合,利用建池材料从400 对引物中筛选出5 对与高β-胡萝卜素含量性状相关的引物组合(表1)。利用筛选出的引物组合,对甘薯材料进行AFLP 分析,使用SPSS Statistics 17.0 软件构建Logistic 回归模型[23],并检测该模型中的每个材料是否符合预期结果。

表1 AFLP 分子标记引物组合序列Table 1 Primer sequences of AFLP markers
构建Logistic 回归模型的过程中,首先对筛选出的AFLP 标记进行多态性赋值,出现条带的记为1,没有出现条带的记为0,经过列联表整理后,用作构建Logistic 回归模型的自变量。筛选自变量采用向前法,即按照筛选出的标记对β-胡萝卜素合成基因的贡献(P 值的大小)由小到大依次挑选,所有P 值均小于临界值0.05,检测该模型中分子标记预测的每个材料是否符合胡萝卜素含量高低划分的结果。并用模型系数的混合检验(Omnibus tests of model coefficients)、对数似然比检验(Log-Likelihood ratio test)以及Hosmer-Lemeshow 检验(Hosmer and Lemeshow test)分析评价该模型。
Logistic 回归模型:表型(即胡萝卜素含量高低)分组概率公式为:

其中P 为表型分组概率;β0为截距;β1、β2…βp为偏回归系数。
2 结果
2.1 β-胡萝卜素含量
根据2008 和2009 年连续2 年对F1代分离群体β-胡萝卜素含量的测定结果,选择杂交后代中β-胡萝卜素含量位于2 个极端的样品,共计41 系(表2)。按照β-胡萝卜素含量的不同,对选出的材料进行分组,分为高β-胡萝卜素含量组和低β-胡萝卜素含量组,从表2中可以看出,高β-胡萝卜素含量组共有19 个样品,甘薯中β-胡萝卜素含量的变化范围为0.096 1 ~0.185 6 mg/g,肉色全部为橘红色;低β-胡萝卜素含量共有22个样品,由于该组β-胡萝卜素含量极低,多数样品利用丙酮提取法无法测到,最高值也仅为0.003 3 mg/g,肉色为淡黄至白色。甘薯β-胡萝卜素含量的高低与肉色有很大联系,通常情况下,β-胡萝卜素含量高的甘薯品种肉色为深黄色至橘红色,含量低的肉色为白色至淡黄色[24],白肉甘薯品种中的β-胡萝卜素含量通常趋近于0[25-26],这些都与本试验结果相一致。
2.2 Logistic 回归结果
在理想的Logistic 模型中,所有高β-胡萝卜素组的概率值应趋向于0,所有低β-胡萝卜素组的概率值应趋向于1。本试验结果(表2)显示,高β-胡萝卜素组中z118 概率值≥0.50,z162 和z058 概率值分别为0.30 和0.20,其余样品分组概率值均≤0.10,19 个样品中有13 个样品分组概率为0,样品的平均分组概率P 为0.068;低β-胡萝卜素组中z008 概率值为0,z105 概率值为0.60,其余样品分组概率都≥0.90,22 个样品中14 个样品分组概率为1.00,样品的平均分组概率P 为0.868。把分组概率P <0.50 的样品归为高β-胡萝卜素组,分组概率P >0.50 的样品归为低β-胡萝卜素组。依据此标准,高β-胡萝卜素组的z118 和低β-胡萝卜素组中的z008 不符合分组,其余39 个样品符合分组,正确度高达95.1%。
为了验证该模型拟合度,本试验对其进行了模型系数的混合检验、对数似然比检验以及Hosmer-Lemeshow 检验。模型系数的混合检验是针对步骤、模块和模型开展模型系数的综合性检验。结果显示,不论是步骤、模块和模型的卡方值均大于显著性水平0.05 的卡方临界值,因此该Logistic 回归模型通过检验。
对数似然比检验中,-2lgL 越小,说明自变量的作用越显著,模型拟合效果越好。该Logistic 回归分析中每一步的-2lgL 值都在不断减小,随着模型的逐步完善,-2lgL 从最初的39.444 减少到15.339,说明该模型的拟合效果不断提高。作为补充和参照,本试验还对该模型进行了Hosmer-Lemeshow 检验,结果显示,高胡萝卜素组的期望值(Expected)逐渐减少到0,与观测值(Observed)趋于接近;低胡萝卜素组的期望值逐渐增加到4,与观测值也趋于接近。综上所述,本试验构建模型的整体拟合效果较好。
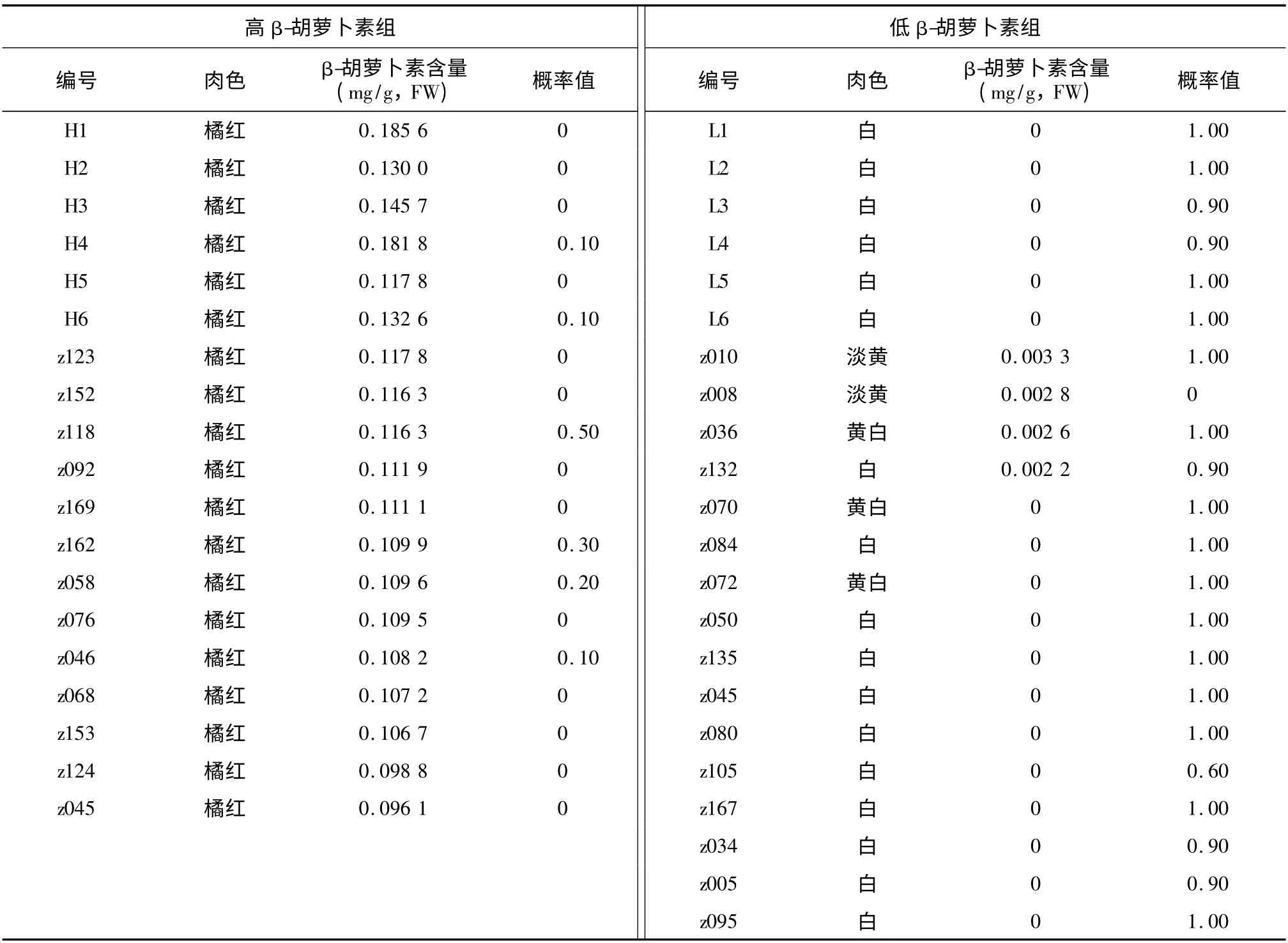
表2 F1 代分离群体表型分类Table 2 Phenotypic classification of F1 half-sibs based on β-carotene content of sweetpotato
2.3 Logistic 回归模型可行性分析
为了进一步分析Logistic 回归模型在甘薯育种中可行性,根据胡萝卜素含量结果,把验证用的10种胡萝卜素品种(系)分成高胡萝卜素品种(系)和低胡萝卜素品种(系)进行Logistic 回归分析,供试样品通过Logistic 回归分析,所得分组概率如表3 所示。高β-胡萝卜素组5 个样品分组概率值均≤0.10,低β-胡萝卜素组5 个样品分组概率都≥0.90。供试材料分组概率全部符合预先表型分析,结果表明该Logistic 回归模型可以用于高β-胡萝卜素甘薯品种的分子标记辅助选育。
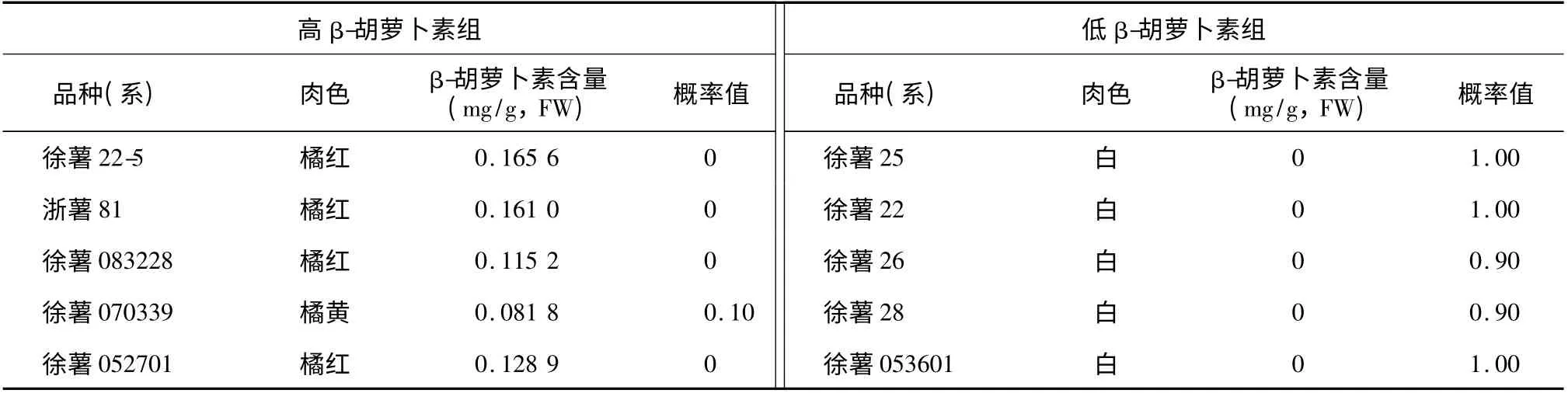
表3 验证甘薯样品表型分类Table 3 The verification of phenotypic classification for β-carotene content in sweetpotato samples
3 讨论
目前,通过多个分子标记建立统计模型来研究甘薯数量性状的方法只有Discrimination 分析与Logistic 回归分析,Logistic 回归分析比Discrimination分析更加精准,用到的分子标记数目更少,应用也更方便[27]。利用分子标记辅助育种的方法有QTL 分析,但QTL 分析需要预先已知甘薯的遗传图谱[28-30];其次,β-胡萝卜素合成基因相关QTL 也有可能分布在甘薯白肉品种中[31],因而这些QTL 不能直接应用到甘薯高β-胡萝卜素育种中;再者,构建遗传图谱和QTL 分析要求建谱亲本纯度高[32],且QTL 分析只适用于亲本的分离群体,而使用多个分子标记构建的Logistic 统计模型则对样品材料无特殊要求。
本研究利用5 个与高β-胡萝卜素含量性状相关的AFLP 分子标记建立Logistic 回归方程,检验徐薯22-5 与徐薯25 的41 个甘薯杂交后代的β-胡萝卜素含量高低是否符合预期的β-胡萝卜素分组,仅2 个样品不符合预期分组,正确率高达95.1%,能够准确预测大多数甘薯样品中β-胡萝卜素含量高低。如果将更多与β-胡萝卜素合成相关的分子标记引入该模型,其正确率完全能够达到100%,使模型达到最优水平。该模型不仅完全通过模型系数的混合检验、对数似然比检验以及Hosmer-Lemeshow 检验,具有较高的拟合度,而且用于构建模型的AFLP 分子标记较之RAPD 和SSR 等分子标记,其多态性高、稳定性好[33]。10 个高(低)胡萝卜素品种(系)全部通过该Logistic 回归模型分析,充分证明了该模型的可靠性。
Delia 等[34]曾指出使用高效液相色谱(HPLC)分析红肉甘薯品种中的类胡萝卜素含量,其中β-胡萝卜素含量最高,其他类胡萝卜素组分含量极低,甚至可以忽略不计。因此,本研究测定甘薯β-胡萝卜素含量的方法,不但简单易行,而且准确度较高。试验中所挑选的甘薯样品依据胡萝卜素含量的高低呈双峰分布,这样不但易于分组,而且使得筛选出的同一个分子标记在2 组样品之间出现的条带数目差异性大,优化Logistic 模型。
由于不同生长发育期,甘薯块根所含β-胡萝卜素含量也有一定的差异,一般表现为生长后期β-胡萝卜素含量高于中、前期[35-36],所以传统育种只有等到甘薯块根成熟后,切开薯块,然后通过肉眼观察甘薯肉色或是测量β-胡萝卜素含量,才能得知该材料是否属于高β-胡萝卜素甘薯品种。但是,这种传统育种方法不但破坏甘薯薯块,而且育种周期长、育种速度缓慢。本试验在注重改善其他农艺性状的同时,结合分子标记辅助育种,在甘薯早代育种过程,特别是在实生苗筛选中,通过田间早期地上部表现结合分子标记手段,在不影响甘薯块根正常生长的情况,提前淘汰不符合育种目标的个体,既减轻工作负担,又提高育种的准确性,从而缩短育种年限。
[1] 陆漱韵,刘庆昌,李惟基. 甘薯育种学[M]. 北京:中国农业出版社,1998.
[2] WEST C E. Vitamin A nutrition:Handout for course in food science and nutrition[D]. Holland,Wageningen:Wageningen Agricultural University,1994.
[3] ANDERSON P,KAPINGA R,ZHANG D,et al. Vitamin A for Africa (VITAA):an entry point for promoting orange-fleshed sweetpotato to combat vitamin A-deficiencyin sub-Saharan Africa[M]//KAPINGA R,KINGAMKONO R,MSABAHA M,et al.Opportunities for poverty alleviation and sustainable livelihoods in developing countries. Tanzania:Proceedings of the 13th ISTRC Symposium,2003:711-720.
[4] WOOLFE J A. Sweet potato:An untapped food resource[M].New York:Cambridge University Press,1992.
[5] LOW J,ARIMOND M,OSMAN N,et al. A food-based approach introducing orange-fleshed sweetpotatoes increased vitamin A intake and serum retinol concentrations in young children in rural Mozambique[J]. J Nutr ,2007,137:1320-1327.
[6] CAZZONELL C I,POGSON B J. Source to sink:regulation of carotenoid biosynthesis in plants[J]. Trends Plant Sci,2010,15(5):266-274.
[7] 后 猛,李 强,马代夫,等. 甘薯主要经济性状的遗传倾向及其相关性分析[J].西北农业学报,2011,20(2):99-103.
[8] MA D F,LI Q,LI X Y,et al. Selection of parents for breeding edible varieties of sweetpotato with high carotene content[J]. Agricultural Sciences in China,2009,8(10):1166-1173.
[9] HALL M R,PHATAK S C. Sweetpotato[Ipomoea batatas (L.)Lam][M]// Kalloo G,Bergh B O. Genetic improvement of vegetable crops. University of California:Pergamon Press,1993:693-708.
[10] UKOSKIT K P G,THOMPSON C E,WATSON J G W. Identifying a randomly amplified polymorphic DNA(RAPD)marker linked to a gene for rootknot nematode resistance in sweetpotato[J].J Amer Soc Hort Sci,1997,122:818-821.
[11] MAHESWARAN M,SUBUDHI P K,NANDI S,et al. Polymorphism,distribution and segregation of AFLP markers in a double haploid rice population[J].Theor Appl Genet,1997,94:39-45.
[12] 蒲志刚,唐 静,王大一,等. 甘薯抗黑斑病材料AFLP 标记分子鉴定初步研究[J].西南农业学报,2008,21(1):93-95.
[13] 揭 琴,李 华,翟 红,等. 甘薯抗茎线虫病基因AFLP 标记的开发[J].农业生物技术报,2008,16(5):837-841.
[14] 揭 琴,姜 伟,李 华,等. 甘薯抗茎线虫病基因的遗传分析及SCAR 标记[J].分子植物育种,2008,6(3):523-526.
[15] JONES A. Sweetpotato heritability and their use in breeding[J].HortScience,1986,21:14-17.
[16] ZHANG Y,STOMMEL J R. RAPD and AFLP tagging and mapping of Beta(B)and Beta modifier(MoB),two genes which influence β-carotene accumulation in fruit of tomato(Lycopersicon esculentum Mill.)[J]. Pheor Appl Genet,2000,100:368-375.
[17] MCHARO M D R,LABONTE J,MCLAURIN W J,et al. Linking quantitative traits with AFLP markers in sweetpotatoes using discriminant analysis[J]. Acta Hort,2004,637:285-293.
[18] MCHARO M D R,LABONTE J. Molecular marker variability for southern root-knot nematode resistance in sweetpotato[J]. Euphytica,2005,144:125-132.
[19] DOUGLAS W,MIANO D R,LABONT J,et al. Identification of molecular markers associated with sweet potato resistance to sweet potato virus disease in Kenya[J]. Euphytica,2008,160:15-24.
[20] 李 强,揭 琴,刘庆昌,等. 甘薯基因组DNA 高效快速提取方法[J].分子植物育种,2007,5(5):743-746.
[21] 李 强,李 鹏,刘庆昌,等. 东亚甘薯品种AFLP 标记遗传差异研究[J].分子植物育种,2008,6(5):905-911.
[22] 张允刚,房伯平. 甘薯种质资源描述规范和数据标准[M].北京:中国农业出版社,2006.
[23] HOSMER D W,LEMESHOW S. Applied Logistic regression[M]. New York:John Wiley & Sons,1989.
[24] 张黎玉,谢一芝. 甘薯块根肉色遗传以及与其它性状的相关性分析[J].江苏农业学报,1988,4(2):30-34.
[25] AMENY M A,WILSONi P W. Relationship between hunter color and b-carotene content in white-fleshed African sweetpotato[J]. J Sci Food Agric,1997,73:301-306.
[26] HAGENIMANA V K,SAMBO L M,CAREYE E. Potential of sweetpotato in reducing vitamin A deficiency in Africa[M] //ZANDSTRA H,VALLE R J,COLLINS W,et al. Impact of a changing word. Peru:International pototo centre(CIP),1998:287-294.
[27] MCHARO M. Associatig molecular markers with phenotypesing sweetpotatoes and liriopogons using multivariate statistical modeling[D]. Baton Rouge:Louisiana State University,2005.
[28] 吴 洁,谭文芳,何俊蓉,等. 甘薯SRAP 连锁图构建淀粉含量QTL 检测[J].分子植物育种,2005,3(6):841-845.
[29] KUAN Y,ANG H,FENG L O,et al. Identification of quantitative trait loci associated with yield-related traits in sweet potato (Ipomoea batatas)[J]. Botanical Studies,2009,50:43-55.
[30] CERVANTES F J C. Development of a genetic linkage map and QTL analysis in sweet potato[D]. Carolina:North Carolina State University,2006.
[31] SOSINSKI B,ECOTA K V,MWANGA R O M,et al. Identification of quantitative trait loci for dry-matter,starch,and b-carotene content in sweetpotato[J]. Mol Breeding,2011,28:201-216.
[32] 方宣军,吴为人,唐记良. 作物DNA 标记辅助育种[J].中国农业科学,2004,37(4):584-587.
[33] ULRICH G,MUELLER L,LAREESA W. AFLP genotyping and fingerprinting[J]. Trends in Ecology & Evolution,1999,14(10):389-394.
[34] DELIA B,RODRIGUEZ A,MIEKO K. HarvestPlus handbook for carotenoid analysis[M]. Washington D C:International Food Policy Research Institute,2004:25-27.
[35] EZELL B D,WILCOX M S,CROWDER J N. Pre-and postharvest changes in carotene,total carotenoids and ascorbic acid content of sweetpotatoes[J]. Plant Physiol,1952,27:355-369.
[36] HAMMETT H L. Total carbohydrate and carotenoid content of sweetpotatoes as affected by cultivar and area of production[J].Hortscience,1974,9(5):467-468.
