高产M onacolin K红曲霉菌种的诱变选育及液态发酵工艺优化
2013-02-21胡文效魏彦锋蒋锡龙史红梅李彦奎刘一凡
胡文效,魏彦锋,蒋锡龙,史红梅,李彦奎,刘一凡
(山东省葡萄研究院,山东济南250100)
我国利用红曲霉的历史悠久,主要是在酿酒中的应用以及利用其红色素对食品着色[1]。1979年日本学者Endo A等[2]发现红曲霉次级代谢产物Monacolin K及其类似物具有羟甲基戊二醛辅酶A(HMG-CoA)还原酶抑制剂的作用。目前Monacolin K已成为各国公认的最佳血脂调节物[3-4],对产Monacolin K红曲霉菌株的选育成为热点,唐伟等[5]对产Monacolin K红曲霉菌株进行了亚硝酸和UV复合诱变,选育出产Monacolin K含量达到18.7mg/L的红曲霉菌株,吴学倩等[6]通过红曲霉原生质体诱变和融合,选育出一株高产Monacolin K菌株,其固体发酵含量可达3328.6μg/g。
桔霉素是一种真菌毒素,1995年法国学者Blanc在红曲霉的发酵物中检测出桔霉素[7],其具有肾毒性、致癌性、致突变等作用[8]。桔霉素副作用的存在严重制约了红曲酶的应用[9],之前的研究只注重Monacolin K的含量,对桔霉素的关注不多。优良菌株是生产高品质、高产量Monacolin K的基础和关键[5],诱变筛选是获得优良红曲霉菌株的有效途径。目前我国红曲霉液态发酵生产Monacolin K的报道和研究不是很多,原因在于液态发酵产量低。但液态发酵也具有自身优点,其规模大且生产过程便于自动化控制,势必将节省生产成本。本研究通过三次诱变,以期筛选出高产Monacolin K且低桔霉素的菌株,并对其液态发酵条件进行研究和探讨。
1 材料与方法
1.1 材料与仪器
大米 市售;出发菌株 实验室分离及购买的红曲霉菌株29株,编号M 1~M 29,红曲霉培养后测定Monacolin K的含量及桔霉素含量,确定以M 2为诱变出发菌株;Monacolin K标准品、桔霉素标准品 Sigma公司;琼脂、葡萄糖、酵母膏、硫酸铵、磷酸二氢钾 国药集团,分析纯;酵母膏葡萄糖琼脂培养基 酵母膏8g,葡萄糖100g,琼脂15g,蒸馏水1000m L,pH自然,121℃灭菌30m in,用于菌种活化;大米培养基 将大米于30℃水中浸泡2h,沥干,分装于500m L三角瓶(100g/瓶)瓶)中,121℃灭菌20m in,趁热打散,冷却备用;限量培养基 葡萄糖1.0g,硫酸铵0.5g,蒸馏水1000m L,pH自然,121℃灭菌30m in,用于红曲霉孢子萌动;液体培养基 葡萄糖60g,蛋白胨25g,酵母膏5g,硫酸铵5g,磷酸二氢钾0.25g,蒸馏水补足1000m L,pH 6.0,121℃灭菌30m in,用于红曲霉产Monacolin K的液态培养。
YXQG02型手提式电热压力蒸汽消毒器 山东新华安得医疗用品有限公司;SW-CJ-ZD型超净工作台 苏州净化设备有限公司;GSP-9160MBE型隔水式恒温静置培养箱 上海博迅实业有限公司;HZQQ型全温振荡器 哈尔滨东联电子技术开发有限公司;Sigma 3-30K型实验室高速冷冻离心机 德国Sigma公司;Infinity 1260型HPLC仪 安捷伦科技有限公司;BILONG2-IIDL型超声波细胞粉碎机 上海比朗仪器有限公司。
1.2 实验方法
1.2.1 Monacolin K的HPLC检测条件 Monacolin K检测的色谱条件参考文献[9]。
检测波长:紫外吸收光谱扫描结果显示Monacolin K在231、238、246nm处有三个特征吸收峰,238nm处吸收值最大,231nm次之。因此HPLC检测时,选238、231nm为吸收峰,其中定性测定时参考238、231nm的图谱,定量测定参考238nm条件下的图谱。
色谱条件:色谱柱C18(5μm,150mm×4.6mm),流动相乙腈:0.1%磷酸(V/V)65∶35,柱温25℃,流速1m L/m in。在以上条件下Monacolin K达到基线分离。称取Monacolin K标准品21.5mg,用无水乙醇溶液溶解定容至100m L容量瓶。精确称取8、6、2、0.5m L、0.2m L定容至10m L,混合均匀。10μL进样测定。以浓度为横坐标,峰面积为纵坐标绘制标准曲线。
1.2.2 桔霉素的检测条件 桔霉素检测色谱条件参考文献[10]。色谱柱:C18柱(250mm×4.6mm,5μm);流动相:甲醇-磷酸水溶液(5.0m L/L)=72-28;流速:1.0m L/m in;荧光检测器,激发波长:331nm;发射波长:500nm。将桔霉素标样质量浓度分别稀释为0.25、0.5、1.0、2.0、5.0μg/m L。以峰面积为纵坐标,桔霉素浓度为横坐标做标准曲线。
1.2.3 Monacolin K提取方法 发酵产物的处理:固体红曲米研磨至20目,液态产物离心弃上清,沉淀物50~60℃烘干,研磨至20目。
提取方法:70%乙醇为提取溶剂,500W超声波细胞破碎15m in,料液比为1∶6。
1.2.4 诱变处理
1.2.4.1 出发菌株孢子悬浮液制备 斜面种子用含0.9%NaCl无菌水洗涤红曲孢子,制备孢子悬浮液[11-12],通过镜检将孢子悬浮液稀释至104~105之间。
1.2.4.2 UV诱变 取0.1m L孢子悬液,涂布于PDA平板,UV 0.3m处照射,设置对照和时间梯度。照射后30℃暗培养7~8d,计算致死率,选择合适处理时间进行诱变选育。
1.2.4.3 LiCl诱变 配制0.2‰~1.6‰LiCl溶液,吸取0.2m L,涂布平板,完全吸收后,取孢子悬液0.1m L涂布,30℃培养7d,计算致死率,选择合适的处理剂量进行诱变选育。
1.2.4.4 硫酸二乙酯+氯化锂复合诱变 将孢子悬液用硫酸二乙酯(1%)处理30~70m in,28℃,置于摇床,150r/min,每10min取样,测得硫酸二乙酯(1%)的致死率,选择合适的处理时间与氯化锂进行复合诱变选育。
1.2.5 发酵条件的单因素实验
1.2.5.1 碳源与氮源的选择 以液体培养基为基础,测定碳源(含量7%)(甘油、葡萄糖、乳糖、大米粉、玉米粉、大米粉水解液、玉米粉水解液),氮源(含量0.5%)(酵母膏、牛肉膏、硝酸钠、蛋白胨、硫酸铵)对Monacolin K含量的影响。5%接种量,30℃,150r/m in培养12d,测定Monacolin K含量。
1.2.5.2 土豆汁或豆芽汁对Monacolin K含量的影响
培养基:甘油7%,大米粉水解液2%,蛋白胨0.5%,土豆汁或豆芽汁补足1000m L,pH 6.0。5%接种量,30℃,150r/m in培养12d,测定Monacolin K含量。
1.2.5.3 镁离子、锌离子对Monacolin K含量的影响培养基:甘油7%,大米粉水解液2%,蛋白胨0.5%,豆芽汁补足1000m L,pH6.0,MgSO(40.1%、0.5%)和ZnSO4(0.2%、0.3%)分别加入。5%接种量,30℃,150r/m in培养12d,测定Monacolin K含量。
1.2.5.4 接种量对Monacolin K含量的影响 培养基:甘油7%,大米粉水解液2%,蛋白胨0.5%,豆芽汁补足1000m L,pH 6.0。不同接种量(3%、4%、5%、6%、7%、8%)接入种子液,培养条件:30℃,150r/m in培养12d,测定Monacolin K含量。
1.2.5.5 摇床转速对Monacolin K含量的影响 培养基:甘油7%,大米粉水解液2%,蛋白胨0.5%,豆芽汁补足1000m L,pH 6.0。接种量5%,30℃,摇床转速(r/m in)分别为100、120、140、160、180、200,培养12d,测定Monacolin K含量。
1.2.5.6 发酵液中甘油含量对Monacolin K含量的影响 培养基:碳源甘油含量分别为6%、7%、8%、9%、10%,大米粉水解液2%,蛋白胨0.5%,MgSO40.1%,ZnSO40.2%,5%接种量,豆芽汁补足1000m L,pH6.0。30℃,150r/m in培养12d,测定Monacolin K含量。1.2.5.7 发酵液中蛋白胨含量对Monacolin K含量的影响 培养基:甘油7%,大米粉水解液2%,MgSO40.1%,ZnSO40.2%,蛋白胨含量梯度分,别为0.25%、0.5%、0.75%、1.0%、1.5%,豆芽汁补足1000m L,pH6.0。5%接种量,30℃,150r/m in培养12d,测定Monacolin K含量。
1.2.5.8 发酵温度对Monacolin K含量的影响 培养基:甘油7%,大米粉水解液2%,蛋白胨0.5%,MgSO40.1%,ZnSO40.2%,豆芽汁补足1000m L,pH 6.0。接种5%,发酵温度分别为26、28、30、32℃,150r/m in培养12d,测定Monacolin K含量。
1.2.5.9 起始pH对Monacolin K含量的影响 培养基:甘油7%,大米粉水解液2%,蛋白胨0.5%,MgSO40.1%,ZnSO40.2%,豆芽汁补足1000m L,用6%HCl和2.0mol/L的NaOH调节液体培养基的pH分别为4.5、5.0、5.5、6.0。5%接种量,30℃,150r/m in培养12d,测定Monacolin K含量。
1.2.6 发酵条件的正交实验优化 选取甘油含量、蛋白胨含量、发酵温度及液体培养基起始pH四个因素进行4水平的正交实验,正交实验因素与水平见表1。

表1 红曲霉培养条件正交因素与水平表Table1 Experimentassignmentof the level and factor of Monascus culture conditions
1.2.7 验证实验及最佳发酵时间的确定 根据单因素及正交实验的结果,在最优培养基和最优发酵条件下对筛选菌株进行发酵实验,发酵14d,每天测定Monacolin K含量。
2 结果与分析
2.1 HPLC法测定Monacolin K和桔霉素的标准曲线
Monacolin K标准曲线图见图1,其回归方程为y= 403.63x+5.4176,R2=0.9998,相关性良好,线性范围为:0.0043~0.172mg/m L。

图1 HPLC法测定Monacolin K含量标准曲线Fig.1 Standard curve of Monacolin K contentmeasured by HPLC
桔霉素标准曲线图见图2,其回归方程为y= 1463438x+69412,R2=0.9998,相关性良好,线性范围为:0.25~5μg/m L。
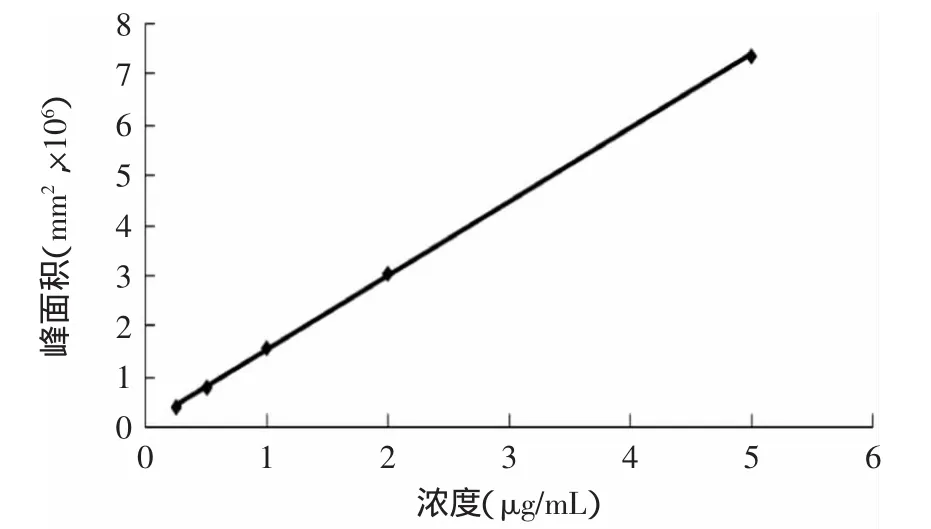
图2 HPLC测定桔霉素含量标准曲线图Fig.2 Standard curve of citrinin contentmeasured by HPLC
2.2 菌种的诱变
2.2.1 诱变剂的确定 由表2可知,UV处理5m in、 1.2‰氯化锂诱变以及1%硫酸二乙酯处理60m in时的致死率分别为97.1%、98.7%和98.1%。

表2 诱变剂的确定Table2 The determination ofmutagen
2.2.2 UV诱变菌株的筛选 UV诱变处理后,获得48株变异菌株,编号:Mu-1~Mu-48。5株菌株Monacolin K产率提高且桔霉素含量较低(见表3),其中Mu-29菌株Monacolin K产量最高且桔霉素的量最低,故选择其为氯化锂诱变的出发菌株。

表3 UV处理突变株的Monacolin K和桔霉素含量Table3 Contents of Monacolin K and citrinin in mutant strainsmutagenized by UV
2.2.3 氯化锂诱变菌株的筛选 氯化锂诱变后,获得变异菌株35株,编号:ML-1~ML-35,其中5株Monacolin K产率提高明显,且桔霉素含量较低(见表4),菌株ML-21的Monacolin K产量最高,达0.957mg/g,故以ML-21为出发菌株进行硫酸二乙酯诱变。

表4 氯化锂突变株的Monacolin K和桔霉素含量Table4 Contents ofMonacolin K and citrinin in mutant strainsmutagenized by LiCl

表5 复合诱变菌株的Monaco1in K和桔霉素含量Table5 Contents ofMonacolin K and citrinin in mutant strainsmutagenized by LiCl and diethyl sulfate
2.2.4 硫酸二乙酯+氯化锂复合诱变菌株的筛选 获得3株突变株,其Monacolin K的含量提高明显且桔霉素含量较低,其中MS-12产率提高最大(见表5),故选择其为选育的目的菌株。

表6 碳源对红曲霉产Monacolin K的影响Table6 Effectof carbon sources on Monacolin K contentof Monascus
2.3 发酵条件优化
2.3.1 液态发酵最佳碳源的确定 碳源是微生物生长代谢最重要的营养物质之一,它是构成菌体和代谢物、为菌体生命活动提供能量的最重要的物质。7种单一碳源实验的结果见表6,甘油是最有利于提高Monacolin K产量的单一碳源,产量为86.1μg/m L,大米水解液次之为56.2μg/m L。根据单一碳源的实验结果选择3种复合碳源,其他条件不变进行发酵实验,其中甘油7%+大米粉水解液2%作为复合碳源,Monacolin K的产量达到124.2μg/m L(见表6)。可能是甘油+大米粉水解液更有利于红曲霉MS-12菌株的生长和次生代谢产物的生成,故选择其为红曲霉发酵的碳源。
2.3.2 液态发酵最佳氮源的确定 氮源是构成菌体细胞中核酸、蛋白质和细胞质的主要成分,也是合成各种含氮代谢产物的重要原料。由表7可知,蛋白胨为氮源时的产量最高为123.4μg/m L,其次是酵母膏和牛肉膏。无机氮源硝酸钠和硫酸铵目标产物的产量都比较低,可能是有机氮为迟效氮源,这种利用方式不易产生某些代谢产物的过分积累而阻碍目的物质的产生,即代谢产物的阻遏作用。因此确定蛋白胨为最佳的氮源。

表7 氮源对红曲霉产Monacolin K的影响Table7 Effects of nitrogen sources on Monacolin K contentof Monascus

表8 添加土豆汁或豆芽汁对红曲霉产Monacolin K的影响Table8 Effectofmurphy juice and bean sprouts juice on Monacolin K contentof Monascus
2.3.3 土豆汁或豆芽汁对红曲霉菌株MS-12产Monacolin K的影响 分别以蒸馏水、土豆汁和豆芽汁配制的液体培养基发酵MS-12其Monacolin K产量见表8,土豆汁和豆芽汁都可不同程度地提高目标产物的产量,特别是豆芽汁中含有的丰富的氨基酸和维生素等物质,能够更好地促进Monacolin K的产生。其中采用豆芽汁目标产物产量提高较大,产量达到142.1μg/m L,故选择豆芽汁配制红曲霉液体发酵培养基。
2.3.4 MgSO4和ZnSO4对红曲霉M 2菌株产Monacolin K的影响 镁离子是许多酶的激活剂,锌是乙醇脱氢酶和乳酸脱氢酶的辅基。它们的存在可能会在微生物的代谢过程中起着特殊的作用,对菌体的生长和次生代谢产物产生有一定的作用。由表9可以看出,添加MgSO4和ZnSO4对Monacolin K的产量都有提高,其中0.1%MgSO4和0.2%ZnSO4对Monacolin K的产量提高较大,确定该浓度为两种硫酸盐的添加浓度。
2.3.5 不同接种量对Monacolin K产量的影响 由图3可知,接种量为6%时目标产物的产量最高为137.9μg/m L。接种量低时,Monacolin K积累较少,可能由于培养基营养成分相对丰富,有利于菌体的生长而不利于Monacolin K的积累。较大的接种量可缩短生长达到高峰的时间,使产物的合成提前,且种子液多时其胞外水解酶类含量也多,利于基质的利用及Monacolin K的产生和积累。而接种量过大,菌种生长过快,对发酵后期次级代谢产物Monacolin K积累有一定的阻遏作用,其Monacolin K的生成量也相对较低。故最佳接种量为6%。
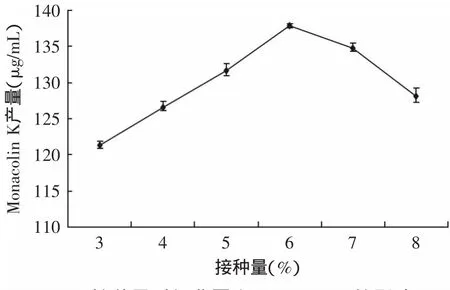
图3 接种量对红曲霉产Monacolin K的影响Fig.3 Effectof inoculum size on Monacolin K content of Monascus

表9 MgS04和ZnSO4对红曲霉产Monacolin K的影响Table9 EffectofMgSO4 and ZnSO4 on Monacolin K contentof Monascus
2.3.6 发酵摇瓶转速对Monacolin K产量的影响 红曲霉是一种好气性微生物,发酵过程中需向发酵培养基中不断通入净化过滤后的空气,保证发酵液中溶氧的含量,并使溶解氧分布均匀是菌体生长繁殖的重要条件。从图4可知,并非转速越大,Monacolin K的产量越高,转速为140~160r/m in时,Monaco1in K的产量较大。转速过大,虽能增加溶解氧含量,提供红曲霉足够的营养成分。但因机械损伤加大或菌体呈现团块状生长而影响其菌体的自由蔓延,从而导致生长的生物量降低。故最佳转速为150r/min。

图4 转速对红曲霉产Monacolin K的影响Fig.4 Effectof the rotate speed on Monacolin K content of Monascus
2.4 红曲霉液态发酵单因素实验
2.4.1 发酵液中甘油含量对Monacolin K含量的影响
液体发酵培养基中甘油含量对Monacolin K含量的影响见图5,蛋白胨含量增加,产物的含量随之增加,但当甘油含量10%时,产物含量降低,可能因为碳氮比过高,菌体代谢不平衡,造成产物积累下降。

图5 甘油含量对红曲霉产Monacolin K的影响Fig.5 Effectof glycerol contenton Monacolin K content of Monascus
2.4.2 发酵液中蛋白胨含量对Monacolin K含量的影响 液体发酵培养基中蛋白胨含量对Monacolin K含量的影响见图6,随着蛋白胨含量的增加,Monacolin K产量增加,但蛋白胨含量大于1%时,蛋白胨含量增加,产物的含量在减少。这是因为对微生物培养时,碳氮比过高过低都不利于微生物的生长,碳氮过低菌体提前自溶,碳氮比过高菌体代谢不平衡,不利于代谢产物的积累。故蛋白胨含量1%为适合浓度。
2.4.3 发酵温度对Monacolin K含量的影响 不同发酵温度下液态发酵物中Monacolin K的含量见图7,随着温度的升高,Monacolin K含量增高,在30℃时达到最高值,32℃产物的含量下降。这是因为温度低时红曲霉的生长和代谢都慢,产物积累少;而温度过高时,红曲霉生长快,达到对数期早,菌体自溶也早,不利于产物积累。
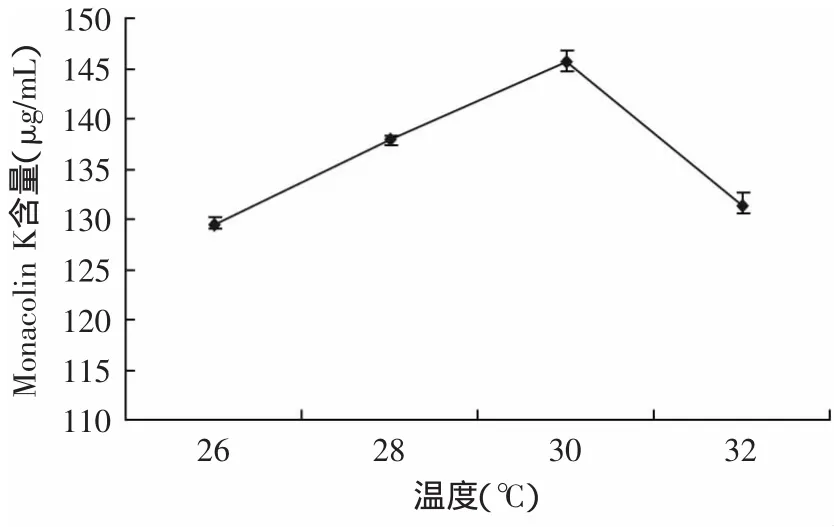
图7 发酵温度对红曲霉产Monacolin K的影响Fig.7 Effectof fermentation temperature on Monacolin K contentof Monascus
2.4.4 起始pH对Monacolin K含量的影响 不同起始pH条件下Monacolin K含量见图8,产物含量在pH 5.0时最高,pH升高或降低,产物的含量都呈降低趋势,说明pH 5.0时红曲霉的生长代谢适合产物Monacolin K的积累,是最适起始pH。

图8 起始pH对红曲霉产Monacolin K的影响Fig.8 The effectof pH on Monacolin K contentof Monascus
2.5 正交实验
选取甘油含量、蛋白胨含量、发酵温度及液体培养基起始pH四个因素进行正交实验,正交实验结果见表10。
由表10可知,各因素中发酵温度对发酵产物中Monacolin K的含量影响最大,发酵液中甘油的含量次之,再次是发酵液中蛋白胨的含量,发酵液起始pH影响最小,即C>A>B>D。最优发酵条件组合为A4B3C2D3,即甘油含量9%,蛋白胨含量1.0%,发酵温度30℃,发酵液起始pH 5.0。

表10 红曲霉发酵正交实验结果Table1 0 Results of orthogonal testof Monascus fermentation
2.6 验证实验及液态发酵时间的确定
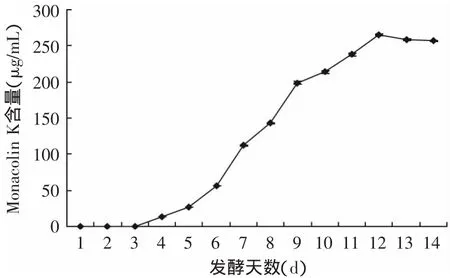
图9 不同发酵时间Monacolin K含量Fig.9 Monacolin K contents at different fermentation time
根据单因素实验和正交实验结果,确定发酵培养基:甘油含量9%,大米水解液2%,蛋白胨含量1.0%,硫酸镁0.1%,硫酸锌0.2%,磷酸二氢钾0.25%,豆芽汁补至1000m L,pH 5.0,加入0.1mol/L的EDTA 40μL[13]。接种量6%,发酵温度30℃,摇床转速150r/m in。发酵14d,每天测定Monacolin K含量。结果见图9,Monacolin K含量在12d时达到最高为264.7μg/m L,12d后Monacolin K含量逐渐降低,由此可知,红曲霉的最佳发酵时间为12d,Monacolin K最高产量为264.7μg/m L,此时桔霉素含量仅为0.026ng/m L。
3 结论
通过UV诱变、氯化锂诱变以及硫酸二乙酯与氯化锂复合诱变三次诱变选育,筛选出红曲霉突变菌株MS-12,其固态发酵Monacolin K产量为1.346mg/g,提高显著,且MS-12菌株与出发菌株相比桔霉素含量变化不大。经过发酵条件的优化,MS-12在液态发酵条件下Monacolin K的含量达到264.7μg/m L,而桔霉素的含量仅为0.026ng/m L。
[1]刘颖,林亲录.红曲霉菌株选育的研究进展[J].现代食品科技,2006,22(3):280-283.
[2]Endo A,Monacolin K.A new hypocholesterolemic agent produced by a Monascus species[J].JAntibiotics,1979,32(8):852-854.
[3]宋洪涛,宓鹤鸣,郭涛.中药红曲的研究进展[J].药学实践杂志,1999,17(3):172-174.
[4]黄群,麻成金,余佶等.产Monacolin K红曲霉筛选及响应面法优化发酵条件[J].食品科学,2011,32(21):177-182.
[5]唐伟,陈菲.产Monacolin K的红曲霉菌株的诱变选育[J].江苏农业科学,2013,41(2):306-308.
[6]吴学倩,汪安芳.红曲霉菌的原生质体紫外诱变与融合选育及Monacolin K检测[J].食品与发酵科技,2011,47(6):44-49.
[7]Blanc PJ,JPLaussac.Characterization ofMonascidin A from Monascusascitrinin[J].International Journalof Food Microbiology,1995,27:201-213.
[8]Betina V.Mycotoxins-Production,Isolation,Separation and Purificution[M].Amsterdam:Elsevier,1983:217-236.
[9]朱华,许赣荣,陈蕴.HPLC法测定红曲中酸型与内酯型Monacolin K[J].无锡轻工大学学报,2003,22(3):46-52.
[10]班昭,王昌禄,陈勉华,等.红曲霉发酵液中桔霉素快速检测方法的优化[J].氨基酸和生物资源,2010,32(2):70-73.
[11]石鹤,艾凌燕.红曲霉菌种的筛选[J].广州食品工业科技,2004,20(3):67-68.
[12]赵树欣,陈云,许春英,等.界面上红曲霉的生长及Monacolin K的产生[J].食品与发酵工业,2003,29(5):11-14.
[13]赖卫华,龚春来,黄秋阳.红曲霉培养过程中桔霉素积累规律的初步研究[J].食品工业科技,2003,24(7):28-29,32.
