乳清多肽螯合钙的制备与结构表征
2013-02-21黄立新赵璧秋
肖 珊,黄立新,赵璧秋
(1.华南理工大学轻工与食品学院,广东广州510640;2.广州市华侨糖厂,广东广州510280)
钙为人体内含量最多的一种无机元素,所有的生命过程基本上均需要钙的参与[1-2],缺钙可导致人体产生骨质疏松、佝偻症等多种疾病[3]。到目前为止,经中国食品药品监督管理局批准的钙制剂保健食品有近900个,钙类药品达1740多个[4]。尽管补钙产品种类丰富,但钙的生物利用度低,导致补钙效果与补钙量不成正比,寻找新技术改善补钙制剂的补钙效果倍受国内外的关注。导致人体缺钙的主要原因有:在正常人中,钙结合蛋白对钙的转运能力是一个常量,单纯依靠钙结合蛋白为细胞内提供钙并不能满足机体需要;离子钙在胃、小肠的酸度条件下,Ca2+易生成不溶物,导致其吸收率下降[3-5]。
Agar(1953)[6]、Adibi(1984)[7]、Hara(1984)[8]、Rerat(1988)[9]的实验结果证实了“小肽优先吸收理论”:小肽中氨基酸残基的吸收速率要大于等量游离氨基酸的吸收速率。依此,国内外的科研者们陆续展开了小肽与钙螯合反应的研究,并得到“小肽与钙螯合,不易饱和,吸收速度快,耗能低,更有利于提高钙的生物学效价”的结果[10-15]。
乳清蛋白被誉为是“蛋白之王”,具有高吸收性、完整的氨基酸成分、低脂肪和胆固醇的特点[16],是当今最常见的蛋白质补充产品之一[17]。目前,国内外科研者多以鱼骨架、牛骨、鸡羽毛、鸡肉、豆粕、米渣、血粉、蛋清等为原料,水解制得蛋白肽,与钙螯合后得到“蛋白肽螯合钙”。本文以乳清蛋白为原料制取多肽,再与钙盐反应制得乳清多肽螯合钙,为多肽螯合钙产品的研发提供参考。
1 材料与方法
1.1 材料与仪器
浓缩乳清蛋白WPC80 美国Hilmar公司;碱性蛋白酶(酶活>200000U/g) 北京奥博星生物技术有限责任公司;无水氯化钙、氢氧化钠、乙醇(95%) 分析纯。
pHS-3C精密pH计 上海雷磁;FA2004B电子天平 上海精密科学仪器有限公司;SHA-B水浴恒温振荡器 金坛市医疗仪器厂;恒温水浴锅 北京永光明医疗仪器厂;TDL-5-A离心机 上海安亭(飞鸽);NICOLET-6700红外光谱仪 美国Thermo Fisher Scientific公司;UV500紫外可见分光光度计 英国UNICAN;X’Pert PRO X-射线衍射光谱仪 荷兰帕纳科公司;TGA Q500热重分析仪 美国Waters公司;Hitachi S3700N扫描电镜 H itachi公司。
1.2 实验方法
1.2.1 乳清多肽的制备 配制一定浓度的乳清蛋白溶液(5g/100m L),调节pH至10.5,60℃恒温10m in,加入蛋白酶0.3g,振荡水解5h。水解结束后置沸水浴中灭酶10min,取出迅速冷却,50℃烘干、研磨(至过80目筛)。测得乳清多肽水解度约30%。
1.2.2 乳清多肽螯合钙的制备与提纯 配制浓度为2%的乳清多肽溶液,NaOH溶液调节pH,加入钙盐,搅拌溶解,在恒温振荡水浴中反应一定时间,用反应液15倍以上体积乙醇沉淀,3500r/m in离心10m in收集沉淀,乙醇洗涤至上清液加入钙指示剂不变色(仍显示蓝色),加入茚三酮指示剂加热后不变紫,50℃烘干,研磨拌研磨(至过100目筛)得产品[18-19]。
1.2.3 合成乳清多肽螯合钙的单因素实验 实验中以0.06g乳清多肽配制成30m L水溶液为基础,溶液分别以钙盐质量(0.01、0.2、0.3、0.6、1.0、1.2、1.5、2.0、3.0、4.0g),溶液初始pH(5、6、7、8、9、10、11、12),反应温度(35、45、55、60、65、75℃),时间(5、10、20、30、40、50、60min)为影响因素,以钙含量或螯合率为指标,考察各因素对螯合钙反应的影响。反应基本条件依次为:pH 8、60℃、反应时间60m in、钙盐质量1.2g。
1.2.4 合成乳清多肽螯合钙的正交实验 根据单因素实验结果选取合适的因素水平,以钙螯合率为指标,设计四因素三水平正交实验,因素水平见表1。

表1 乳清多肽螯合钙合成的正交实验因素水平表Table1 Factors and levels ofwhey polypeptide chelating calcium orthogonal experiment
1.2.5 钙螯合率的测定
1.2.5.1 钙含量的测定方法 参照GB/T 5009.92-2003食品中钙的测定中的滴定法(EDTA法)[20]。其中10g/L氰化钠溶液用三乙醇胺溶液(与蒸馏水体积比1∶2)替代,每次滴定前加入2~3m L。
1.2.5.2 总钙含量的测定 准确移取0.1m L反应液于三角瓶中,加入50m L蒸馏水,加入2~3m L三乙醇胺(1∶2),摇匀,用滴定管加0.8~1m L 1.25mol/L氢氧化钾溶液至pH为12~13,摇匀,加入适量钙指示剂,摇匀,立即以稀释10倍EDTA溶液(已标定每m L EDTA相当于0.0456mg Ca)滴定,至溶液由紫红色变纯蓝色为止,记EDTA溶液体积V0。按公式(1)可计算可得总钙含量M0(g):

1.2.5.3 螯合钙含量的测定 准确移取1m L反应液于50m L离心管中,加入20m L乙醇,温水浴中振摇1h,3500r/m in离心10m in,弃上清液,沉淀定容至20m L溶液,取2m L溶液EDTA滴定,同1.2.5.2步骤,记EDTA溶液体积V1。可按公式(2)得螯合钙含量M1(g):

1.2.5.4 钙螯合率 计算方法如公式3所示:

式中:M0、M1分别表示0.1m L反应液中总钙的含量、螯合钙的含量(g)。
1.2.6 乳清多肽螯合钙的表征
1.2.6.1 扫描电镜和能谱分析 乳清多肽与乳清多肽螯合钙粉末分别用扫描电镜观察拍摄样品形态,并在加速压20.00kv的条件下进行能谱分析。
1.2.6.2 红外光谱分析 采用KBr压片法,累加扫描次数32次。
1.2.6.3 紫外光吸收曲线 配制浓度为1%的乳清多肽与乳清多肽螯合钙溶液,于波长190~350nm下扫描。
1.2.6.4 钙含量分析 精确称取约0.0100g的乳清多肽与最佳工艺条件下合成的乳清多肽螯合钙,溶解在5m L容量瓶中定容。取2m L溶液,采用1.2.5中EDTA滴定法测定钙含量,计算得到样品中钙的质量分数。
1.2.6.5 TGA热重分析 样品质量约2.5mg。氮气流量:天平40m L/m in,样品60m L/min,升温速率为:30℃/m in,温度范围为40~1000℃。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 钙盐用量的影响 乳清多肽螯合钙反应的理想情况是一定量的乳清多肽能与尽可能多的钙离子发生螯合,亦即所得单位质量产物中钙离子含量最多。螯合反应产物中钙离子含量(%)与加入钙盐质量(g)的变化关系如图1所示。
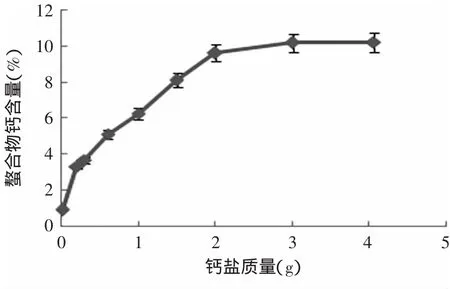
图1 钙盐质量对螯合产物中钙含量的影响Fig.1 Effectof calcium ion weighton the Ca2+content in product
由图1可知,在0.01~2g内,随着钙盐加入越多,螯合产物中钙含量也逐渐增加。当钙盐质量增至3~4g间,螯合产物中钙含量趋于不变。因此,确定加入钙盐的质量在3g左右,此时螯合物中的钙含量约为10%。
2.1.2 反应液初始pH的影响 由图2可知,随着反应初始pH升高,钙离子螯合率呈现先增加后降低的趋势。当初始反应液为酸性时,溶液中H+较多,会抑制多肽-COOH中的H+电离(式4),同时易使-NH2结合一个H+而带上正电(式5),阻碍二者与钙离子的螯合反应,因此钙螯合率较低。与此相反,当初始反应液呈碱性时,溶液中OH-较多,有利于肽-COOH中的H+电离及-NH2失去一个H+而带上负电(式6),均有利于二者与钙离子的螯合反应,因此钙螯合率逐渐增大。但当初始反应液pH超过11左右时,钙螯合率又减少了,这是由于在强碱性条件下钙离子与过多的OH-形成CaOH沉淀,而参与螯合反应的Ca2+减少了。综合实验和以上的理论分析,适宜的初始反应液pH为10~11。


图2 反应液初始pH对钙离子螯合率的影响Fig.2 Effectof the initial pH of reaction liquid on Ca2+chelating rate
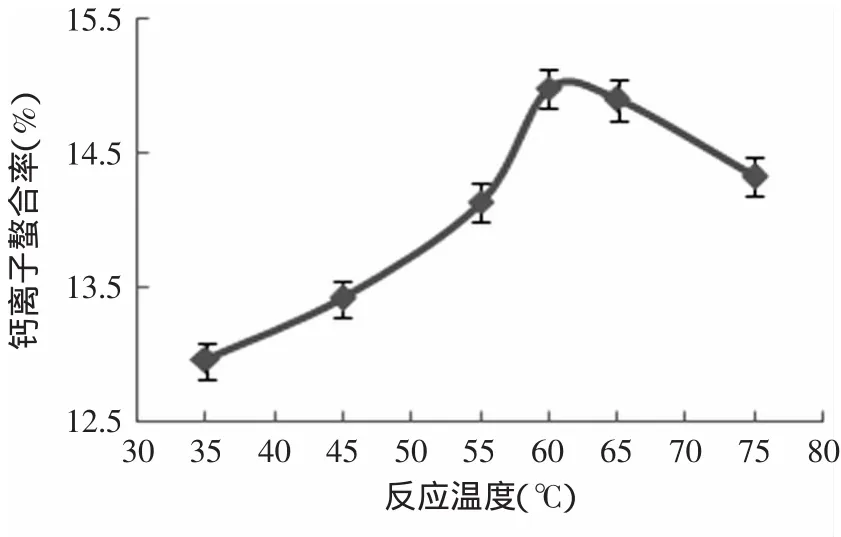
图3 反应温度对钙离子螯合率的影响Fig.3 Effectof reaction temperature on Ca2+chelating rate
2.1.3 反应温度的影响 实验如图3所示。随着反应温度的升高,钙离子螯合率呈现先增加后减少的趋势。反应温度在35~65℃时,温度越高,钙离子螯合率越大,这是由于分子及离子热运动加强,使反应物间碰撞并发生螯合的几率增大。而当温度大于65℃时,乳清多肽分子可能发生变性,部分团聚,导致能与钙离子的反应的基团变少,钙离子螯合率便降低。综合以上因素,选择合成的适宜温度约60~70℃。
2.1.4 反应时间的影响 结果见图4。可见随着反应时间的延长,钙离子螯合率逐渐增大,而后趋于平缓。当反应时间在5~20m in间时,钙离子螯合率迅速增加;而后40~50m in时,钙离子螯合率趋于稳定。因此,确定反应时间在40~50m in较适宜。

图4 反应时间对钙离子螯合率的影响Fig.4 Effect of reaction time on Ca2+chelating rate
2.2 正交实验结果及分析
正交实验结果见表2。各因素对结果的影响为:钙盐量>反应时间>温度=溶液初始pH,优化后的因素水平组合为A2B2C1D3,即当乳清多肽溶液质量溶度为2%时,反应温度65℃,溶液初始pH 10.5,钙盐质量为3g(乳清多肽与钙盐质量比为1∶5),反应时间50m in。验证实验结果显示:此最优条件下钙螯合率为7.45%。

表2 乳清多肽螯合钙合成的正交实验结果Table2 Orthogonal experiment resultofwhey polypeptide chelating calcium
2.3 乳清多肽螯合钙的表征
2.3.1 乳清多肽螯合钙扫描电镜 乳清多肽粉末与乳清多肽螯合钙粉末的扫描电镜图见图5、图6。由图可见乳清多肽的表面呈多孔状,这可能是由乳清多肽水解液在干燥过程中水分汽化逸出时形成的小气孔;能谱分析确定乳清多肽中含有Ca、K、S、P、Na等元素,其中Ca含量较少。其次,乳清多肽螯合钙颗粒大小不一,无定形状,表面粗糙,为交织团状的结构。能谱分析确定乳清多肽螯合钙中含有Ca、Cl、S、P、Na等元素,其中Ca元素的含量较乳清多肽明显增多。

图5 乳清多肽电镜显微照片(10000×)及其能谱图Fig.5 Electronmicroscopy(10000×)and energy spectrum diagram ofWhey peptides

图6 乳清多肽螯合钙电镜显微照片(10000×)及其能谱图Fig.6 Electronmicroscopy(10000×)and energy spectrum diagram ofwhey polypeptide chelating calcium

图7 乳清多肽与乳清多肽螯合钙的红外光谱对比分析Fig.7 Infrared spectrum analysis ofwhey peptides and whey peptides chelating calcium
2.3.2 红外光谱分析 乳清多肽与乳清多肽螯合钙样品的红外光谱图见图7。乳清多肽的红外光谱见上方曲线,在特征区,-NH2的吸收峰在3386cm-1;指纹区,C=O的吸收峰在1647cm-1,-COO-的吸收峰在1397cm-1。乳清蛋白肽螯合钙的红外光谱见下方曲线,在特征区,-NH2的吸收峰移动到了3392cm-1,发生了变化,说明乳清蛋白水解肽中的-NH2键发生了的化学反应;在指纹区,C=O的吸收峰红移至1649cm-1,-COO-的吸收峰红移至1416cm-1,可见,-COO-键也发生了的化学反应,表明氨基和羧基均参与了钙的螯合反应。
2.3.3 紫外光吸收曲线 乳清多肽与乳清多肽螯合钙溶液紫外光吸收曲线见图8。前者的出峰波长为212、280nm;而乳清多肽螯合钙溶液的出峰波长为203nm,在280nm处的峰则大大减弱。乳清多肽与钙离子螯合后,第一个特征峰由212nm移到203nm,这也证实了乳清多肽中某些基团发生了反应。

图8 乳清多肽与乳清多肽螯合钙的紫外吸收曲线Fig.8 Ultraviolet absorption curve ofwhey peptides and whey peptides chelating calcium
2.3.4 钙含量分析 乳清多肽与乳清多肽螯合钙的钙含量的测定结果见表3,乳清多肽中原本含有少量的钙,加入钙盐与之反应后大大增加了钙的含量,结果与2.3.1的能谱检测结果一致。
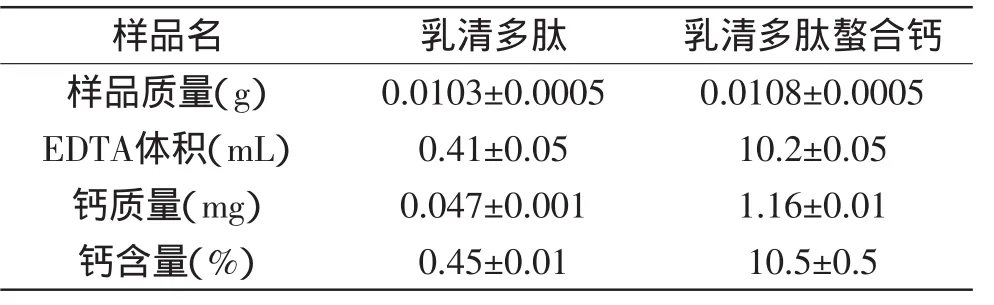
表3 乳清多肽与乳清多肽螯合钙的钙含量分析Table3 Calcium content analysis ofwhey peptides and whey peptides chelating calcium
2.3.5 TGA热重分析 乳清多肽与乳清多肽螯合钙的质量随温度变化曲线见图9。随温度的升高,样品质量逐渐减少。105℃前主要是水分的散失,二者水分含量相近,约3%~5%。当温度高于200℃时,有机成分开始逐渐分解,由图9可见,当二者质量分数最低点趋于不变时,乳清多肽螯合钙所需温度(907℃)比乳清多肽所需温度(629℃)高许多,这说明乳清多肽与钙离子螯合后分子间及分子内的作用力更大了,因此,要破坏此作用力使分子分解所需的温度也就更高。热重检测结果可得乳清多肽的灰分含量约为4.82%,乳清多肽螯合钙的灰分含量约为14.67%,后者比前者灰分含量高出10%左右,主要为钙元素的含量,这一结果与2.3.1与2.3.4中的结果具有一致性。

图9 乳清多肽与乳清多肽螯合钙TGA热重曲线Fig.9 TGA thermogravimetric curve ofwhey peptides and whey peptides chelating calcium
3 结论
当乳清多肽溶液质量溶度为2%时,乳清多肽螯合钙合成的最佳工艺为:乳清多肽与钙盐质量比为1∶5,多肽溶液初始pH为10.5,反应温度为65℃,反应时间为50m in,此最优条件下钙螯合率为7.45%,所得产物Ca2+含量为10.5%±0.5%。当乳清多肽与钙离子发生螯合反应后,产物显微可见表面的多孔状结构及微小的颗粒,官能团-NH2、-COO-的红外吸收峰会发生偏移,紫外光吸收曲线的波峰也会发生偏移;TGA热重分析表明乳清多肽螯合钙需要较高的温度才能分解。
[1]周聪,刘洪升,高丽花.钙强化饮料中钙含量及其稳定性实验[J].热带农业工程,2003,3(10):24-26.
[2]杨堤林.补钙的科学[J].家庭中医药,2004,2(4):56.
[3]韩樱,何慧,赵宁宁,等.蛋清肽-钙配合物体内促钙吸收作用研究[J].食品科技,2012,33(11):262-265.
[4]蒋金来,王令充,吴皓,等.钙制剂研究进展[J].食品工业科技,2012,33(11):379-382.
[5]Bronner F.An analysis of intestinal calcium transport acrossrat in stestine[J].JNutr,1995,125(5):1971-1979.
[6]AgarWT,Hird FJ,Sidsu GS.The active absorption of amino acids by the intestine[J].JPHysiol,1953,121(5):255-263.
[7]Adibi AS.Intestinal phase of protein as simulation inman[J].America Nutrition,1984,25(6):1114-1122.
[8]Hara H,FunabikiR,Iwata M,etal.Prota labsorption of small peptides in rats under undrestraied Condi-tions[J].JNutr,1984,114(8):1122-1129.
[9]Rerat A.Amino acid absorption and production of pancreatic hormoned in non-anaesthetized pigs after duodenal infusions of amilk enzymie hydrolysate or of free amino acids[J].Brit JNutr,1988,60(6):121-136.
[10]Malin M.Metal-binding proteins and peptides in bioremediation and phytoremediation of heavy metals[J].Trends in Biotechnology,2001,2(9):369-381.
[11]Fisher AEO,Naughton DP.Metal ion chelating peptideswith superoxide dismutase activity[J].Biomedicine&Pharmacotherapy,2005,59(4):156-162.
[12]李彦春.酶解胶原蛋白多肽的制备与分析[J].中国皮革,2004,3(3):20-24.
[14]Jung WK,Lee BJ,Kim SK.Fish-bone peptide increases caleium solubility and bioavailability in ova-riectomised rats[J].Brit JNutr,2006,95(8):124-128.
[15]李翠芹,何腊平,仇保权.氨基酸螯合钙的研究进展[J].食品研究与开发,2011,32(10):162-164.
[16]卢晓明,王静波,任发政,等.乳清蛋白在食品工业中的应用[J].食品科学,2010,31(1):262-267.
[17]韩婷,蔡东联.乳清蛋白的营养特点和作用[J].肠外与肠内营养,2005,12(4):243-246.
[18]付文雯.牛骨胶原多肤鳌合钙的制备及其结构表征[D].武汉:华中农业大学,2010.
[19]魏凌云,钱建强,魏鹏,等.谷氨酸螯合钙的合成条件研究[J].氨基酸和生物资源,2009,31(3):43-46.
[20]GB/T 5009.92-2003.食品中钙的测定[S].
