超声和水提法提取灵芝多糖的结构和抗氧化性的比较研究
2013-02-21刘钧发冯梦莹游丽君赵强忠赵谋明
刘钧发,冯梦莹,游丽君,*,罗 维,赵强忠,赵谋明
(1.华南理工大学轻工与食品学院,广东广州510640;2.华南理工大学分析测试中心,广东广州510640)
灵芝(Ganoderma lucidum)又称芝草、神芝、灵芝草、仙草,属于担子菌门担子菌纲多孔菌科灵芝属。早在两千年前就应用于中医,作为一种珍贵药材,有很高的药用价值。如《本草纲目》中记载,灵芝“甘温无毒,主治耳聋,利关节,保神,益精气,坚筋骨,好颜色,疗虚劳,治痔”。多糖是灵芝的主要活性成分,根据目前的研究,灵芝多糖主要具有抗癌,抗肿瘤,抗衰老,提高机体免疫力,降血糖等活性。如Liyan等[1]通过MTT方法研究灵芝多糖的GP-1和GP-2两种纯化组分,发现该两种组分均能够刺激巨噬细胞的增殖和胞饮能力,从而提高机体的免疫力。Chen等[2]通过对比正常小鼠,子房癌小鼠和经灵芝多糖治疗的子房癌小鼠的血清抗氧化酶的活性,发现经多糖治疗的子房癌小鼠的MDA(丙二醛)的数量减少,血清抗氧化酶的活性提高,抑制子房癌细胞。
目前,灵芝多糖的提取方法主要有热水提取法,酶解提取法,微波提取法以及超声提取法。由于不同的提取方法,所得到的灵芝多糖的结构以及活性都有所差异。因此,本研究通过采用超声和传统水提法制备灵芝多糖,对比两种方法所得多糖的性质差异,测定了得率、分子量、表面形态、单糖组成、抗氧化活性等,旨在为灵芝多糖的高效制备提供参考。
1 材料与方法
1.1 材料与仪器
云南的赤灵芝子实体 由无限极(中国)有限公司提供;DPPH·、Trolox、FL及APPH· 购于Sigma公司;其他试剂 均为分析纯。
GL-21M型高速冷冻离心机 长沙湘仪离心机有限公司;UV-2100型紫外可见分光光度计 广州市广一科学仪器有限公司;KQ5800型超声清洗器 东莞市科桥超声波仪器有限公司;荧光酶标仪Varioskan Flash 美国Thermo公司;Breeze高效凝胶渗透色谱仪 美国Waters公司;TDL-5-A型台式飞鸽离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 原料预处理 先将灵芝子实体粉碎,得到的灵芝粉末再按料液比1∶6(w/v)的比例加入95%乙醇,在微沸的状态下回流3h,除去色素及其他一些醇溶性杂质。然后过滤,得到的滤渣置于烘箱中,把乙醇挥发干,得到的灵芝粉备用。
1.2.2 超声提取灵芝多糖的制备 处理后的灵芝粉32g,并以蒸馏水为溶剂,按料液比1∶25,在超声条件为480W,70℃,52m in,对灵芝进行超声提取。超声的溶液进行减压抽滤,所得滤液在56℃下旋转蒸发浓缩。浓缩液中快速加入4倍体积的95%乙醇并不断搅拌,在4℃冰箱下冷藏过夜后,于4800r/m in、20m in的条件下进行离心,弃去上清液,取沉淀,将多余的乙醇挥干,用水复溶,即为超声提取的灵芝多糖溶液。
1.2.3 水提灵芝多糖的制备 处理后的灵芝粉32g,并以蒸馏水为溶剂,按料液比1∶25,在100℃下回流2h,然后进行减压抽滤,所得滤渣,再按上述条件重复一次,所得两次滤液合并,在56℃下旋转蒸发浓缩。浓缩液中快速加入4倍体积的95%乙醇并不断搅拌,在4℃冰箱下冷藏过夜后,于4800r/min、20min的条件下进行离心,弃去上清液,取沉淀,将多余的乙醇挥干,用水复溶,即为水提的灵芝多糖溶液。
1.2.4 多糖含量的测定 采用苯酚—硫酸法[3]来测定灵芝多糖的含量,并以葡萄糖为标准物作标准曲线。
多糖得率(%)=溶液中多糖含量(g)/原料质量(g)×100
1.2.5 分子量的测定
1.2.5.1 色谱条件 色谱仪:Waters 1525,检测器:Waters 2414,色谱柱:保护柱TSK-gel(PWXL6.0×40mm),TSKGEL 4000K凝胶柱(PWXL 7.8mm×300mm)和凝胶柱TSK-GEL2500K(PWXL7.8mm×300mm),流动相:0.2mol/L的磷酸盐缓冲液(pH=7.0),流速:0.6m L/m in,柱温:35℃,注射容积:30L,运行时间:35m in。
1.2.5.2 标准曲线制作和样品测定 将不同分子量的右旋糖酐(5200、11600、23800、48600、148000、273000、410000、668000、1400000u)相继进样,测出其洗脱体积与分子量的对数关系,作标准曲线。再根据样品的洗脱体积和标准曲线来计算分子量。
1.2.6 红外分析 灵芝多糖水提和超声提取的样品红外光谱分析参照Kumar等[4]的KBr压片法。称取2~4mg冷冻干燥后的多糖样品,与已经充分干燥的溴化钾在研钵中充分研磨,压片机压成薄片。将薄片进行红外光谱扫描,扫描范围为4000~400cm-1。
1.2.7 原子力显微镜(AFM)分析 参照孙润广等[5]的方法,将冻干的水提和超声提取的灵芝多糖,稀释至0.01mg/m L,再吸取5~10μL于云母片上,吹干,使其固定于云母片上,再进行AFM测定。
1.2.8 单糖组成的测定 通过气相色谱进行灵芝多糖单糖组成的分析,参考井泽良等[6]的文献并略作修改。20mg的多糖样品与5m L的4mol/L三氟乙酸(TFA)在100℃中水解2h。得到的水解液于55℃减压旋干,再加入适量的甲醇继续旋干,重复3~5次。再加入40mg的盐酸羟胺、15mg内标肌醇和2m L的吡啶于90℃水浴振荡30m in后,加入2m L醋酸酐继续在90℃水浴振荡30min。反应后的溶液加入2m L水终止反应后,加入4m L的二氯甲烷萃取,吸取上层的水,重复3次,最后加入无水硫酸钠吸去剩余水分,经0.45μm微孔滤膜滤过后即可上样。另外以D-葡萄糖、鼠李糖、木糖、甘露糖、半乳糖、阿拉伯糖等标准物经相同的条件处理,进样。
色谱条件为流动相:100mmol/L磷酸盐缓冲溶液(pH 6.0)-乙腈(体积比为80∶20),等度洗脱,流速1m L/min;紫外检测波长:245nm进样量:5μL;柱温:室温。
1.2.9 多糖抗氧化活性的测定
1.2.9.1 DPPH自由基的清除能力测定 DPPH自由基的清除能力是一种较为普遍的测抗氧化活性的方法。参考Wu等[7]的方法,并略作修改。2m L的灵芝多糖溶液(0.1~2.0mg/m L)与2m L的0.2mmol/L DPPH·溶液混合,振荡,室温下避光放置30m in,在517nm下测吸光值(Ai)。以2m L相同浓度的样品和2m L无水乙醇混合作为对照组(A j),另外2m L DPPH·溶液和2m L无水乙醇混合后测吸光值(Ac)。
DPPH·清除率(%)=[1-(Ai-A j)/Ac]×100
1.2.9.2 还原力的测定 多糖还原力的测定主要参考You等[8],并略作修改。2m L的多糖样品(1~5mg/m L)与2m L的0.2mol/L磷酸盐缓冲液(pH6.6)和2m L的铁氰化钾(1%,w/v)混合,在50℃水浴反应20m in,然后加入2m L的三氯乙酸(10%,w/v)振荡。取上清液2m L,并加入2m L的蒸馏水和0.4m L的氯化铁振荡,混匀,反应10m in,在700nm下测吸光值,用蒸馏水调零。
1.2.9.3 氧自由基清除能力的测定 参照Wu等[9]的方法,并略作修改,20μL样品与40μL 3.5nmol/L FL(荧光素钠盐)混合在37℃预热15m in,然后加入140μL 12mmol/L的APPH·(自由基产生剂),通过酶标仪在485nm下激发,538nm发射,每隔两分钟测一次吸光值并对吸光值的曲线进行积分。再以Trolox(维生素E水溶性类似物)标准曲线的制备,将Trolox配成浓度分别为0、20、40、60、80、100、200μmol/L,再通过以上方法测出其净面积,再以浓度为x轴,净面积为y轴作标准曲线。根据样品测得的净面积,代入Trolox标准曲线,即可得到样品的Trolox当量浓度。
2 结果与讨论
2.1 超声提取和水提灵芝多糖得率的比较
超声提取和水提灵芝多糖的得率如图1所示,超声提取灵芝多糖的得率为2.16%±0.03%,而水提灵芝多糖的得率为3.26%±0.03%。对于该品种的灵芝,传统的水提方法能获得更多的灵芝多糖,与其他文献报道[10-11]的情况有所差异,可能由于该品种灵芝受温度的影响要大于超声功率的影响,而由于水提方法温度高,因此多糖更容易溶出,但具体的机理还有待以后深入研究。而且水提消耗的时间约是超声提取方法的4倍。因此,从节能方面考虑,超声提取方法的效率较高。
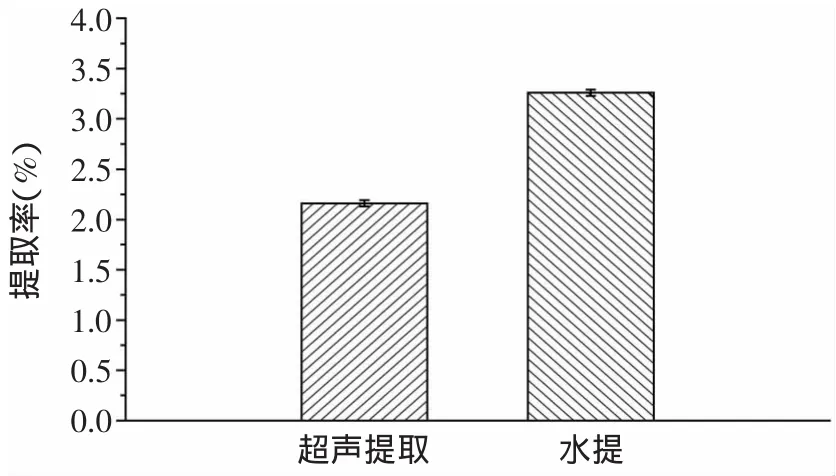
图1 超声提取和水提灵芝多糖的得率Fig.1 The yields of Ganoderma lucidum polysaccharides extracted by ultrasonic wave and hotwater
2.2 超声提取和水提灵芝多糖分子量的分析
超声提取和水提灵芝多糖的分子量分布如表1所示,从表1中可以看出,超声方法提取的灵芝多糖分子量主要由两部分组成,分别是19.5ku占23.56%和6.0ku占76.44%,而水提的灵芝多糖分子量则由三部分组分,分别是598.7ku占48.72%,18.6ku占20.91%和6.7ku占30.37%。与水提的灵芝多糖相比,经超声提取的灵芝多糖没有检测到分子量在598.7ku的组分,而6.0ku的组分比例升高明显。可以推测,超声提取时超声波的作用对灵芝细胞的破碎程度明显,导致部分大分子的多糖被破坏或者是更多小分子物质溶出,从而降低了灵芝多糖的分子量。Chien等[12]通过比较不同分子量壳聚多糖的抗氧化活性,发现低分子量(12ku)的壳聚多糖比中分子量(95ku)和高分子量(318ku)的壳聚多糖要高。由于高分子量的多糖分子内部氢键连接紧密,减弱了分子中羟基和活性基团的活性,而低分子的多糖分子内部的氢键连接相对较弱,分子中的羟基和活性基团的活性较高,更有利于捕获自由基,因此抗氧化能力较强。
2.3 超声提取和水提灵芝多糖红外的分析
为了进一步确定超声提取的灵芝多糖和水提的灵芝多糖结构差异,分别对两种多糖进行红外光谱的分析,结果如图2所示。两种灵芝多糖均在3410~3440cm-1之间具有较宽的吸收峰,为O-H的伸缩振动,在2935cm-1附近具有弱吸收峰为烷基的C-H伸缩振动,在1642cm-1附近可能是羧基的伸缩振动,也有可能是结晶水特征峰,在1423cm-1和1382cm-1附近为-CH2的变形吸收峰。而在1200~1000cm-1附近水提的灵芝多糖的吸收峰强度要大于超声提取的灵芝多糖,该区域为C-O-C和C-O-H的吸收峰,在921cm-1附近的可能为D-葡萄糖特征吸收峰。说明超声法与水提法所得的灵芝多糖的基团无显著性差异,这与Yang等[13]的结论一致。

图2 超声提取和水提灵芝多糖的红外光谱图Fig.2 IR spectra of Ganoderma lucidum polysaccharides extracted by ultrasonic wave and hotwater
2.4 超声提取和水提灵芝多糖AFM的分析

图3 超声提取和水提灵芝多糖的原子力显微镜图Fig.3 AFM images of Ganoderma lucidum polysaccharides extracted by ultrasonic wave and hotwater

表1 超声提取和水提灵芝多糖的分子量的组成(ku)Table1 Themolecularweights of Ganoderma lucidum polysaccharides extracted by ultrasonic wave and hotwater(ku)
图3是在扫描范围5.00μm×5.00μm的超声提取和水提的灵芝多糖的原子力显微镜图,通过比较超声提取和水提灵芝多糖的平面图可以发现,水提的灵芝多糖分子具有侧枝结构,分子中有很多分支连接,而经超声提取的多糖形状发生明显的变化,结构较松散,呈现微小的圆颗粒状,另外还有部分紧凑的聚合体,从超声的三维图更能清晰的看出,与其他单个多糖分子相比,其聚集成一定的高度的聚合物。主要是由于超声的空穴作用,使大分子得到灵芝多糖离解成小分子,再由于超声波的振动使小分子相互聚集,形成形状紧凑的聚合物。与Yang等[13]通过扫描电子显微镜的观察多糖分子形态的结论相一致。超声处理可让多糖的解聚,分子量降低[14]。从图3中可以看出,超声处理后的灵芝多糖分子明显要小于水提的灵芝多糖,这与本研究的分子量结论相一致。

表2 超声提取和水提灵芝多糖的单糖组成Table2 Themonosaccharide composition of Ganoderma lucidum polysaccharides extracted by ultrasonic wave and hotwater
2.5 超声提取和水提灵芝多糖单糖组成的分析
从表2可以看出,超声提取的灵芝多糖和水提的灵芝多糖的主要由葡萄糖组成,摩尔百分比分别75.44%和79.39%,半乳糖和甘露糖也占有一定的比例。与Yi等[15]研究灵芝多糖的单糖组成为甘露糖,半乳糖,葡萄糖的摩尔比为1∶1.28∶4.91的结果相符合。另外本文还检测含有少量的鼠李糖和岩藻糖,通过对比两种方法得到的灵芝多糖,可以看出超声提取对灵芝多糖的单糖组成影响不大。
2.6 超声提取和水提灵芝多糖DPPH自由基清除能力

图4 超声提取和水提灵芝多糖的DPPH自由基清除能力Fig.4 DPPH radical scavenging activities ofGanoderma lucidum polysaccharides extracted by ultrasonic wave and hotwater
图4为超声提取和水提灵芝多糖的DPPH自由基清除能力。两种方法提取的灵芝多糖的DPPH自由基清除率都随着多糖浓度的增加而升高。在灵芝多糖浓度为0.5mg/m L时,超声提取的灵芝多糖的DPPH自由基清除率达到79.90%±0.30%,是水提的灵芝多糖的1.3倍。从图中可以看出,超声提取灵芝多糖的DPPH自由基清除率要明显高于水提灵芝多糖。Matthaus等[16]指出DPPH自由基的清除能力,主要是通过抗氧化剂提供的氢使DPPH自由基形成稳定的分子,达到清除自由基的目的。经超声处理后的灵芝多糖,分子量降低,使得更多的活性基团暴露出来,更容易捕获DPPH自由基分子,因而超声提取的灵芝多糖的DPPH自由基清除较强。这与Bao等[17]超声提取能够提高多糖的DPPH自由基清除能力的结果相一致。
2.7 超声提取和水提灵芝多糖还原力
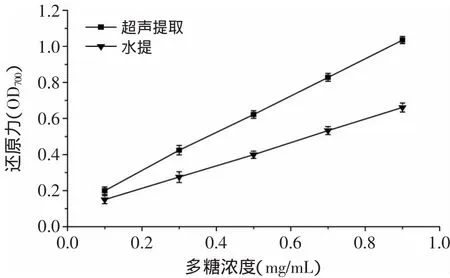
图5 超声提取和水提灵芝多糖的还原力Fig.5 The reducing power of Ganoderma lucidum polysaccharides extracted by ultrasonic wave and hotwater
还原力法的原理是抗氧化剂于50℃,能够与铁氰化钾被还原成亚铁氰化钾,再与FeCl3反应生成绿色的普鲁士蓝,在700nm下有强吸收峰[18]。因此抗氧化剂提供电子或者氢原子的能力越强,其还原力越强。图5所示为超声提取和水提灵芝多糖的还原力。两种方法提取的灵芝多糖的还原力都随着多糖浓度的增加而增加,且超声提取灵芝多糖的还原力在0.9mg/m L多糖浓度时,达到1.035±0.001,而水提多糖的还原力只有0.661±0.005,即提高了约1.5倍。与DPPH自由基的清除能力结果一致。
2.8 超声提取和水提灵芝多糖ORAC值

图6 超声提取和水提灵芝多糖的ORAC值Fig.6 The ORAC values ofGanoderma lucidum polysaccharides extracted by ultrasonic wave and hotwater
从图6中可以看出,超声提取灵芝多糖的ORAC值要显著高于水提的灵芝多糖,超声提取和水提灵芝多糖的ORAC值分别为2275.07±115.73、1260.51± 85.48μmol Trolox/g,超声提取灵芝多糖是水提灵芝多糖的1.8倍。可见,超声方法提取的灵芝多糖更有利于提高灵芝多糖的氧自由基清除能力,与DPPH自由基的清除能力和还原力的结果一致。
多糖的抗氧化活性与多糖的分子量、单糖组成,糖苷键连接、链构象密切相关,本文研究其两种不同提取方法的灵芝多糖,通过分子量、红外光谱、AFM和单糖组成分析,发现超声提取方法对灵芝多糖的单糖组成和官能团的组成影响不大,但能够明显降低灵芝多糖的分子量,在AFM图下灵芝多糖的分子形态也发生了明显变化,结构较为松散,增大了灵芝多糖与自由基的接触面积,更容易捕捉到自由基,因此超声提取灵芝多糖的DPPH自由基的清除能力、还原力、ORAC值均明显高于水提灵芝多糖。影响超声提取的灵芝多糖抗氧化能力还有其他的原因,如其溶解度,链构象的变化等等,这还有待进一步的研究。
3 结论
通过研究超声提取灵芝多糖和水提灵芝多糖,发现水提灵芝多糖的得率较高,但超声提取灵芝多糖的DPPH自由基清除能力、还原力、ORAC值均明显高于水提的灵芝多糖,分子量和多糖分子形态也明显改变,另外单糖组成和红外分析的结果变化不大。因此超声提取灵芝多糖的抗氧化活性的提高可能与其分子量和结构形态的改变有关,但其具体的机理还有待进一步的研究。
[1]Zhao L Y,Dong Y H,Chen G T,etal.Extraction,purification,characterization and antitumor activity of polysaccharides from Ganoderma lucidum[J].Carbohydrate Polymers,2010,80:783-789.
[2]Chen YG,Shen ZJ,Chen X P.Modulatory effectofGanoderma lucidum polysaccharideson serum antioxidantenzymes activities in ovarian cancer rats[J].Carbohydrate Polymers,2009,78:258-262.
[3]Dubois M,Gilles K,Hamilton J,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28:350-356.
[4]Kumar C G,Joo H S,Choi JW,et al.Purification and characterization of extracellular polysaccharide from haloalkalophilic Bacillus sp.I-450[J].Enzyme and Microbial Technology,2004,34:673-681.
[5]孙润广,张静.甘草多糖螺旋结构的原子力显微镜研究[J].化学学报,2006(24):2467-2472.
[6]井泽良,刘兴华,关文强.真菌寡聚糖单糖组成(HPLC)分析及诱导抗病活性初步研究[J].食品研究与开发,2006(1):53-55.
[7]Wu H C,Chen H M,Shiau CY.Free amino acidsand peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J].Food Research International,2003,36:949-957
[8]You L,Zhao M,Cui C,et al.Effect of degree of hydrolysis on the antioxidant activity of loach(Misgurnus anguillicaudatus)protein hydrolysates[J].Innovative Food Science and Emerging Technologies,2009,10:235-240.
[9]Huang W Y,Kaustav M,Wu JP.Oxygen radical absorbance capacity of peptides from egg white protein ovotransferrin and their interaction with phytochemicals[J].Food Chemistry,2010,123(3):635-641.
[10]覃海元,潘嫣丽,覃梅珍.热水与超声波提取鹿角灵芝多糖工艺比较研究[J].食品添加剂,2011(3):91-95.
[11]黄生权,王周,林俊钦,等.超声波辅助提取灵芝水溶性多糖的工艺研究[J].安徽农业科学,2009,37(23):10993-10995.
[12]Chien P J,Sheu F,Huang W T,et al.Effect of molecular weight of chitosans on their antioxidative activities in apple juice [J].Food Chemistry,2007,102:1192-1198.
[13]Yang B,Jiang Y M,Zhao M M,et al.Effects of ultrasonic extraction on the physical and chemical properties of polysaccharides from longan fruitpericarp[J].Polymer Degradation and Stability,2008,93(1):268-272.
[14]Fu L L,Chen H X,Dong P,et al.Effects of ultrasonic treatment on the physicochemical properties and DPPH radical scavenging activity of polysaccharides from mushroom Inonotus obliquus[J].Journal of Food Science,2010,75(4):c322-c327.
[15]Chen Y,Xie M Y,Nie S P,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruitingbodiesofGanoderma atrum[J].Food Chemistry,2008,107:231-241.
[16]Matthaus,B.Antioxidant activity of extracts obtained from residues of different oilseeds[J].Journal of Agricultural and Food Chemistry,2002,50:3444-3452.
[17]Yang B,Zhao M M,Shi J,etal.Effectof ultrasonic treatment on the recovery and DPPH radical scavenging activity of polysaccharides from longan fruit pericarp[J].Food Chemistry,2008,106:685-690.
[18]Isabel C,Paula B,Miguel V,et al.Free-radical scavenging capacity and reducing power of wild edible mushrooms from northeast Portugal:Individual cap and stipe activity[J].Food Chemistry,2007,100:1511.
