降低鲤鱼饲料蛋白质的初步研究
2013-02-20井润珍程镇燕孙金辉白东清乔秀亭
■郭 立 井润珍 程镇燕 孙金辉 白东清 乔秀亭
(天津农学院水产科学系天津市水产生态及养殖重点实验室,天津 300384)
随着水产养殖业的迅猛发展,水产养殖动物高蛋白饲料,特别是动物蛋白饲料的使用,极大地增加了资源的压力;同时养殖过程中产生的氮、磷已成为养殖水质恶化和环境污染的重要根源。面对资源危机与环境污染的双重压力,开展低氮高效饲料的开发利用,发展清洁生产模式,将是我国水产养殖业的必然选择,也是低碳经济的需要。低氮排放水产饲料是营养素利用率高、溶失率和残留率低的饲料,这种饲料通过水产动物的摄食、消化、吸收、积累和排泄对养殖水体环境影响较小,是一种绿色饲料[1]。Vergara等[2]在以非蛋白能源物质替代蛋白质的试验中,发现碳水化合物与脂肪有节约蛋白质的作用。碳水化合物作为配合饲料的组成成分,属于价格比较低廉的能源。在饲料营养平衡的情况下,适量的碳水化合物能节约部分蛋白质,降低饲料成本[3]。鲤鱼是世界上养殖最为广泛的鱼类,其产量约占世界养殖鱼类总产量的40%,在我国鲤鱼也是传统的淡水养殖品种之一。关于鲤的营养需要,国内外已有较多研究[4-8],但综合考虑养殖效果和环境效益的低氮高效饲料的研究尚未见报道。目前大多鲤鱼养成初期(体重小于500 g)的商品饲料的蛋白含量为32%,本文以较小规格鲤(体重26 g左右)为对象,研究了不同蛋白含量饲料对鲤生长、体内消化酶的活性及养殖水体水质的影响,以期为低氮饲料的研究和使用提供一定的参考。
1 材料与方法
1.1 试验用鱼及养殖条件
试验鲤鱼由天津农学院提供,体重为(26.93±3.50)g,体长为(10.34±0.48)cm。试验在天津农学院循环水实验室进行。每个试验桶的有效容积为60 L,初始水源为充分曝气后除氯的自来水。pH值为7.0~8.0,水温为23~25 ℃。
1.2 试验饲料
试验饲料由鱼粉、豆粕、花生粕、棉粕、菜粕、次粉、麸皮、预混料混合而成,以糊精作为填充物(成分详见表1)。
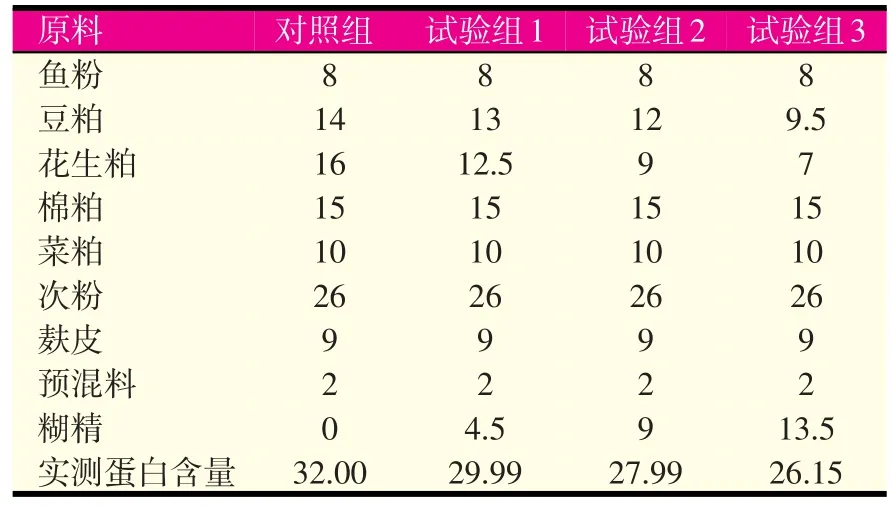
表1 试验饲料组成及成分含量(%干重)
将所有干性原料都经过粉碎,通过60目筛后充分混匀,加入适量水,再用小型电动绞肉机(模孔直径2.00 mm)制成饲料颗粒,风干备用。
1.3 试验方法
1.3.1 生长试验
将试验鱼分为4组,即对照组、试验组1、试验组2、试验组3,每组3个平行,共计12个水箱(循环水养殖),每个水箱中放入体质健康的试验鱼30尾。试验期间,日投饵量为鱼体体重的3%,每天投饵两次(6:00、18:00)。
试验起始和结束时分别对各水族箱中鲤鱼进行记数、称重。
增重、特定生长率(SGR)、饲料系数(FCR)计算公式如下:
增重=Wf-Wi;
SGR(%/d)=[(lnWf-lnWi)/T]×100;
FCR=Wt/(Wf-Wi)。
式中:Wf——为平均终体重(g);
Wi——平均初体重(g);
T——饲养时间(d);
Wt——试验期间投入饲料量(g)。
1.3.2 对营养物质表观消化率影响试验
养殖试验2周后,采用虹吸法收集粪便于筛网上,选取包膜完整的粪便置于称量瓶中,冷冻干燥,置于20℃冰箱保存待测。样品中铬含量测定参照GB/T13088—2006方法。干物质、粗蛋白和脂肪的表观消化率计算公式如下:
干物质表观消化率(%)=(1-饲料中Cr2O3含量/粪便中Cr2O3含量)×100;
营养成分表观消化率(%)=100-[(饲料中Cr2O3含量/粪便中Cr2O3含量)×(粪便中营养成分/饲料中营养成分)]×100。
1.3.3 消化酶活性测定
养殖试验结束后,将试验鱼空腹暂养48 h后,每个水箱中随机取试验鱼5尾,取其肝脏和肠道。去除肠道粪便及附着物,用冰双蒸水清洗肠道、滤纸吸干,称重,捣碎后移入匀浆器内冰水浴匀浆,在 4℃下离心 15 min(10 000 r/min),取上清液备用,于24 h分析完毕。
1.3.3.1 蛋白酶活性采用福林-酚法[9]测定
蛋白酶活性定义:在37℃下每分钟水解酪素产生1 μg酪氨酸为一个酶活力单位[μg/(min·g)]。
蛋白酶活力单位=F×A/15。
式中:A——样品测得光密度曲线(y=0.001x+0.005)得相应的酪氨酸数;
F——酶液最终稀释的倍数;
15——反应时间(min)。
注:稀释倍数=[反应的总体积/取样量]×样本测试前稀释倍数。
1.3.3.2 淀粉酶活性采用碘淀粉显色法测定[10]
淀粉酶活性的定义∶以30 min内,1 mg新鲜组织中的淀粉酶在30℃(温度试验除外)下能完全水解10 mg淀粉为一个酶活力单位,记为mg/(30 min·g)。
淀粉酶活性=[(对照管光密度-测定管光密度)/对照管光密度]×800。
1.3.3.3 脂肪酶活性的测定采用滴定法[11]
脂肪酶活性定义:在30℃水浴中,1 g新鲜组织脂肪酶水解底物而释放出的脂肪酸被中和时消耗的0.05 mol/l氢氧化钠的毫升数,即为脂肪酶活性单位,记为ml/(min·g)。
脂肪酶活性单位=(A-B)N×f/t。
式中:A——样品耗碱液体积数(ml);
B——对照组耗碱液体积数(ml);
N——每毫升碱液微克分子数;
f——稀释倍数;
t——作用时间(min)。
1.3.4 水质影响试验
将试验鱼分为4组(同上),每组3个平行共计12个水箱(静水充氧),每个水箱中放入体质健康的试验鱼30尾。试验期间,日投饵量为鱼体重的3%,每天投饵两次(6:00、18:00)。每24 h测定养殖水体中NH4+-N、NO2--N、Nt和Pt含量,试验持续72 h。
1.4 数据分析
分析方法采用SPSS10.0统计软件进行单因素方差分析(One-way ANOVA),邓肯氏法多重比较各组间数值的差异显著性(P<0.05)。
2 结果
2.1 降低饲料中蛋白质含量对鲤生长的影响(见表2)

表2 各试验组鲤鱼的增重量、特定生长率、饲料系数
由表2可知,试验组1的增重、特定生长率均最高,分别达到了276.40 g和1.07(%/d),试验组3最低,增重和特定生长率分别为232.41 g和0.85(%/d);饲料系数为试验组3最高,试验组1最低。饲料系数越低,说明该饲料转化率提高,该饲料使用效果越好。经过对上述表格中的数据进行方差分析得到:在增重方面,试验组1显著高于对照组、试验组2和试验组3(P<0.05),试验组2与对照组之间无显著差异(P>0.05)。在特定生长率方面,只有试验组1显著高于试验组3(P<0.05),其余3组之间无显著差异(P>0.05)。饲料系数方面,试验组3显著高于其他3个组(P<0.05),其余3组之间无显著差异(P>0.05)。
2.2 鲤对不同饲料中各物质表观消化率的影响(见图1)
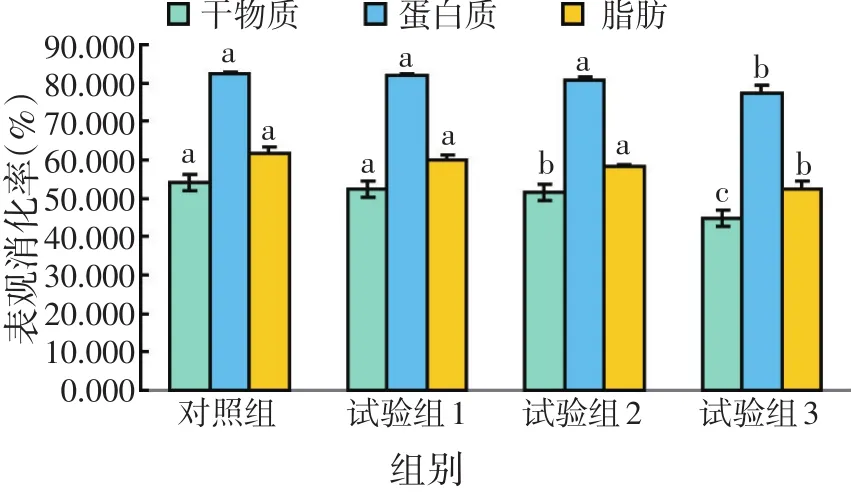
图1 鲤对饲料中干物质、蛋白质及脂肪表观消化率
由图1可知,在试验饲料中,鲤鱼对不同饲料中干物质的表观消化率随着饲料中蛋白质水平含量的降低而呈下降趋势。其中对照组最高,为53.87%,试验组3最低,为47.17%。经SPSS分析比较,试验组2和试验组3显著低于其他2组(P<0.05),试验组1和对照组之间无显著差异(P>0.05)。鲤鱼对蛋白质的表观消化率随着蛋白质含量的降低呈现先上升,然后逐渐降低的趋势,试验组1的蛋白质表观消化率最高,达82.31%,最低的是试验组3,只有77.79%。对照组、试验组1和试验组2显著高于试验组3(P<0.05),前三者之间差异不显著(P>0.05)。鲤鱼对不同饲料中脂肪的表观消化率随着饲料中蛋白质水平含量的降低而呈下降趋势。对照组最高,试验组3最低。对照组、试验组1和试验组2均显著高于试验组3(P<0.05)。
2.3 不同饲料对鲤消化酶活性的影响(见表3)
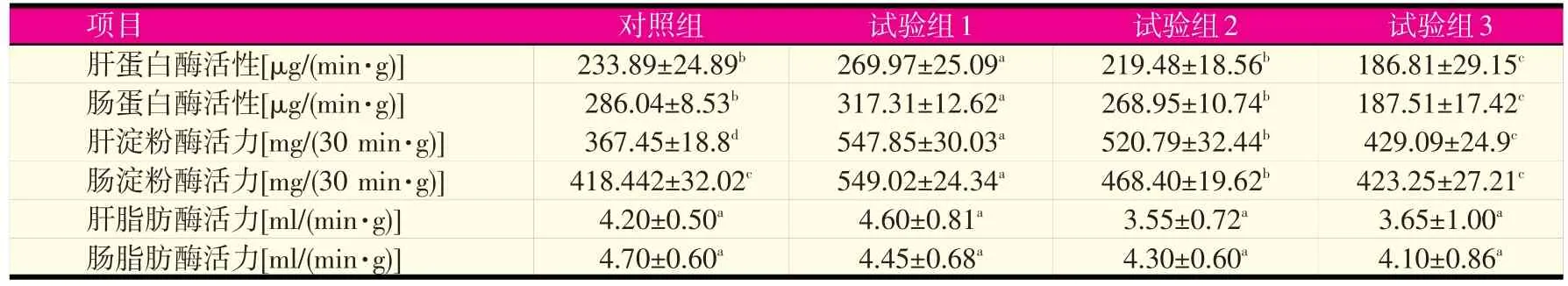
表3 不同蛋白水平对鲤鱼蛋白酶、淀粉酶和脂肪酶活性的影响
由表3可知,随着饲料中蛋白含量的降低,鲤肝脏和肠道中各种消化酶活性基本呈先上升后下降趋势。试验组1的肝脏和肠道中蛋白酶活性最强,分别为269.97 μg/(min·g)和317.31 μg/(min·g),显著高于对照组及其他试验组(P<0.05)。试验组1的肝脏中淀粉酶活性最强,为547.85 mg/(30 min·g),显著高于其他组,且对照组和各试验组间均差异显著。试验组1的肠道中淀粉酶活性也最强,达549.02 mg/(30 min·g),显著高于对照组及试验2、3组。肝脏和肠道中脂肪酶活性最强的分别是试验组1和对照组,但各组之间差异均不显著(P>0.05)。
2.4 不同饲料对养殖水体水质的影响(见表4)
由表4可见,各组养殖水体中的NH4+-N、NO2--N、Nt和Pt含量均随着时间的推移而上升。在48 h和72 h时,水体中的NH4+-N和NO2--N的含量各组间均无显著差异。试验组1中Nt的含量在48 h时略高于对照组,但与对照组无显著差异;在72 h时Nt含量最低,且与对照组的差异显著。在48 h和72 h时,试验组1中的Pt含量最低,但与对照组相比差异不显著。

表4 不同蛋白含量饲料对养殖水体中NH4+-N、NO2--N、Nt和Pt含量的影响(mg/l)
3 讨论
3.1 降低饲料中蛋白质含量对鲤生长的影响
鱼类的生长主要靠从食物中摄食蛋白质以构成鱼体的组织和器官,蛋白质也可为鱼类的生命活动提供部分能源。饲料中蛋白质含量过低,会使鱼类生长减慢;而蛋白质含量过高会增加饲料成本,同时加重鱼体代谢负担,也使鱼体生长减慢,代谢中过剩的氨基酸还会对鱼体产生毒性,排泄物含氮量高,促进水体富营养化,不利于长期养殖。因此,鱼类蛋白质最适需求量便成了鱼类配合饲料研究的重点[12]。对鲤鱼最适营养需要量的研究表明,粗蛋白质为30%~38%就能满足鱼的需要[7,13],适宜的能量水平和氮能比有益于鲤生长和饲料利用,在饲料蛋白质含量一定的情况下,饲料中非蛋白质能量的供给不充分常常导致较多的蛋白质分解以满足鱼体对能量的需求。因此,在鱼饲料中使用适宜水平的非蛋白质能源物质可以提高饲料的蛋白质利用效率[8]。糖和脂肪是鱼类饲料中主要的非蛋白质能源物质。虽然脂肪通常被认为是鱼类主要的非蛋白质能量来源,但是饲料中过高含量的脂肪容易引起饲料颗粒质量问题;同时造成鱼体脂肪含量过高,影响鱼肉口感。本试验用糊精来代替部分蛋白质,随蛋白水平的降低鲤的增重和特定生长率均呈现先升高再降低的趋势。投喂试验组1的饲料(蛋白质含量为29.99%),鲤的增重和特定生长率最高,而饲料系数最低。这与姜志强等[12]对锦鲤及石英[14]对金鱼和血鹦鹉的研究结果一致。由此可见,将鲤饲料蛋白含量降至30%左右,既不影响鲤的正常生长,还有助于降低饲料成本。但是当蛋白含量低于28%时,对鲤鱼来说可能处于蛋白质含量相对缺乏的水平,满足不了鱼体的正常需求,使鱼的生长受到抑制。
3.2 鲤对不同饲料中各物质表观消化率的影响
表观消化率是动物从食物中所消化吸收的部分营养物质占总摄入量的百分比,是评价饲料营养价值的重要指标之一。当饲料中蛋白质含量为32.00%和29.99%时,蛋白质供给较充足,鲤对各物质消化能力均较强。而饲料中蛋白质含量低于28%时,鲤对各物质的消化率均较低,这可能由于饲料中蛋白质缺乏,导致机体的代谢机能降低。
3.3 不同饲料对鲤消化酶活性的影响
消化酶是维持机体正常代谢的生命活性物质,对生物体内的各种化学变化起催化作用。提高消化酶活性,可以促进鱼类对营养物质的消化吸收,进而促进鱼类生长[15]。鱼的食性决定了其消化道消化酶的组成和酶的活性,消化酶的活性与饵料的成分有关[16-18]。本试验中试验组1中的鲤肝脏和肠中蛋白酶和淀粉酶的活性均显著高于其他各组,这可能是由于当饲料中蛋白质适宜时,能使鲤处于最佳生长状态,使体内消化酶的活性保持在较高的水平。
王吉桥等[19]认为,饲料蛋白质水平对花肠道中脂肪酶的活性无显著影响,这与本试验结果一致。
3.4 饲料中蛋白质含量对养殖水体水质的影响
国内外的许多研究表明,养殖中产生的饲料溶失、残饵和排泄物都在水中分解并消耗溶解氧,从而使水中溶解氧减少,氨氮、亚硝酸盐氮、硝酸盐氮增加,水中积累大量的病毒、细菌、浮游生物等微生物,导致水体富营养化或水质恶化,不良的水环境使养殖动物更容易受到应激,也易于感染疾病,从而削弱动物的抵抗力,病害发生率增高,严重影响水产养殖的健康发展[20-23]。本试验投喂低氮饲料,对养殖水体中NH4+-N和NO2--N的含量影响不大。但适当降低饲料中的蛋白质水平,能显著降低水体中Nt和Pt含量。高攀[24]研究了通过16种不同蛋白质和脂肪含量的饲料对草鱼幼鱼的饲喂试验,表明投喂不同饲料的池塘部分水质表现出了显著的差异,这与本试验结果基本一致。Rodehutscord M等[25]通过试验证明,在磷的需求被满足之前,吸收的所有磷都会在体内累积,不会影响可溶性磷的排泄;试验表明饲料中蛋白含量过高或过低都不利于保持水体中总磷的浓度。这与本试验的结果一致,这可能是由于饲料中鱼粉的磷含量虽然高,但是利用率较低,随鱼的代谢过程而释放到水体中。
4 结论
蛋白质是鱼类重要的营养物质,饲料中蛋白质含量的高低对鱼的生长有着重要影响,养殖过程中由于残饵和排泄物所产生的氮、磷会使养殖水质恶化,造成环境污染。本试验综合分析了不同蛋白含量饲料对鲤生长、体内消化酶的活性及养殖水体水质的影响。结果表明,适当降低鲤饲料蛋白,即将饲料中蛋白质含量由目前常用的32%降至30%左右时,不仅能显著提高鲤体内各种消化酶的活性,提高增重率,降低养殖成本,提高经济效益,还能显著降低养殖水体中Nt和Pt积累,减少对水环境的污染,具有重要的社会效益。