C57BL/6小鼠微小残留白血病模型的建立
2013-01-20张小杰蒋东霞房佰俊张龚莉符粤文魏旭东宋永平
张小杰,蒋东霞,周 健,房佰俊,张龚莉,符粤文,魏旭东,宋永平
(郑州大学附属肿瘤医院血液科,河南郑州 450003)
C57BL/6小鼠微小残留白血病模型的建立
张小杰,蒋东霞,周 健,房佰俊,张龚莉,符粤文,魏旭东,宋永平
(郑州大学附属肿瘤医院血液科,河南郑州 450003)
目的探讨构建C57BL/6小鼠FBL-3微小残留白血病(MRL)模型的方法。方法将5×106个FBL-3红白血病细胞经尾静脉接种至C57BL/6小鼠,接种后第3天经尾静脉注射不同剂量环磷酰胺(CTX),观察小鼠生存时间与药物剂量间的关系;根据白血病小鼠生存时间与CTX剂量和与接种FBL-3细胞数量的关系,确定构建小鼠MRL模型所需的化疗药物剂量。结果C57BL/6白血病小鼠对CTX敏感,随CTX剂量增加白血病小鼠的生存时间逐渐延长,药物剂量与生存时间有较好的回归关系。移植生物试验显示,接种500个FBL-3细胞的小鼠生存时间与接受100 mg·kg-1CTX化疗白血病小鼠相当。结论每只C57BL/6小鼠经尾静脉接种5×106个FBL-3细胞3 d后给予100 mg·kg-1CTX化疗可以建立MRL动物模型。
白血病细胞;微小残留白血病;小鼠;模型
白血病患者化疗缓解后体内仍然残留少量白血病细胞,这部分细胞即为微小残留白血病(minimal residual leukemia,MRL)细胞。部分MRL细胞为白血病干细胞,对多种化疗药物耐受,是白血病化疗和骨髓移植术后复发的根源。因此,检测和根除MRL对彻底治愈白血病具有重要意义[1-2]。由于对人体内MRL的分布和复发规律了解甚少,加上动物模型研究具有实验周期短,容易得到规律性的结果,并且重复性好,敏感特异的检测方法较多。因此,临床检测和治疗MRL多以动物实验为基础,国内外学者大多利用小鼠或大鼠动物模型开展研究[3-4]。为了构建细胞株和动物传代方便、重复性好的MRL模型,我们在原来建立的移植性C57BL/6小鼠FBL-3红白血病模型的基础上[5],加用环磷酰胺(CTX)化疗,建立FBL-3红白血病MRL的C57BL/6小鼠模型,并初步研究了MRL细胞在体内的分布规律。
1 材料与方法
1.1 材料
1.1.1 细胞株和实验动物 FBL-3白血病细胞株由河南省血液病研究所冻存。C57BL/6近交小鼠96只,雌雄各半,8~12周龄,体质量18~22 g,平均(20±2)g,购自南方医科大学实验动物中心。饲养于清洁级实验动物房中,按随机数字表对实验动物进行分组。
1.1.2 药品、试剂和仪器 胎牛血清(杭州四季青生物技术有限公司),环磷酸胺注射液(山东齐鲁制药厂),RPMI-1640培养基(美国 Gibco公司),PBS平衡盐溶液、细胞培养瓶、血细胞计数板、细胞冻存管、净化工作台(苏州净化设备厂),CO2培养箱(日本Sanyo公司),液氮罐、台式离心机、生物显微镜(日本Olympus公司),倒置显微镜(重庆光学仪器厂)。
1.2 方法
1.2.1 细胞处理 常规方法复苏FBL-3细胞,于RPMI-1640培养基(含胎牛血清体积分数15%,碳酸氢钠1 ~ 2 g· L-1,HEPES 2.38 g· L-1,L-Glu 300 mg·L-1,青、链霉素各 200 u·L-1)中常规传代培养,每3~4 d传代1次。培养条件:体积分数5%CO2,饱和湿度:37℃。实验用细胞均处于对数生长期。
1.2.2 建立MRL模型 以我们原来的工作[5]为基础,参考褚建新等[6]的方法进行。C57BL/6小鼠随机分组,每组6只,雌雄各半,经尾静脉接种对数生长期FBL-3 细胞每只1 ×106个,接种3 d后以50、100、150、200、250、300 mg·kg-1CTX 化疗后,记录小鼠生存时间,绘制CTX剂量与小鼠生存时间关系表。
1.2.3 计数外周血白细胞(WBC) 小鼠眼眶采血,在库特血细胞计数仪上计数WBC并分类,涂片Wright染色观察外周血细胞。
1.2.4 观察MRL的病理学结果 断颈处死小鼠,取肝脏和脾脏,常规病理方法制作蜡块、切片、HE染色,计数每10个低倍视野下的白血病细胞浸润灶。
1.2.5 移植生物实验 化疗后第3天活杀小鼠,取小鼠股骨骨髓、脾脏和肝脏,制成单细胞悬液,每只健康C57BL/6小鼠腹腔接种5×106个FBL-3细胞,观察记录生存时间。
1.2.6 观察生存时间 自接种之日起,每2.4 h为0.1 d,精确至死亡时止,夜间死亡而早晨发现者减去0.5 d。
1.3 统计学处理 采用SPSS 13.0进行数据处理,实验数据以±s表示,先行方差齐性检验和正态性检验,再行组间均数F检验和回归相关分析,检验水准α=0.05。
2 结果
2.1 不同剂量CTX化疗后白血病小鼠外周血WBC变化 注射CTX的剂量与白血病小鼠外周血WBC数量有一定关系,化疗后9 d内,CTX量越大,WBC数量越低。化疗后第5天WBC降至最低点,随后又逐渐升高,在第16天升至化疗前水平,接着升高速度增快,外周血出现白血病细胞,且比例逐渐增高。
2.2 病理学检查结果 100 mg·kg-1的CTX化疗后不同时间点对白血病小鼠的肝脾进行病理检查,化疗后第8天在肝内检测到白血病浸润灶,第9天起病灶数量大幅度增加,第16天达(61.3±8.2)。以每10个低倍视野白髓个数来计数脾脏,化疗后第6天起白髓面积明显扩大,数量增多,但不能辨认出明显的白血病细胞浸润。
2.3 移植生物试验 白血病小鼠化疗后3 d,肝脏、脾脏和股骨骨髓均未检出明显的白血病细胞,将肝脏、脾脏和骨髓细胞接种正常C57BL/6小鼠,受鼠生存时间均大于60 d。由受鼠的生存时间推断供鼠器官的残留白血病细胞。
2.4 MRL模型的建立 接受不同剂量CTX化疗后,CTX剂量每增加50 mg·kg-1,小鼠生存时间延长2~4 d。化疗量增加到250 mg·kg-1以上时,尽管生存时间有所延长,但增长幅度明显延缓,3组之间差异无统计学意义(P>0.05)。CTX剂量和生存时间之间有良好剂量 -效应关系,回归方程为 y天数=0.15x剂量+7.38。结果显示,随着CTX剂量的增加,白血病小鼠体内白血病细胞数逐渐下降,小鼠的生存时间逐渐增加。化疗剂量达100 mg·kg-1时小鼠的存活时间相当于接种500个白血病细胞时小鼠存活时间,约为26 d,因此选择100 mg·kg-1为MRL的造模剂量。不同剂量CTX化疗后小鼠的存活时间见表1。
3 讨论
小鼠造血系统特点与人类十分相似,同时近交系动物基因纯合度高,遗传背景均一,易于控制,重复性好。因此,选择近交系小鼠构建MRL模型更能近似反映人体的实际情况。国外的MRL实验研究多采用BNML模型,该模型使用LT12细胞和BN大鼠建立,具有重复性好、发病规律等特点[7-8]。但国内缺乏BN近交系大鼠,所以难以开展工作。我们前期应用FBL-3细胞和C57BL/6小鼠建立了红白血病模型,其结果显示,C57BL/6小鼠接种1×103~1×107个FBL-3细胞,发病率均为100%,无自发缓解现象,并且接种FBL-3细胞数量与小鼠存活时间呈负相关。为了建立一种细胞株传代方便、模型重复性好,能模拟人类急性白血病缓解和复发过程的MRL理想模型,作者在原工作基础上,给予接种1×106个FBL-3细胞的C57BL/6小鼠不同剂量的CTX化疗,结果发现,CTX不仅可有效地杀灭白血病细胞,延长小鼠存活时间,而且其剂量与小鼠的存活时间有良好的剂量-生存时间关系。每增加50 mg·kg-1的CTX,小鼠存活时间增加2~4 d,小鼠全部死于白血病复发。因为接种500个细胞的小鼠存活天数与接种1×106个细胞后第3天给予CTX 100 mg·kg-1化疗的小鼠生存时间相当。因此,我们选择CTX 100 mg·kg-1为MRL的造模剂量。
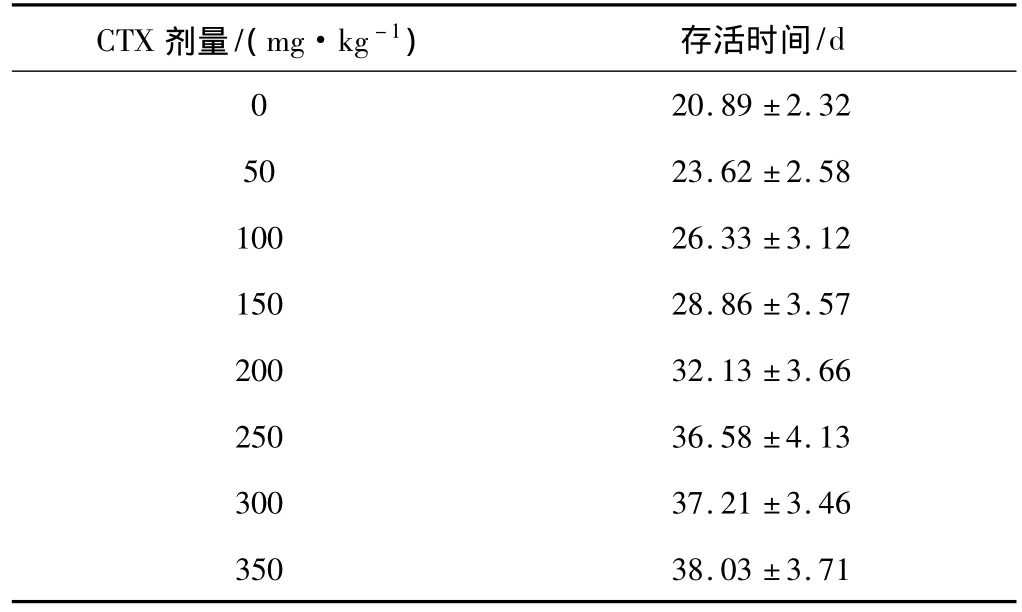
表1 不同剂量CTX化疗后小鼠的存活时间
移植生物试验是检测MRL模型全身各器官和部位MRL细胞的最敏感方法,Martens等[9]的研究资料显示,其敏感性可达10-8~10-9。C57BL/6白血病小鼠化疗后第3天,我们使用肝脏、脾脏和骨髓细胞进行移植生物试验,结果显示,小鼠肝脏、脾脏和骨髓中存在的白血病细胞均少于10个,与供鼠肝脏、脾脏病理检查结果一致,受鼠存活时间均>60 d。但按回归方程 y剂量=121.45 -17.14 lg x细胞数推算,此时体内应残留白血病细胞应在10个左右。我们推测,这些白血病细胞可能存在于肝脏、脾脏和骨髓以外的组织器官中,MRL细胞在机体各组织器官的分布是不均匀的。这与Hagenbeek等[10]的实验结果一致。
[1] Laczika K,Mitterbauer G,Mitterbauer M,et al.Prospectivemonitoring ofminimal residual disease in acutemyeloid leukemia with inversion(16)by CBFbeta/MYH11 RT-PCR:implications for amonitoring schedule and for treatment decisions[J].Leuk Lymphoma,2001,42(5):923 -931.
[2] Eckert C,Biondi A,Seeger K,et al.Prognostic value ofminimal residual disease in relapsed childhood acute lymphoblastic leukaemia[J].Lancet,2001,358(9289):1239 -1241.
[3] Sato K,Torimoto Y,Tamura Y,et al.Immunotherapy using heatshock protein preparations of leukemia cells after syngeneic bone marrow transplantation in mice[J].Blood,2001,98(6):1852-1857.
[4] Hendrikx PJ,Martens AC,Schultz FW,etal.Monitoring of leukemia growth in a ratmodel using a highly sensitive assay for the detection of LacZmarked leukemic cells[J].Leukemia,1995,9(11):1954-1960.
[5] 吴远彬,周健,郭坤元,等.移植性C57BL/6小鼠FBL-3红白血病模型的建立及其生物学特性[J].肿瘤基础与临床,2010,23(3):192-194.
[6] 褚建新,王敏,杨天楹,等.微小残留白血病的实验研究[J].中华血液学杂志,1991,12(8):394.
[7] Martens AC,Hagenbeek A.Amifostine(WR2721)for dose escalation inmarrow-ablative treatment of leukaemia[J].Eur JCancer,1999,35(4):634 -640.
[8] 陈琳军,丁训杰,许小平,等.以LacZ基因标记的大鼠微量残留血病细胞的分布研究[J].中华血液学杂志,2000,21(2):6-9.
[9] Martens AC,Van Bekkum DW,Hagenbeek A.The BN acutemyelocytic leukemia(BNML)(a rat model for studying human acute myelocytic leukemia(AML))[J].Leukemia,1990,4(4):241-257.
[10] Hagenbeek A.Minimal residual disease in leukemia:state of the art1991[J].Leukemia,1992,6 Suppl 2:12 -16.
Establishment of Minimal Residual Leukem ia Model in C57BL/6 Mice
Zhang Xiaojie,Jiang Dongxia,Zhou Jian,Fang Baijun,Zhang Gongli,Fu Yuewen,Wei Xudong,Song Yongping
(The Tumor Hospital Affiliated to Zhengzhou University,Zhengzhou,450003)
ObjectiveTo establish FBL-3 minimal residual leukemia(MRL)model in C57BL/6 mice.Methods5×106FBL-3 cellswere inoculated intravenously into C57BL/6mice and the relationship of the amountof inoculated cells and the survival time ofmouse was investigated.On the third day,cyclophosphamide(CTX)of different dose was infused into thesemice through vena caudalis and the relationship of the dose of CTX and the survival time ofmouse was investigated.Resultsof the above two stepswere combined to decide the dose of CTX in construction ofminimal residual leukemia model of FBL-3 cells in mice.ResultsThe survival time increased following the increase of the doses of CTX.Themodel of leukemia was sensitive to CTX and the time of survivalwas related to the dose of CTX
.The results of biological transplantation experiments indicated that the survival time of the inoculated mouse treated with CTX at100 mg·kg-1was equal to that of themouse inoculated with 500 FBL-3 cells without treatment.ConclusionMRL Model could be established by C57BL/6 mice intravenously inoculated 5 ×106FBL-3 cell and chemotherapy by 100 mg·kg-1CTX after inoculation the third day.
leukemia cell;minimal residual leukemia;mice;model
10.3969/j.issn.1673-5412.2013.02.002
R733.7;R73-35+2
A
1673-5412(2013)02-0097-03
张小杰(1987-),女,硕士在读,主要从事血液病学研究。E-mail:z20055610331@163.com
宋永平(1963-),男,教授,主要从事血液病学研究。E-mail:songyongping@medmail.com
2012-07-17)
