电动势法测定化学反应的热力学函数实验的改进
2013-01-19屈景年曾荣英
聂 雪,屈景年,曾荣英,刘 玲
(衡阳师范学院 化学与材料科学系,湖南 衡阳 421008)
采用测定电池电动势温度系数法求化学反应的热力学函数变化值,比用热化学方法得到的值更精确,同时,它还具有测试方法简单、测试灵敏度高和重现性好等优点。因此,电动势法测定热力学函数变化值,是重要的基础物理化学实验[1],大多数物理化学实验教材选用如下电池作为热力学函数测定的对象[2-3]:
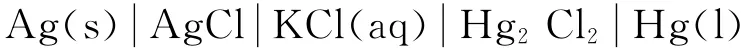
我们在多年教学中发现选用上述电池作为热力学函数测定对象存在以下几个问题:(1)该电池的理论电势值较小(T=298K,45.5mv),现在一般教学型仪器精密度都不是太高,如果再考虑电极的误差,最后通过误差传递得到实验结果的误差就会很大,达不到物理化学实验教学目的与要求。(2)该电池使用的甘汞电极其电极电势随温度变化而变化,电动势与温度之间存在如下关系[2]:
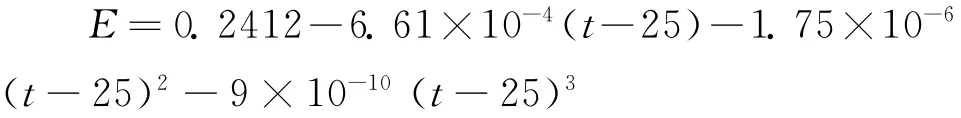
当改变实验温度测量电池电动势的温度系数(∂E /∂T)P时,甘汞电极的电极电势随温度变化函数关系较复杂,使得该电池电动势随温度变化的测定结果波动较大。在作E~T曲线时就会引入较大的人为误差,这种误差通过温度系数传递到热力学函数,实验结果很不理想。针对上述问题,我们设计了如下电池:
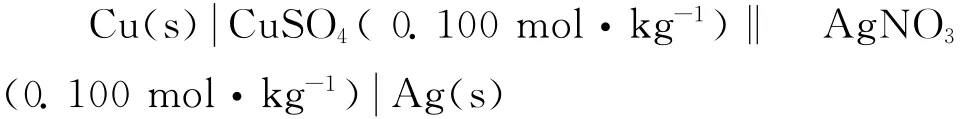
电池反应 Cu+2Ag+=2Ag+Cu2+
改进后的电池电动势理论值较大,且改进后电池电动势随温度的变化值与实验教材选用的电池电动势随温度变化值基本相当,学生通过常规的实验仪器,利用自己制作的盐桥和电极进行实验,相对误差较小,所得实验结果的准确性较高。经过几年的学生实验证明,实验效果较好。
1 改进实验的内容
1.1 实验原理
对电池:Cu(s)|CuSO4(m1)‖AgNO3(m2)|Ag(s),当电池放电时,负极起氧化反应 Cu→Cu2+(α(Cu2+))+2e-
正极起还原反应 2Ag+(α(Ag+))+2e-→2Ag
电池总反应为 Cu+2Ag+(α(Ag+))→2Ag+Cu2+(α(Cu2+))
电池电动势为:
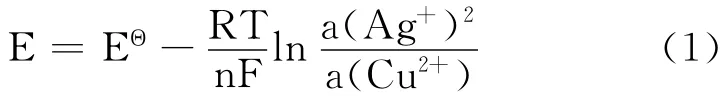
对定温定压下的可逆电池而言:
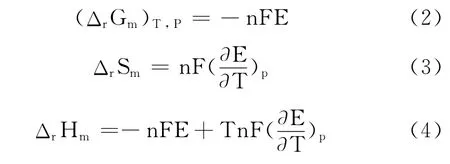
式中,F为法拉弟(Farady)常数;n为电极反应式中电子的计量系数;E为电池的电动势。在恒压下,测定一定温度T时的电池电动势E,即可求得电池反应的ΔG。测定不同温度下的电动势,以电动势对温度作图(E~T曲线图),从曲线上求得电池的温度系数,代入式(3)和式(4),进而求得电池反应的ΔrSm和ΔrHm。
1.2 实验装置
目前电池电动势温度系数测定实验中,所采用的测定装置存在一些缺点需要改进。我们设计了一种简单、易行的测定装置,如图1所示,三管式电池结构示意图,A,B,C为电池装置的三支管,A,C两支管分别插入两个电极(E1和E2),盛放相应的电解质溶液(S1和S2),B支管用于插入温度计,D为用琼脂制成的盐桥。
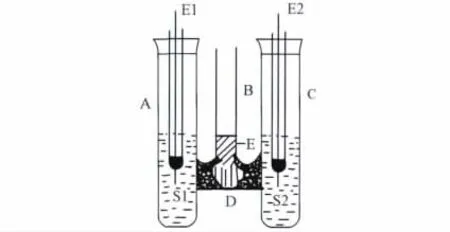
图1 三管式电池测定装置
1.3 实验仪器和试剂
实验仪器:电位差计;稳压电源(或蓄电池);标准电池;银电极;铂电极;铜电极;烧杯;三管式电池测定装置;毫安表;电阻箱;自制NO3NH4盐桥[4];超级恒温水槽。
实验试剂:CuSO4(m1)(0.100mol·kg-1)溶液;AgNO3(m2)(0.100mol·kg-1)溶液;稀硝酸溶液;镀银液;镀铜液
1.4 实验步骤
(1)银电极的制备
将要镀的银电极用细砂纸轻轻打磨至露出新鲜的金属光泽,用蒸馏水洗净。将欲用的Pt电极浸入稀硝酸溶液片刻,取出用蒸馏水洗净。将洗净的电极分别插入盛有镀银液(100mL镀液组成:3.0 g硝酸银、60g碘化钾和7.0mL浓氨水)的小瓶中[2],按图2接好线路,控制电流为1.0mA/cm2镀1h,得银白色紧密的镀银电极。
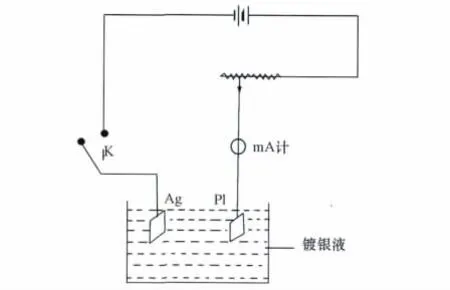
图2 镀银线路图
(2)铜电极的制备
将铜电极用砂纸擦光并用水冲洗,在1∶3的稀硝酸中浸泡片刻,取出洗净,作为阴极,以另一铜板作阳极在镀铜液中电镀(镀铜液组成为:每升中含125g CuSO4·5H2O,25g H2SO4,50mL乙醇[2])。按图3接好线路,控制电流为20mA/cm2,电镀20~30min得表面光亮的Cu电极,洗净后放入0.100mol·kg-1CuSO4中备用。
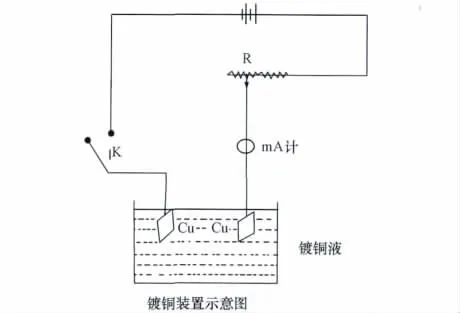
图3 镀铜线路图
(3)电池电动势的测定
采用图1三管式电池测定装置,A,C两支管分别插入自制的电极,加入相应的电解质溶液;B支管插入温度计;D为用琼脂和NO3NH4制成的盐桥,E中为饱和NO3NH4溶液。将其置于恒温水浴中,用电位差计分别测定教材指定电池(电池1:和改进后电池(电池2:Cu(s)|CuSO4(m1)‖AgNO3(m2)|Ag(s))在不同温度下的电动势值,每次升温达到指定温度后再恒温10分钟左右开始测电池电动势,当数值稳定在±0.1mV之内时即可认为电池已达到平衡。实验温度选择293K,298K,303K,308K,313K,318K,323K每隔5℃测定一次电动势。
2 结果与讨论
实验温度范围内,采用三管式电池测定装置,测得电池1和电池2的实验结果如表1、表2所示:

表1 电池1电动势随温度变化关系
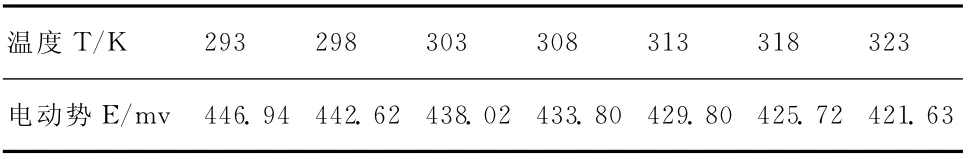
表2 电池2电动势随温度变化关系
由于在温度不高时,非气体电极的电极电势与温度近似呈直线关系[5-6],因此可由测得的不同电池的实验数据Ei、Ti值,分别绘制E-T曲线,结果如图4、图5所示:
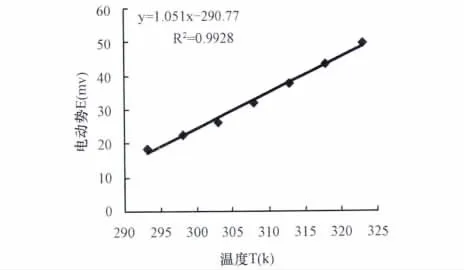
图4 电池1的E-T曲线

图5 电池2的E-T曲线
结果与文献[7]相近。同理由式(2)、(3)、(4)可求得电池2反应的热力学函数如下:ΔrG298=-85.426kJ/moL;ΔrS298=-162.602J/moL/K;ΔrH298=-133.881kJ/moL。而电池2理论:ΔrG298=-88.724kJ/moL;ΔrS298=-194.46J/moL/K;ΔrH298=-146.388kJ/moL。相对误差分别为:3.7%;16.4%;8.54%。
3 结 论
实验结果证明:我们所作的改进同原来的实验相比有以下的优点:
(1)改进后电池的理论电池电动势值(459.71 mV)较大[7],在一般实验参考书所指定的仪器条件下容易测定,且从E-T曲线的回归方程可以看出:电池的稳定性较高;重复性较好。
(2)改进电池后,实验所得ΔrG298、ΔrS298、ΔrH298的相对误差分别为3.7%;16.4%;8.54%,比测得教材选用电池的ΔrG298、ΔrS298、ΔrH298的相对误差少很多,实验结果的准确度大大提升。
(3)改进后实验采用三管式电池测定装置,D处中间大两端细的巧妙设置,减少盐桥中的电解质向两侧溶液扩散[8],学生操作简单,方便,具有通用性。在整个测量过程中,系统处于密封状态,可减少溶液中溶剂挥发而影响溶液的浓度变化,使实验结果更准确。
(4)改进的电池属双液化学电池,由盐桥产生的液体接界电势对实验结果有一定的影响,如果设计成双联浓差电池消除液体接界电势,实验结果会更准确。
[1]林清枝.电动势与温度关系实验的改进[J].大学学报,1989,4(1):48.
[2]复旦大学.物理化学实验[M].3版.北京:高等教育出版社,2004.
[3]孙尔康,徐维清,邱金恒,等.物理化学实验[M].南京:南京大学出版社,1998.
[4]秦旅.巧制盐桥[J].化学教育,1998,6(4):14-15.
[5]夏海涛.物理化学实验[M].哈尔滨:哈尔滨工业大学出版社,2003.
[6]天津大学物理化学教研室.物理化学:下册[M].北京:高等教育出版社,1985.
[7]印永嘉,祁学勇.物理化学简明手册[M].北京:高等教育出版社,1988.
[8]阚锦晴,薛树忠,耿文英.原电池电动势测定方法的改进[J].大学学报,1994,9(8):123-124.
