草甘膦对青鳉鱼卵黄蛋白原的诱导及其潜在分子机理
2013-01-18赵砚彬杨鸣琦胡建英
夏 爽,赵砚彬,杨鸣琦,胡建英*
(1.西北农林科技大学动物医学院,陕西 杨凌 712100;2.北京大学城市与环境学院,北京 100871)
有机磷类化合物在农业生产中被逐渐广泛应用.近年来,随着一系列低毒有机磷农药[1-2]、阻燃剂[3]等有机磷化合物的开发和市场化,有机磷类化合物在人类生活以及工农业生产中占的地位越来越重要,其毒性也随之受到人们的重视.
长久以来,人们对有机磷化合物毒性的关注大多只集中在急性神经毒性上[4],对其内分泌干扰作用如雌激素效应,则研究甚少.体外实验表明有机磷化合物并不能通过结合雌激素受体而引起雌激素效应.如Chen等[5]通过MCF-7细胞体外增殖实验和雌激素受体体外结合活性实验证明,辛硫磷、马拉硫磷、乐果和久效磷 4种有机磷农药并不显示雌激素效应; Kojima等[6]也利用体外雌激素受体结合实验证明久效磷等有机磷农药不能引起雌激素效应.近年来也有文献报道了有机磷类物质对脑垂体促性腺激素具有一定的干扰作用.如 Esmail等[7]将二嗪磷暴露雄性小鼠,导致其血清中促黄体生成素(LH)和卵泡刺激素(FSH)含量升高;Joshi 等[8]将雄性大鼠暴露于乙酰甲胺磷,也同样观察到血清中LH、FSH含量的上升,显示有机磷可影响脑垂体促性腺激素的合成.但是有机磷类物质是否能够通过对脑垂体促性腺激素的干扰作用产生雌激素效应还没有相关的报道.
草甘膦,由于高效、低毒、广谱、内吸传导非选择的特点,近年来成为全世界应用最广的有机磷除草剂[9],具有较高的环境浓度.Sanchís等[10]在西班牙检测了 140个不同地区地下水样品中,有 41%检出了草甘膦,平均浓度为 200ng/L,最高浓 度 为 2.5μg/L;Popp 等[11]调 查 了 奥 地 利Vorarlberg地区最主要的河流,草甘膦浓度大约为0.67μg/L;Peruzzo等[12]对阿根廷布宜诺斯艾利斯省某主要农产区河流调查显示,草甘膦甚至达到 0.70mg/L.但是目前对草甘膦毒性的研究集中于急性毒性上,没有关于草甘膦内分泌干扰作用方面的研究.
本研究以青鳉鱼为实验动物,通过定量 PCR评估了草甘膦对肝脏VTG的潜在诱导作用,并通过分析调控雌激素合成的一系列脑垂体性腺轴关键基因和肝脏雌激素代谢酶基因的表达变化对其诱导机理进行了深入的解析.
1 材料与方法
1.1 材料与试剂
40wt.%草甘膦异丙胺盐水溶液,购自 sigma;trizol,购自invirogen;M-MMLV反转录套装,购自康维世纪;SYB ®Green PCR Master mix,购自invirogen.
1.2 实验用鱼饲养
青鳉鱼(Orange-Red strain)由本实验室繁殖并饲养,养殖用水为经活性碳过滤并曝气的自来水.水温控制在(25±1)℃,水硬度(以 CaCO3计)为(81.1±1.2)mg/L, pH 值为 7.9±0.1,溶解氧为(7.8±0.3)mg/L.光周期为 16h: 8h(昼:夜),以丰年虫(Artemia nauplii)刚孵化出的幼虫为饵料,每天上午下午各喂食一次,并及时清除多余饵料和排泄物.
1.3 暴露实验
采用刚孵化出 1~3d(1~3dph)的鱼苗,进行暴露实验.共设置5个浓度梯度,每个梯度的草甘膦异丙胺盐浓度分别为 0.2,2,20,200,2000µg/L.以经活性碳过滤并曝气的自来水做空白对照.每日全量换水.用超纯水稀释40wt.%草甘膦异丙胺盐水溶液配制一系列浓度为 0.004,0.04,0.4,4,40μg/μL 的标样,取 200μL 的上述标样到对应的4L暴露池中,使暴露池终浓度分别为 0.2,2,20,200,2000µg/L.
暴露持续5周,在最后1d,每组随机取雌雄鱼各6条,用冰块麻醉,然后每条鱼分别取肝脏、性腺和脑,做好标记,放入液氮中,用来提取总RNA.
1.4 总RNA提取和cDNA第一链合成
采用Trizol试剂分别提取肝脏、脑、性腺组织总RNA,然后对提取的总RNA进行DNase I处理和纯化.所得总RNA紫外光吸收A260/280大于1.8.采用HiFi-MMLV逆转录酶和OligodT15引物合成cDNA第一条链.
1.5 荧光定量PCR检测
根据本实验室已建立的方法,用ABI7500型荧光定量 PCR仪进行荧光定量 PCR检测,RPL-7用作内参基因校正实验误差[13].Primer Premier 5.0(Premier Biosoft)设计所测基因的引物序列,设计时尽可能的跨越内含子,以降低DNA污染.引物具体序列见表1,由北京三博远志生物技术公司合成.

表1 实时定量PCR引物Table 1 Primer pairs of SYBR® Green real-time PCR
1.6 数据处理
定量 PCR数据以 2-ΔΔCt法计算基因的相对表达量.采用SPSS软件(Ver 11.5; Chicago, IL,美国)的独立样品t检验,来检验不同暴露组和对照组的基因表达差异的显著性,P<0.05为差异显著.每个基因的不同浓度暴露组的基因表达量用对照组基因表达量的倍数表示.
2 结果
2.1 肝脏卵黄蛋白原基因表达变化
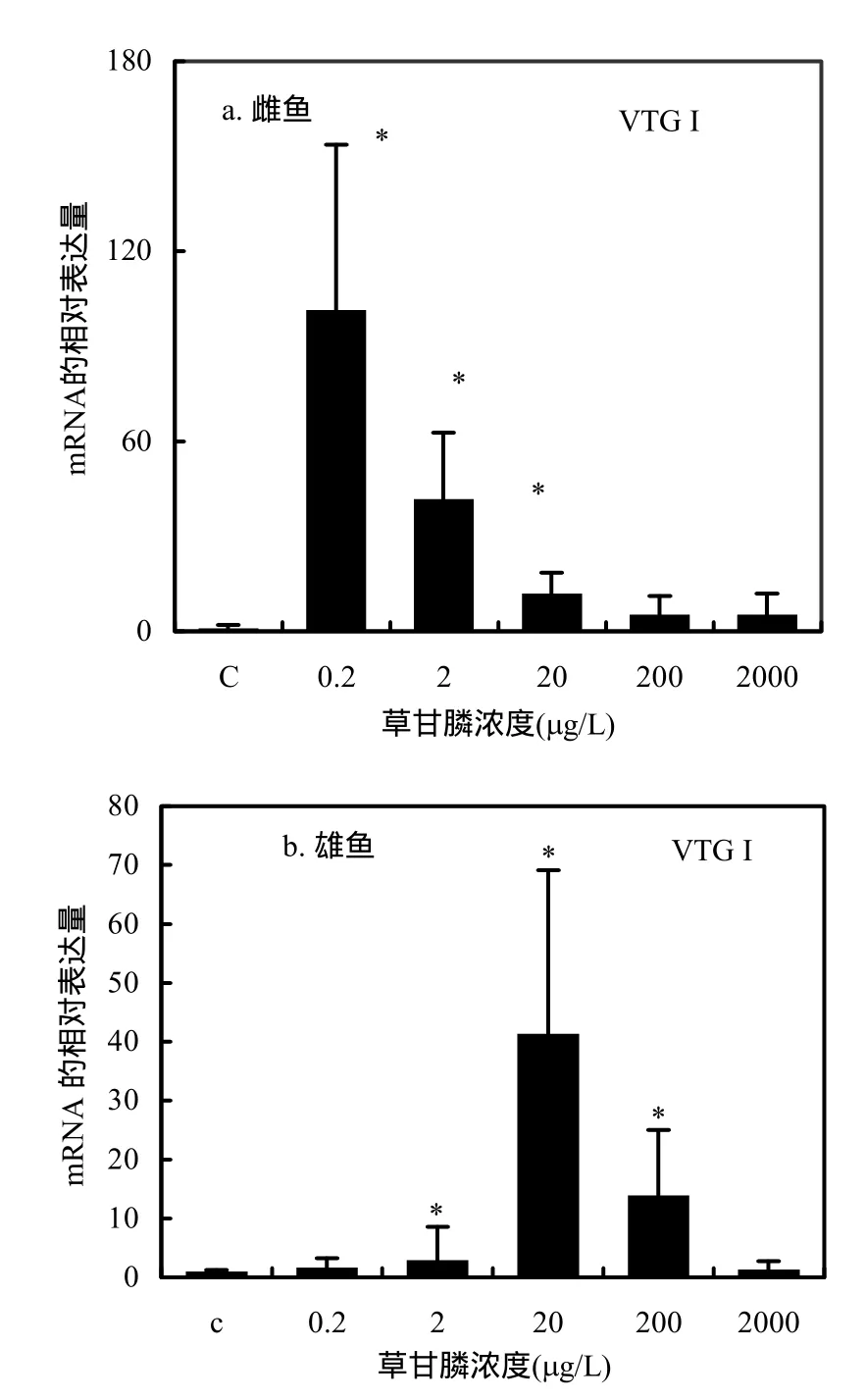
图1 草甘膦暴露对青鳉鱼肝脏中卵黄蛋白原(VTG I)表达量的影响Fig.1 Vitellogenin gene expression in liver of medaka exposed to glyphosate
在雌性幼鱼中,草甘膦在低浓度下(0.2µg/L)即可显著诱导雌鱼卵黄蛋白原基因表达 (P<0.05),但是随着暴露浓度的增加,VTG I的表达量逐渐降低,呈现明显的剂量效应关系.随着暴露浓度的升高,VTG各浓度组基因表达量分别为对照组的101.36、41.76、11.92、5.26、5.34倍(图1a).在高浓度组(200,2000µg/L),和对照比VTG I基因表达虽仍有所增加,但并不显著.在雄鱼中,草甘膦对VTG I基因表达诱导呈现先升后降的趋势:浓度为0.2、2、20µg/L时,VTG I基因表达量分别为对照组的1.64、2.87、41.35倍,浓度增加到200, 2000µg/L时,VTG I的表达量分别是对照组的13.92和1.31倍(图1b).除最低暴露组(0.2µg/L)和最高暴露组(2000µg/L),其余各组 VTG I均被显著诱导.
2.2 雌激素合成和代谢酶基因表达变化
2.2.1 脑垂体性腺轴基因表达变化 对垂体性腺轴中的15个基因进行了检测.其中3个下丘脑促性腺激素释放激素(cGnRH、mdGnRH、sGnRH)基因[14]和 3个垂体促性腺激素亚基(GtHα、FSHβ、LHβ)基因[15-16],分别调控垂体促性腺激素和性腺中性激素的合成分泌.另外,还涉及9个激素合成相关基因(StaR、HMGR、CYP11A、CYP11B、CYP17、CYP19A、3β-HSD、17β-HSD I、17β-HSDⅢ).在类固醇激素合成的早期步骤,胆固醇的合成主要由羟甲基戊二酰辅酶 A还原酶(HMGR)这一酶调控[17].类固醇急性调节蛋白(StAR)负责将胆固醇转运至线粒体内,启动类固醇激素的合成[18].CYP11A催化胆固醇生成孕烯醇酮,这是类固醇激素生物合成的起点,后经3β-HSD酶催化合成孕酮.CYP17酶具有17α-羟化酶和 17,20-裂解酶两种活性,可分别催化生成17α-羟基孕酮和雄烯二酮,两个合成下游雌雄激素的前体物.CYP19A和CYP11B分别调控雌激素雌二醇(E2)和雄激素 11-酮基睾酮(11-KT)的合成[19-20].17β-HSD I可使雌酮转化为生物活性更高的雌二醇.17β-HSDⅢ为雄激素的代谢酶,使雄烯二酮还原为睾酮[21].该 15个基因基本涵盖了整个垂体性腺轴调控性激素合成过程[22].本研究通过定量PCR检测,筛选出显著受到草甘膦影响的基因,以进一步解释草甘膦雌激素效应的分子机理.
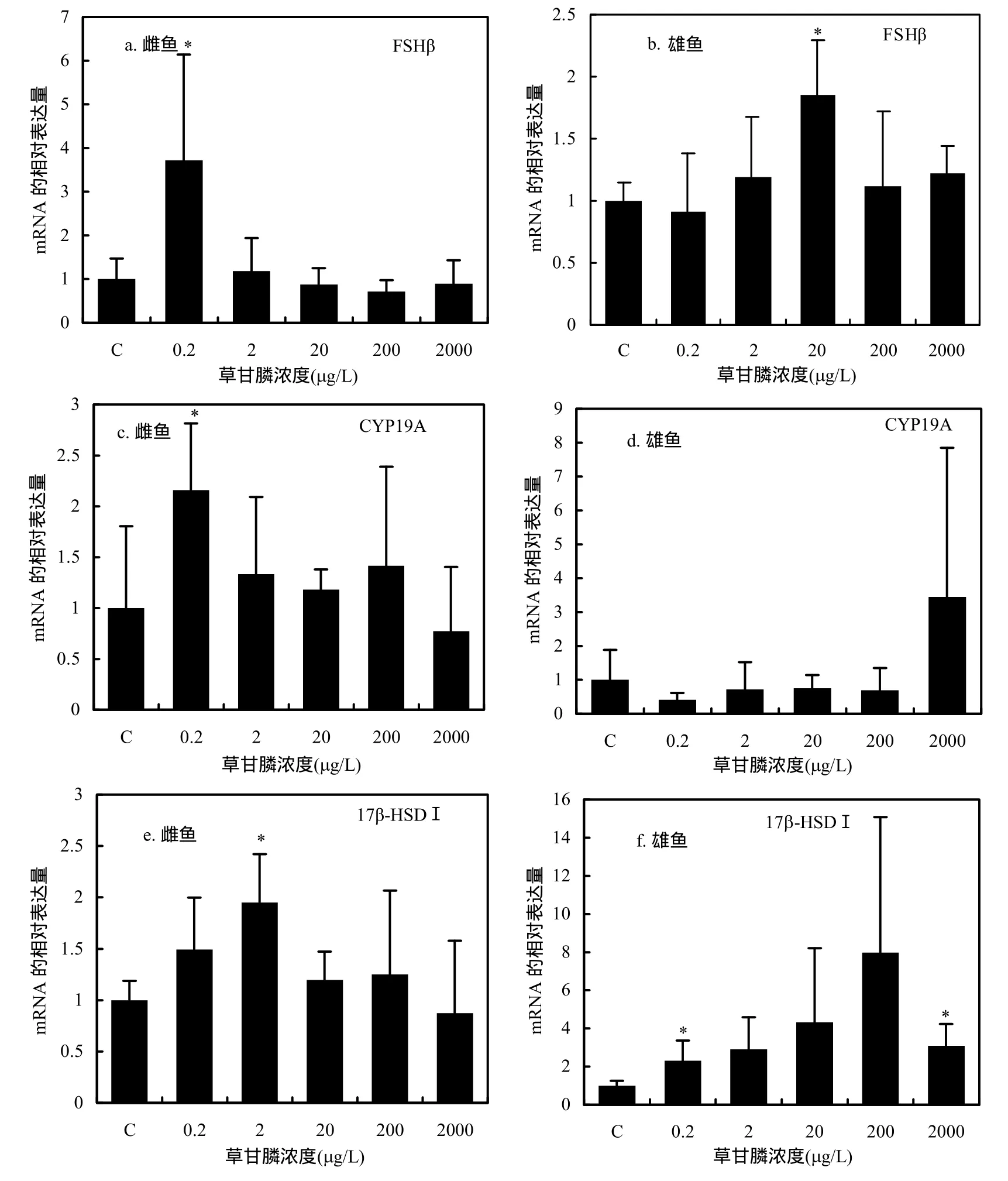
图2 草甘膦暴露对青鳉鱼垂体性腺轴关键基因表达量的影响Fig.2 Hypophysial-gonadal axis key genes expression of medaka exposed to glyphosate
结果显示,在雌鱼中,从低浓度组到高浓度组,脑部 FSHβ mRNA相对表达量分别为对照组的3.71、1.19、0.87、0.72、0.90 倍.如图 2a,在 0.2µg/L草甘膦暴露下,雌鱼的 FSHβ 表达显著上调(P<0.05),其他各浓度组变化不显著;性腺CYP19A和17β-HSD I基因相对表达量分别为对照组的2.16、1.33、1.18、1.42、0.77 倍(图 2c)和 1.49、1.95、1.19、1.25、0.87倍(图 2e).CYP19A 基因在 0.2µg/L 草甘膦浓度下,被显著诱导(P<0.05),而其他浓度组表达量相对对照组没有明显变化,但随浓度升高而逐渐下降.17β-HSDI基因在2µg/L草甘膦浓度下被显著诱导(P<0.05),在其余各浓度组该基因表达并没有显著变化.
从低浓度组到高浓度组,雄鱼脑部 FSHβ mRNA相对表达量分别为对照组的0.91、1.19、1.85、1.12、1.23倍(图 2b),但是只有在 20µg/L时,才被显著诱导(P<0.05);雄鱼 17β-HSDI 基因相对表达量分别为对照组的2.31、2.90、4.33、7.98、3.08 倍(图 2f).在 0.2µg/L和 2000µg/L 浓度时,17β-HSD I 表达量显著上升(P<0.05),其余各组中17β-HSD I基因表达量呈现上升趋势,相对对照组均有2倍以上差异,但并不显著.
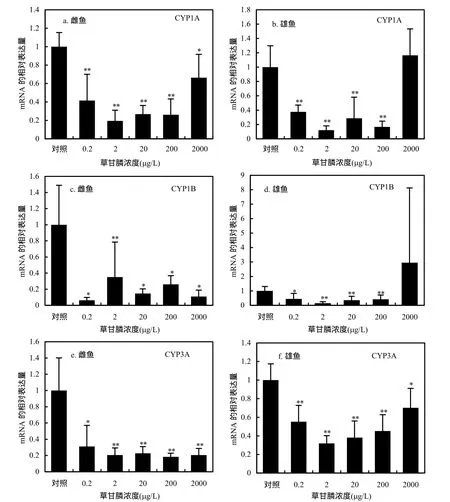
图3 草甘膦暴露对青鳉鱼肝脏中主要雌激素代谢酶CYP1A、CYP1B和CYP3A表达量的影响Fig.3 Expression of estrogen-related metabolic genes in liver of medaka exposed to glyphosate
2.2.2 雌激素代谢酶基因表达变化 各浓度组草甘膦暴露均能显著抑制雌鱼体内雌激素代谢酶基因的表达(P<0.05).CYP1A、CYP1B 和 CYP3A mRNA表达量,按浓度递增的顺序,分别为对照组的 0.42、0.19、0.27、0.26、0.66 (CYP1A)倍;0.06、0.35、0.15、0.26、0.11(CYP1B)倍和 0.31、0.20、0.23、0.18、0.21(CYP3A)倍(图 3a、3c 和3e).CYP1A的表达量,随着暴露浓度的升高,呈现先降后升的U型变化趋势,而CYP1B和CYP3A各浓度组的表达量则相对稳定.
如图3b、3d和3f,从低浓度到高浓度的各暴露组中,雄鱼 CYP1A mRNA表达量分别为对照组的0.38、0.12、0.27、0.17、1.16倍;CYP1B表达量分别为0.44、0.15、0.36、0.42、2.94倍;CYP3A表达量分别为0.55、0.32、0.38、0.45、0.70倍.除了CYP1A和CYP1B在最高浓度组表达量和对照组无显著差异,雄鱼肝脏雌激素代谢酶的表达在其他浓度组均被显著抑制(P<0.05),并且随着暴露浓度的升高,均呈现出先降后升的U型表达模式.
3 讨论
本研究中,草甘膦暴露能够显著诱导雌雄青鳉鱼中 VTGI基因的表达,并呈现一定的剂量效应关系(图1),表明草甘膦具有一定的雌激素效应.并且雄鱼 VTGI基因诱导能力明显小于雌鱼,这与 Bickley等[23]的研究结果一致,即雌鱼对雌激素物质较雄鱼更加敏感.
Petit等[24]通过酵母双杂交筛选实验,证明草甘膦本身并不具有雌激素受体结合活性,Hiroyuki Kojima等[6]利用转染人雌激素受体和雌激素反应元件重组质粒的中国仓鼠肝细胞进行草甘膦雌激素受体结合活性实验,也得到相似的结果.这些实验结果说明草甘膦并不能直接介导雌激素受体而诱导肝脏 VTG表达.大量文献[25-27]已经证明,鱼体内 VTG 合成主要依赖于血液中雌二醇(17β-E2)浓度水平,并受到 17β-E2的直接调控,因此为了进一步分析草甘膦诱导VTGI表达的潜在机理,本研究测定了雌激素合成和代谢相关基因的表达变化.
芳香化酶(CYP19)和 17β-羟基类固醇脱氢酶(17β-HSDI)是促进性腺雌激素合成的两个重要酶,能够将睾酮(Testosterone,T)转化 17β-E2、雌酮(Estrone,E1)转化 17β-E2[28].在草甘膦雌鱼2µg/L 暴露组,性腺17β-HSDI显著表达(P<0.05),可能对VTG的上升具有一定贡献.而在脊椎动物中,肝脏细胞色素450酶(CYP450s)中的CYP1A、CYP1B和CYP3A是将17β-E2代谢为2-羟雌二醇(2-OHE2)的主要酶[29],研究表明,在鱼类中,CYP1A在17β-E2代谢中起到的作用更大[30].
结果显示,雌鱼脑部FSHβ和性腺CYP19A在最低浓度下即被显著表达(P<0.05),而后随暴露浓度的升高,表达量呈现降低的趋势,显示出与雌鱼 VTG相似的表达模式.这可能是由于脑部 FSH可以提高性腺芳香化酶(CYP19A)的表达量和活性[31-32],从而增加了性腺雌激素合成,最终导致 VTG合成量升高.另一方面雌鱼肝脏雌激素代谢酶,在各暴露浓度组均被显著抑制(P<0.05),这种抑制作用与毒死蜱抑制 CYP1A表达的报道类似[33-34].
同雌鱼相似,雄鱼肝脏雌激素代谢酶表达也被显著抑制.另外,在 E2代谢过程中起到作用更大的CYP1A,呈现U型的表达模式,和雄鱼VTG基因表达的倒 U型的剂量效应关系一致.据Anderson等[35]以虹鳟鱼肝细胞进行的体外实验显示,CYP1A表达同VTG的合成具有负相关性.因此,草甘膦抑制雄鱼体内雌激素代谢而诱导肝脏VTG基因表达.除了代谢因素,雄鱼脑部FSHβ虽然具有和 VTG相同的表达模式,但性腺CYP19A基因在各浓度组均未有显著变化.雄鱼17β-HSDI在最低和最高两个浓度组,均有显著表达(P<0.05),但是这两组的VTG表达量并没有显著变化,而在 VTG表达量显著上升的实验组,雄鱼 17β-HSDI均有两倍以上的升高,不过由于组内差异较大,并没有显著性.说明雄鱼17β-HSDI在 VTG上升过程中可能并不起关键作用.
4 结语
一定浓度范围内草甘膦可以诱导青鳉鱼VTG 表达,显示雌激素效应.并且其雌激素效应的诱导机理在雌雄鱼中存在一定的差异.在雌鱼体内草甘膦通过上调脑部 FSH表达,诱导CYP19A表达,从而加强了雌激素合成能力.而在雄鱼中,则主要通过抑制肝脏雌激素代谢酶(CYP1A 和CYP3A),使体内17β-E2浓度升高从而诱导VTG表达变化.
[1] 贺红武,刘钊杰.有机磷农药的发展趋势与低毒有机磷杀虫剂的开发和利用(上) [J]. 世界农药, 2001,23(3):1-5.
[2] 贺红武,刘钊杰.有机磷农药的发展趋势与低毒有机磷杀虫剂的开发和利用(下) [J]. 世界农药, 2001,23(4):26-31.
[3] 高 峰,朱梦如.有机磷系阻燃剂的研究与应用 [J]. 武警学院学报, 2009,25(4):9-12.
[4] 杨再福,赵晓祥.环境雌激素对水生动物的影响研究进展 [J].生态环境, 2005,14(1):108-112.
[5] Chen Haiyan, Xiao Jigao, Hu Gang, et al. Estrogenicity of organophosphorus and pyrethroid pesticides [J]. Journal of Toxicology and Environmental Health, 2002,65:1419-1435.
[6] Hiroyuki Kojima, Eiji Katsura, Shinji Takeuchi, et al. Screening for Estrogen and Androgen Receptor Activities in 200Pesticides by In Vitro Reporter Gene Assays Using Chinese Hamster Ovary Cells [J]. Environmental Health Perspectives, 2004,112(5):524-531.
[7] Fattahi E, Parivar K, Jorsaraei S G A. The effects of diazinon on testosterone, FSH and LH levels and testicular tissue in mice [J].Iranian Journal of Reproductive Medicine, 2009,7(2):59-64.
[8] Joshi S C, Sharma P. Effect of acephate on sex hormones, sperm dynamics and fertility in male albino rats [J]. International Journal of Research in Pharmaceutical and Biomedical Sciences,2012,3(1):286-292.
[9] Gonzalo Luis Pérez, María Solange Vera, Leandro Andrés Miranda, et al. Effects of herbicide glyphosate and glyphosatebased formulations on aquatic ecosystems [J]. Herbicides and Environment, 2011,16:343-368.
[10] Sanchís J, Kantiani L, Llorca M, et al. Determination of glyphosate in groundwater samples using an ultrasensitive immunoassay and confirmation by on-line solid-phase extraction followed by liquid chromatography coupled to tandem mass spectrometry [J]. Anal Bioanal. Chem., 2012,402(7):2335-2345.
[11] Popp M, Hann S, Mentler A, et al. Determination of glyphosate and AMPA in surface and waste water using high-performance ion chromatography coupled to inductively coupled plasma dynamic reaction cell mass spectrometry (HPIC-ICP-DRC-MS)[J]. Anal Bioanal. Chem., 2008,391(2):695-699.
[12] Peruzzo P J, Porta A A, Ronco A E. Levels of glyphosate in surface waters, sediments and soils associated with direct sowing soybean cultivation in north pampasic region of Argentina [J].Environmental Pollution, 2008,156:61-66.
[13] Zhang Z B, Hu J Y. Development and validation of endogenous reference genes for expression pro fi ling of medaka (Oryzias latipes) exposed to endocrine disrupting chemicals by quantitative real-time RT-PCR [J]. Toxicol. Sci., 2007,95:356-368.
[14] Kataaki Okubo, Masafumi Amano, Yasutoshi Yoshiura, et al. A Novel Form of Gonadotropin-Releasing Hormone in the Medaka,Oryzias latipes [J]. Biochemical and Biophysical Research Communications, 2000,276:298-303.
[15] Yoshitaka Nagahama, Masakane Yamashita. Regulation of oocyte maturation in fi sh [J]. Develop Growth Differ, 2008,50,S195-S219.
[16] Schulza R W, Vischer H F, Cavaco J E B, et al. Gonadotropins,their receptors, and the regulation of testicular functions in fi sh [J].Comparative Biochemistry and Physiology Part B, 2001,129:407-417.
[17] Hampton R, Dimster-Denk D, Rine J. The biology of HMG-CoA reductase: the pros of contra-regulation [J]. Trends in Biochemical Sciences, 1996,21(4):140.
[18] Walsh L P, McCormick C, Martin C, et al. Roundup inhibits steroidogenesis by disrupting steroidogenic acute regulatory(StAR) protein expression [J]. Environmental Health Perspectives,2000,108(8):769-776.
[19] Baron D, Fostier A, Breton B, et al. Androgen and estrogen treatments alter steady state messenger RNA (mRNA) levels of testicular steroidogenic enzymes in the rainbow trout [J]. Mol.Reprod. Dev., 2005,71:471-479.
[20] Fred Freking, Treza Nazairians, Barney A Schlinger, et al. The expression of the sex steroid-synthesizing Enzymes CYP11A1,3b-HSD, CYP17, and CYP19in gonads and adrenals of adult and developing zebra fishes [J]. General and Comparative Endocrinology, 2000,119:140-151.
[21] 倪 鑫,唐晓露.17β-羟基类固醇脱氢酶 [J]. 生理科学进展,2002,33(2):173-175.
[22] Daniel L Villeneuve, Patrick Larkin, Iris Knoebl, et al. A graphical systems model to facilitate hypothesis-driven ecotoxicogenomics research on the teleost brain pituitary gonadal axis [J]. Environ. Sci. Technol., 2007,41:321-330.
[23] Bickley L K, Lange A, Winter M J, et al. Evaluation of a carp primary hepatocyte culture system for screening chemicals for oestrogenic activity [J]. Aquatic Toxicology, 2009,94(3):195-203.
[24] Petit F, Le Goff P, Cravedi J P, et al. Two complementary bioassays for screening the estrogenic potency of xenobiotics:recombinant yeast for trout estrogen receptor and trout hepatocyte cultures [J]. Journal of Molecular Endocrinology, 1997,19(3):321-335.
[25] Kim B H, Takemura A. Culture conditions affect induction of vitellogenin synthesis by estradiol-17b in primary cultures of tilapia hepatocytes [J]. Comparative Biochemistry and Physiology,2003,135:231-239.
[26] Akihiro Takemura, Byung H Kim. Effects of estradiol-17treatment on in vitro and in vivo synthesis of two distinct vitellogenins in tilapia [J]. Comparative Biochemistry and Physiology, 2001,129:641-651.
[27] Maitre J, Valotaire Y, Guguen-Guillouzo C. Estradiol-17b stimulation of vitellogenin synthesis in primary culture of male rainbow trout hepatocytes [J]. In Vitro Cell. Dev. Biol., 1986,22:337-343.
[28] Daniel L Villeneuve, Patrick Larkin, Iris Knoebl, et al. A Graphical Systems Model to Facilitate Hypothesis-Driven Ecotoxicogenomics Research on the Teleost Brain Pituitary Gonadal Axis [J]. Environ. Sci. Technol., 2007,41,321-330.
[29] Lee A J, Cai M X, Thomas P E, et al. Characterization of the oxidative metabolites of 17beta-estradiol and estrone formed by 15selectively expressed human cytochrome p450isoforms [J].Endocrinology, 2003,144:3382-3398.
[30] Scornaienchi M L, Thornton C, Willett K L, et al. Cytochrome P450-mediated 17β-estradiol metabolism in zebrafish (Danio rerio)[J]. Journal of Endocrinology, 2010,206(3):317-325.
[31] Nagahama Y, Yamashita M. Regulation of oocyte maturation in fish [J]. Development, Growth and Differentiation, 2008,50(s1):S195-S219.
[32] Montserrat N, González A, Méndez E, et al. Effects of follicle stimulating hormone on estradiol-17β production and P-450aromatase (CYP19) activity and mRNA expression in brown trout vitellogenic ovarian follicles in vitro [J]. General and Comparative Endocrinology, 2004,137(2):123-131.
[33] Hreljac I, Filipič M. Organophosphorus pesticides enhance the genotoxicity of benzo (a) pyrene by modulating its metabolism [J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2009,671(1):84-92.
[34] Wheelock C E, Eder K J, Werner I, et al. Individual variability in esterase activity and CYP1A levels in Chinook salmon(Oncorhynchus tshawytscha) exposed to esfenvalerate and chlorpyrifos [J]. Aquatic Toxicology, 2005,74(2):172-192.
[35] Anderson M J, Miller M R, Hinton D E. In vitro modulation of 17-β-estradiol-induced vitellogenin synthesis: Effects of cytochrome P4501A1inducing compounds on rainbow trout(Oncorhynchus mykiss) liver cells [J]. Aquatic Toxicology, 1996,34(4):327-350.
