GST-Smad4融合蛋白的表达与纯化
2013-01-16梅竹杨予涛徐志卿
梅竹 杨予涛 徐志卿
(首都医科大学基础医学院,北京 100069)
转化生长因子-β(TGF-β),是一种具有多种生物学活性的多肽类细胞因子,由多种组织细胞合成,调控细胞周期,影响细胞的增殖、分化、黏附、转移和凋亡,与肿瘤的发生、发展和转归密切相关[13]。TGF-β信号通路主要由TGF-β与其相应的受体和细胞内信号转导分子组成。TGF-β信号通路的胞内转导分子主要由Smads蛋白构成。Smads蛋白主要由受体激活的Smads(R-Smad)、通用型Smads(Co-Smad)和抑制型Smads(I-Smad)构成。受体激活的Smads主要包括Smad2和Smad3,通用型Smads只包括Smad4,抑制型Smads包括Smad6和Smad7。
Smad4基因共有11个外显子,10个内含子,其转录子长2 680 bp,编码由552个氨基酸组成的蛋白质,主要由MH1结构域、MH2结构域和连接区所组成。MH1结构域具有序列特异的DNA结合能力,MH2结构域是形成同/异源聚合物的结合位,同时还具有转录激活和核定位功能[3]。Smad4作为一种抑癌基因,是TGF-β信号通路的重要调节因子,广泛参与细胞分化、增殖、迁移和凋亡等多种生物学过程[4]。
当细胞被TGF-β激活后,引起R-Smads(Smad2和Smad3)的磷酸化,而磷酸化的R-Smads从受体复合物上解离,迅速与Smad4形成异源复合物,然后被转运进细胞后,与Smad结合元件(SBE)结合,并在其它辅助因子的协同下,调节靶基因的表达[5]。因此,在TGF-β信号通路中,Smad4处于中枢地位。鉴于Smad4在TGF-β信号通路中处于的关键地位,本研究拟在体外表达并纯化Smad4蛋白,旨在分离和鉴定与Smad4相互作用的蛋白,从而进一步丰富TGF-β信号通路的组成。
1 材料与方法
1.1 材料
pGEX-4T-1质粒、大肠杆菌DH5α、大肠杆菌BL21(DE3)均为本实验室保存;高保真Taq聚合酶购于Roche公司;质粒提取试剂盒、胶回收试剂盒、PCR纯化试剂盒购于MN公司;反转录试剂盒购于Invitrogen 公司;各种限制性内切酶购于NEB公司;Smad4抗体购于Milipore公司;MagneGST particles购于Promega公司;异丙基-β-D-硫代半乳糖(IPTG)、考马斯亮蓝R-250购于北京普利莱公司;预染分子量标准蛋白marker购于Fermentas公司;引物合成与DNA测序由北京三博远志生物技术有限公司进行。
1.2 方法
1.2.1 HaCaT细胞总RNA的提取 将长满培养瓶的HaCaT细胞用PBS洗两遍,加入1 mL的Trizol(Invitrogen),等细胞充分裂解后,将裂解液转移至无RNase的离心管中。加入0.2 mL的氯仿,震荡混匀,室温放置3 min。4℃,12 000×g离心10 min,将上层水相转移至无RNase的离心管中。加入0.5 mL的异丙醇,室温静置20 min。4℃,12 000×g离心10 min,并用75%的乙醇洗涤RNA沉淀,等沉淀干燥后,加入50 μL无RNase的水,用枪头洗打,使沉淀充分溶解。利用紫外分光光度计测定总RNA的浓度,用甲醛变性胶检测总RNA的质量。
1.2.2 HaCaT细胞总RNA的反转录 在一个无RN-ase的离心管中加入5 μg的总RNA,1 μL的OligodT,并用无RNase的水调节体积到12 μL。70℃水浴变性5 min后,将离心管迅速放置在冰上。加入4 μL的 5×reaction buffer,1 μL 的 RNase inhibitor,2 μL 10 mmol/L dNTP 和 1 μL 的 SuperScript®III Reverse Transcriptase,42℃水浴 60 min。加入 1 μL RNase H,37℃温浴10 min。将RT产物稀释到200 μL,-20℃保存。
1.2.3 质粒的构建 构建pGEX-4T-1-Smad4载体的上游引物5'-TACTCGGATCCATGGACAATATGTCTA TTACG-3'(下划线处为BamH I酶切位点),下游引物5'-ATCACGTCGACCAGTCTAAAGGTTGTGGGTCT-3'(下划线处为SalI酶切位点)。以HaCaT细胞的cDNA为模板,利用上述引物,进行PCR扩增。扩增条件为:94℃预变性2 min; 94℃ 30 s,50℃ 30 s,72℃ 1 min 30 s;30个循环。将扩增到的PCR产物和pGEX-4T-1载体分别用SalI内切酶和BamH I内切酶进行双酶切,并将酶切后的PCR片段与剩余载体片段用T4 DNA连接酶连接,转化大肠杆菌DH5α,菌落PCR验证阳性克隆,并将阳性克隆送往北京三博远志生物技术有限公司进行测序。
1.2.4 GST-Smad4融合蛋白的诱导表达 将构建成功的pGEX-4T-1-Smad4载体转化大肠杆菌BL21(DE3)表达菌中,37℃培养至OD600=0.6时,分别加入 1 mol/L的IPTG,至终浓度分别为0.2、0.4、0.6、0.8、1.0 mmol/L。30℃诱导4-5 h,同时设未经IPTG诱导的菌液做对照。取1 mL诱导后的菌液,10 000 r/min 离心2 min,收集菌体,然后加入40 μL的1×SDS上样缓冲液,沸水煮5 min,然后10 000 r/min离心2 min,取上清用于SDS-PAGE凝胶电泳和考马斯亮蓝染色,检测GST-Smad4融合蛋白的表达情况。
1.2.5 GST-Smad4融合蛋白的纯化 收集1 mL诱导后的细菌,加入200 μL的裂解液,枪头混匀,室温摇动30 min。同时,在另一个离心管中加入20 μL的MagneGST particles,利用磁架,将上清吸去,再加入250 μL Binding/Washing buffer,悬浮磁粉,利用磁架,吸去上清,平衡磁粉。将平衡好的MagneGST particles加 入 100 μL 的 Binding/Washing buffer, 再加入100 μL的细菌裂解液,室温摇动30 min。利用磁架,吸去上清,加入250 μL的Binding/Washing buffer洗涤3次,吸取上清。用30 μL的0.1 mol/L谷胱甘肽洗脱融合蛋白,并在洗脱液中加入8 μL 的5×SDS上样缓冲液,沸水煮5 min,10 000 r/min 离心2 min,利用SDS-PAGE凝胶电泳检测融合蛋白的纯化效果。
1.2.6 GST-Smad4融合蛋白的鉴定 将纯化后GSTSmad4融合蛋白和HaCaT细胞总蛋白经SDS-PAGE凝胶电泳后,电转至PVDF膜上。用5%的脱脂牛奶封闭2 h,按1∶1 000的比例加入Smad4单克隆抗体,孵育3 h后,洗去一抗,再加入辣根过氧化物酶标记的羊抗兔IgG二抗,孵育40 min后,洗去二抗,再利用ECL显色发光试剂盒并结合胶片显影观察试验结果。
2 结果
2.1 Smad4基因的PCR扩增
提取HaCaT细胞总RNA,电泳检测RNA完整性良好,可用于反转录试验。以HaCaT细胞的cDNA为模板进行PCR扩增。扩增产物用1%的琼脂糖凝胶电泳检测,观察到1 700 bp左右的扩增产物,与Smad4基因的预期大小一致(图1)。
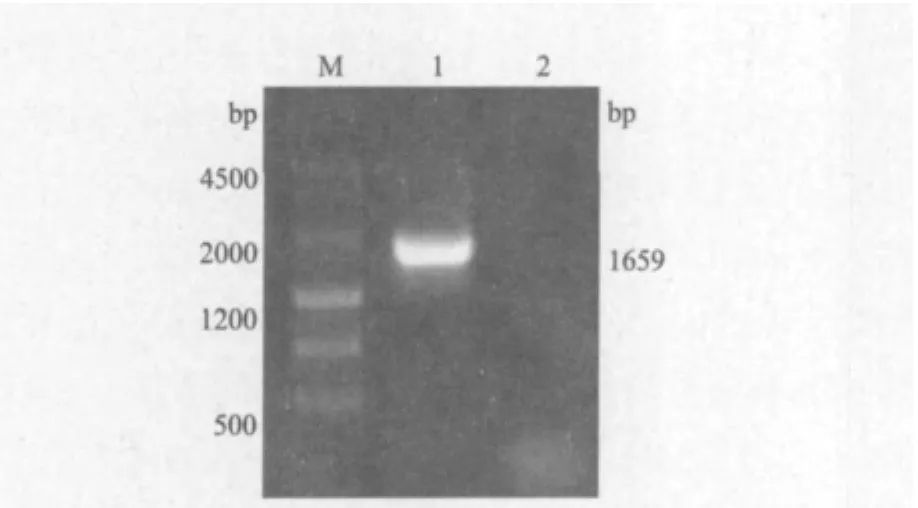
图1 Smad4基因的PCR扩增结果
2.2 pGEX-4T-1-Smad4原核表达载体的构建
将扩增的Smad4基因片段和pGEX-4T-1载体分别用SalI内切酶和BamH I内切酶进行双酶切,电泳并回收酶切后的Smad4基因片段和pGEX-4T-1载体的大片段,通过T4 DNA连接酶将Smad4基因定向插入到pGEX-4T-1载体的多克隆位点中。将菌落PCR鉴定为阳性的2个重组子再进行酶切鉴定,2个重组子经酶切鉴定后均得到两条目的带,大约为1 700 bp和4 900 bp(图2),初步证明重组载体构建正确。将2个重组子进行测序。经过与GenBank的序列对比后,证明Smad4基因已经成功插入pGEX-4T-1载体,pGEX-4T-1-Smad4构建成功。
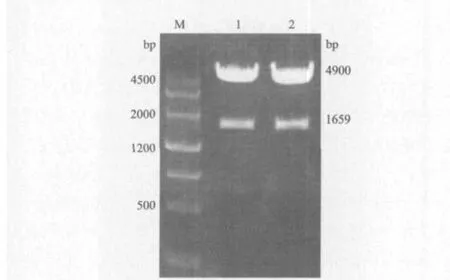
图2 重组质粒pGEX-4T-1-Smad4的鉴定
2.3 GST-Smad4融合蛋白的诱导表达及可溶性分析
将重组载体pGEX-4T-1-Smad4转化大肠杆菌BL21(DE3),收集细菌进行SDS-PAGE凝胶电泳,并用考马斯亮蓝染色。试验结果(图3)显示,5个GST-Smad4诱导组在80 kD处均出现明显条带,与预期结果相符,而未诱导的GST-Smad4表达菌在相应位置无蛋白条带出现,说明融合基因在大肠杆菌中得到有效的表达。但是,随着IPTG浓度的增高,融合蛋白的表达量并未增强。同时,将0.2 mmol/L的IPTG诱导下的GST-Smad4表达菌裂解,收集上清和沉淀,再利用SDS-PAGE凝胶电泳检测其可溶性。从图4中可以看出,GST-Smad4的融合蛋白主要在上清中表达,说明在30℃培养下,0.2 mmol/L IPTG诱导的GST-Smad4融合蛋白主要以可溶性的形式存在。
2.4 GST-Smad4融合蛋白的纯化
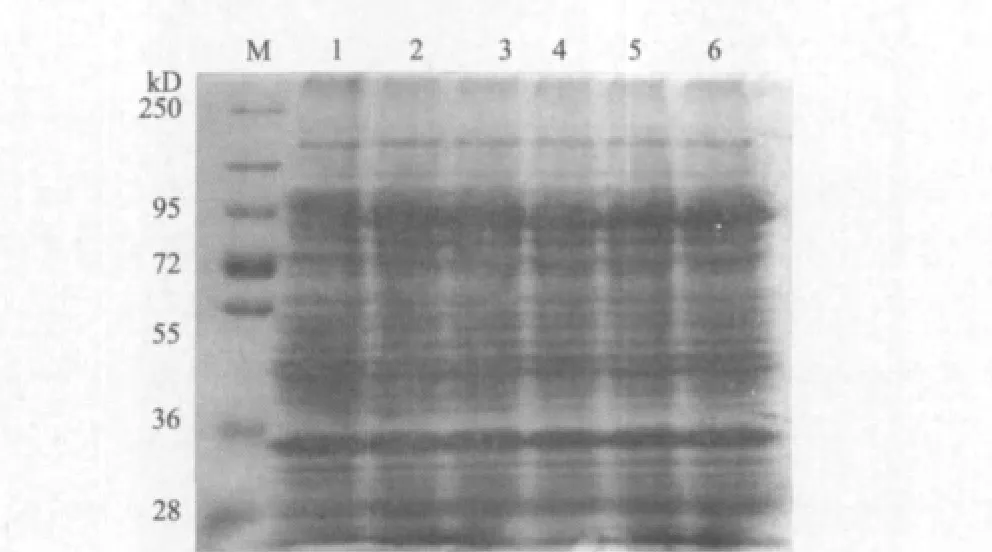
图3 不同浓度IPTG诱导下GST-Smad4 融合蛋白的表达分析
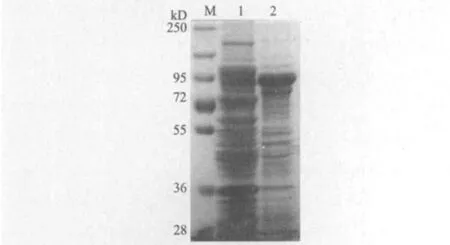
图4 0.2 mmol/L IPTG诱导下GST-Smad4 融合蛋白在上清和沉淀中的对比
将0.2 mmol/L IPTG诱导的GST-Smad4表达菌在-80℃放置1 h,将其融化,加入裂解液,超声破碎后,收集上清,加入MagneGST particles,通过结合、洗涤等步骤后,用0.1 mmol/L的谷胱甘肽洗脱GSTSmad4融合蛋白,并将纯化的GST-Smad4融合蛋白进行SDS-PAGE电泳,然后考马斯亮蓝染色。如图5所示,GST-Smad4融合蛋白得到较好的纯化,纯度较高。

图5 GST-Smad4 融合蛋白的纯化
2.5 GST-Smad4融合蛋白的鉴定
分别将HaCaT细胞总蛋白和纯化的GST-Smad4融合蛋白进行SDS-PAGE凝胶电泳,再将其转移到PVDF膜上,通过Western blot,检测融合蛋白能否被Smad4抗体特异识别。由于GST-Smad4蛋白比Smad4蛋白多了一个GST标签(约20 kD),其分子量预计在80 kd左右。如图6所示,GST-Smad4融合蛋白的条带出现在预期位置,说明Smad4的特异性抗体可以识别GST-Smad4融合蛋白,暗示GSTSmad4融合蛋白可用于后续的研究。
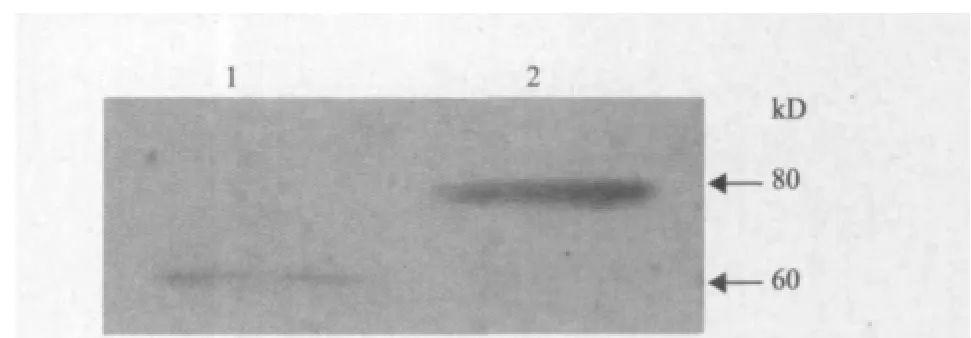
图6 GST-Smad4 融合蛋白的鉴定
3 讨论
Smad4是Smads基因家族的成员,最早被称为DCP4,位于人类染色体18q21.1上[6]。Smad4作为一种抑癌基因,主要通过与其它Smads蛋白的相互作用而参与TGF-β的信号转导。如果Smad4发生缺失或突变,则TGF-β信号转导网络就会被破坏,TGF-β信号途径在肿瘤发展中的抑制效应就会失[7]。
Smad4除了参与肿瘤的发生和发展外,还具有其它的生物学功能。研究发现,乙肝病毒编码的癌蛋白pX通过促进Smads蛋白的核转运和稳定Smad4蛋白的复合体而增强TGF-β信号通路,从而参与肝脏的纤维化[8]。同时,Smad4还参与睾丸、小脑、心瓣膜和早期胚胎的发育过程[9-12]。 因此,Smad4在生命过程中起到十分重要的调节作用。
鉴于Smad4在TGF-β信号途径中的中枢地位,发现和鉴定Smad4的共调节因子具有重要的意义。目前,已经发现了几个Smad4的共调节因子,如Bcl6,v-ErbA。Bcl6主要通过直接与Smad4的相互作用来抑制Smad4的转录活性,从而使B淋巴瘤细胞产生 TGF-β抗性[13]。v-ErbA通过与Smad4相互作用而干扰Smad4复合体向细胞核的转移,从而抑制了TGF-β信号通路的正常功能,进而使HD3B红白血病细胞产生TGF-β抗性[14]。因此,进一步的鉴定和发现Smad4的共调节因子对完善复杂的TGF-β信号网络具有重要的意义。
Biacore是一种基于表面等离子共振(SPR)的新型技术,利用该技术可以实时跟踪生物分子间的相互作用,分离与目的蛋白相互作用的蛋白,我们实验室拟利用这种技术分离与Smad4相互作用的蛋白。在Biacore试验中,获得Smad4蛋白是试验顺利进行的关键。为此,将Smad4基因克隆到原核表达载体pGEX-4T-1载体,通过IPTG诱导,得到带有GST标签的Smad4融合蛋白,再通过亲和层析纯化,得到了GST-Smad4融合蛋白,本研究为Biacore试验奠定了基础。
以往的研究发现,IPTG的浓度对外源蛋白的表达有着重要的影响,但是过高浓度的IPTG往往对细胞产生毒性,同时也影响蛋白的表达量和蛋白表达的形式。本试验探索了不同浓度的IPTG对GSTSmad4融合蛋白表达的影响。研究发现,随着IPTG浓度的增加,GST-Smad4融合蛋白表达几乎没有变化。因此,选择0.2 mmol/L为IPTG诱导的浓度。同时,分别检测了在0.2 mmol/L IPTG诱导下,GSTSmad4融合蛋白在BL2(DE3)表达菌裂解液的上清和沉淀的分布发现,低浓度的IPTG诱导下,GSTSmad4融合蛋白主要以可溶性的形式存在,主要分布在上清,而在沉淀中的分布很低。
4 结论
本研究成功构建了pGEX-4T-1-Smad4原核表达载体,摸索了GST-Smad4融合蛋白诱导表达的适宜条件,并获得了具有Smad4免疫活性的GST-Smad4融合蛋白。
[1] Liu F, Pouponnot C, Massague J. Dual role of the Smad4/DPC4 tumor suppressor in TGFβ-inducible transcriptional complex[J]. Genes Dev, 1997, 11(23):3157-3167.
[2] Elliott RL, Blobe GC. Role of transforming growth factor β in human cancer[J]. Journal of Clinical Oncology, 2005, 23(9):2078-2093.
[3] Shi Y, Massagué J. Mechanisms of TGF-β signaling from cell membrane to the nucleus[J]. Cell, 2003, 113(6):685-700.
[4] Ikushima HK. Miyazono K. TGF-β singalling :a complex web in cancer progression[J]. Nature Reviews Cancer, 2010, 10(6):415-424.
[5] Heldin CH, Landström M, Moustakas A. Mechanism of TGF-beta signaling to growth arrest, apoptosis, and epithelial-mesenchymal transition[J]. Curr Opin Cell Biol, 2009, 21(2):166-176.
[6] Lee DK, Park SH, Yi Y, et al. The hepatitis B virus encoded oncoprotein pX amplifies TGF-beta family signaling through direct interaction with Smad4:potential mechanism of hepatitis B virusinduced liver fibrosi[J]. Genes Dev, 2001, 15(4):455-466.
[7] Rozenblum E, Weinstein CL, Fischer A, et al. DPC4, a candidate tumor suppressor gene at human chromosome18q21.1[J]. Science,1996, 271(5247):350-353.
[8] Yang G, Yang X. Smad4-mediated TGF-β signaling in tumorigenesis[J]. Int J Biol Sci, 2010, 6(1):1-8.
[9] Hu J, Zhang YQ, Liu XP, et al. Expression and localization of Smad1, Smad2 and Smad4 proteins in rat testis during postnatal development[J]. Asian J Androl, 2003, 5(1):51-55.
[10] Fernandes M, Antoine M, Hébert JM. SMAD4 is essential for generating subtypes of neurons during cerebellar development[J].Dev Biol, 2012, 365(1):82-90.
[11] Moskowitz IP, Wang J, Peterson MA, et al. Transcription factor genes Smad4 and Gata4 cooperatively regulate cardiac valve development[J]. Proc Natl Acad Sci USA, 2011, 108(10):4006-4011.
[12] Chu GC, Dunn NR, Anderson DC, et al. Differential requirements for Smad4 in TGFbeta-dependent patterning of the early mouse embryo[J]. Development, 2004, 131(15):3501-3512.
[13] Wang DG, Long JY, Dai FY, et al. BCL6 represses Smad signaling in transforming growth factor-beta resistance[J]. Cancer Res,2008, 68(3):783-789.
[14] Erickson RA, Liu X. Association of v-ErbA with Smad4 disrupts TGF-beta signaling[J]. Mol Biol Cell, 2009, 20(5):1509-1519.
