不同反应体系水热合成的LiFePO4/C的性能
2013-01-16娄永兵张静静
娄永兵,张静静,朱 林
(东南大学化学化工学院,江苏南京 211189)
磷酸铁锂(LiFePO4)正极材料的电导率、Li+扩散系数和振实密度偏低[1],碳包覆和合金化只能在一定程度上克服上述缺陷[2]。纳米级LiFePO4正极材料的循环性能和高倍率充放电性能良好,原因是纳米颗粒能缩短电子和Li+的扩散距离,扩大有效反应区域[3]。形貌和结构对正极材料的电化学性能有直接影响[4],有必要研究颗粒形貌、粒径、分布与电化学性能之间的联系。LiFePO4的制备方法较多,如高温固相法、微波合成法、溶胶-凝胶法、共沉淀法及水热合成法等,其中高温固相法在工业上得到广泛运用,但难以得到粒径小且均匀、性能优良、较纯相的纳米LiFePO4材料[5]。
本文作者以 FeSO4·7H2O、H3PO4、LiOH·H2O、柠檬酸为原料,用水热法制备结晶性优良的纯相纳米LiFePO4/C材料,并通过不同的表面活性剂改良合成条件,控制颗粒的形貌、粒度分布,并研究了产物的电化学性能。
1 实验
1.1 LiFePO4/C材料的制备
按物质的量比 3∶3∶9∶1称取 FeSO4·7H2O(上海产,≥99.0%)、H3PO4(上海产,≥85.0%)、LiOH·H2O(上海产,≥95.0%)和柠檬酸(上海产,≥99.5%)。以去离子水与乙二醇(上海产,≥99.0%)的混合溶液(体积比1∶1)为溶剂,先将LiOH·H2O和H3PO4在烧杯中混合搅拌、溶解,再对溶液进行超声波处理;边搅拌边往溶液中依次加入FeSO4·7H2O、柠檬酸及表面活性剂[聚乙烯吡咯烷酮K-30(PVP,上海产,≥90.0%)或者聚乙二醇 400(PEG-400,上海产,≥90.0%)],再进行超声波处理。所得溶液磁力搅拌20 min后,移入到内衬聚四氟乙烯、容积为30 ml的高压反应釜中,在180℃下反应6 h。反应后冷却至室温,真空抽滤,用去离子水、乙醇(上海产,≥99.7%)反复洗涤。将洗涤后的样品在40℃下干燥8 h,再与蔗糖(广东产,≥99.5%)按质量比4∶1混合,采用氮气保护,在600℃下煅烧6 h,得到黑色的LiFePO4/C材料。各样品对应的表面活性剂及用量见表1。

表1 不同LiFePO4/C样品的表面活性剂种类及用量Table 1 Surfactant types and amounts for different LiFePO4/C samples
1.2 电池的组装
将LiFePO4/C样品、乙炔黑(天津产,≥99.9%)和聚偏氟乙烯(美国产,电池级)按质量比20∶3∶2混匀,再以 N-甲基吡咯烷酮(上海产,≥98.0%)为溶剂调浆,并涂覆在直径为1 cm、0.5 mm厚的铝箔(东莞产,电子级)圆片上,再在100℃下,干燥24 h,以20 MPa的压力压实,制成正极片(含10~13 mg活性物质)。以金属锂片(长沙产,工业级)为负极,Celgard 2300膜(广东产)为隔膜,1.0 mol/L LiPF6/EC+DMC(体积比1∶1,东莞产,≥99.8%)为电解液,在氮气保护的手套箱中组装CR2032型电池。
1.3 测试与分析
用Tensor27型傅立叶变换红外分析测试仪(德国产)进行傅立叶红外光谱(FT-IR)分析,KBr压片;用XPert Pro MPD型X射线衍射仪(德国产)对样品进行物相分析,CuKα,λ=0.154 4 nm,管压40 kV、管流40 mA,扫描速度为4(°)/min,步长为0.02°;用Netzsch STA 449F3仪器(德国产)进行热重(TG)测试,实验气氛为氧气,升温速率为5℃/min;用S-3400N II型扫描电子显微镜(日本产)观察样品的形貌。
用CT2001充放电测试仪(深圳产)测试电池的充放电性能,电压为2.0~4.2 V。所有测试材料先在0.1 C时循环12次,然后依次在0.5 C和1.0 C时分别循环23次。
用CHI 660D电化学工作站(上海产)进行电化学阻抗分析,电化学阻抗的频率为0.1~105Hz,交流幅值为5 mV。
2 结果与讨论
2.1 FT-IR分析
图1为LiFePO4/C样品的FT-IR图。
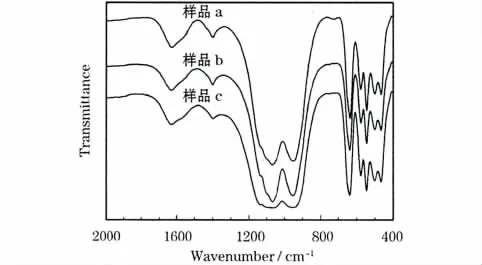
图1 LiFePO4/C样品的FT-IR图Fig.1 FT-IR spectra of LiFePO4/C samples
图1中,1 634 cm-1和1 400 cm-1处的吸收峰来自于样品中残留柠檬酸的羧酸基团;800~1 250 cm-1处的强吸收峰显示了PO3-4的存在;500~700 cm-1处的强吸收峰由Fe—O和 Li—O 键产生。1 132 cm-1、1 069 cm-1和1 046 cm-1处的峰为PO3-4四面体的不对称伸缩振动峰,而968 cm-1处的峰为四面体的对称伸缩振动峰;在642 cm-1、629 cm-1和468 cm-1处的峰为PO3-4四面体的不对称弯曲振动峰,而571 cm-1、550 cm-1、497 cm-1和472 cm-1处的峰来源于PO3-4对称和不对称弯曲振动的组合。这说明:水热反应后,LiFePO4晶体已经形成。样品b、c和a的FT-IR图差别不明显,说明表面活性剂PVP和PEG-400在经过高温固化后,都已经转变成单质碳。
2.2 XRD分析
图2为LiFePO4/C样品的XRD图。
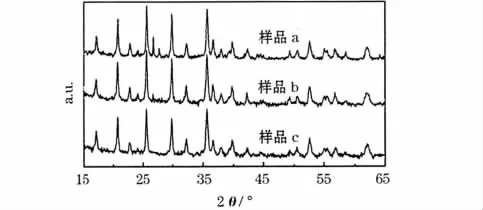
图2 LiFePO4/C样品的XRD图Fig.2 XRD patterns of LiFePO4/C samples
从图2可知,所得样品都有与LiFePO4标准谱(JCPDS:40-1499)相同的衍射峰,且峰形较尖锐、对称,强度高、杂峰较少。根据图1数据计算得到晶胞参数见表2。
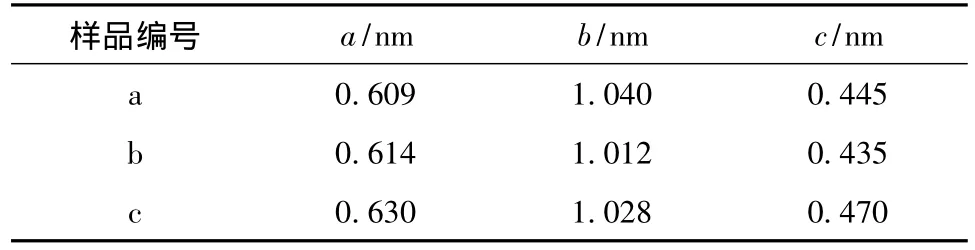
表2 不同LiFePO4/C样品的晶胞参数Table 2 Cell parameters for different LiFePO4/C samples
从表2可知,所得样品的晶胞参数都与文献[6]的数据接近,说明合成了结晶性较好、较纯的LiFePO4/C颗粒,避免了三价铁和Li3PO4的生成。
2.3 TG分析
LiFePO4/C样品的TG曲线见图3。
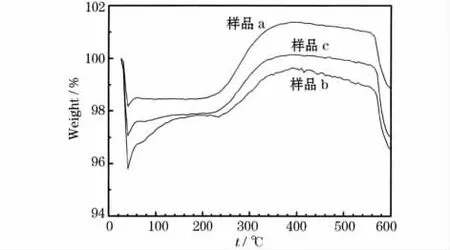
图3 LiFePO4/C样品的TG曲线Fig.3 TG curves of LiFePO4/C samples
纯LiFePO4在250~500℃时由于吸附氧气而被氧化成Li3Fe2(PO4)3和 Fe2O3,因此会有理论值5.07%的增重[7]。基于上述原因,图3中各样品在250~400℃时TG曲线上升,但增重比例不到5.07%;在400℃后,曲线开始下滑,原因是当温度继续升到350℃以上时,样品中的包覆碳被氧化成CO2气体,导致混合物失重;当温度升到500℃以上时,LiFePO4与碳的氧化结束。从曲线数据可计算出,碳包覆后,样品a、b及c的碳含量分别为2.09%、3.22%和2.30%。样品b和c中,有少量残留的PVP大分子和PEG-400低分子包覆在LiFePO4的表面,这些有机物质在氮气保护、600℃下煅烧成碳,包覆在LiFePO4表面,提高了碳含量。
2.4 SEM分析
图4是LiFePO4/C样品的SEM图。

图4 LiFePO4/C样品的SEM图Fig.4 SEM photographs of LiFePO4/C samples
从图4可知,以水和乙二醇的混合溶液为反应介质,制备的LiFePO4颗粒均呈球形,粒径较小,粒度均匀,约为100~200 nm。乙二醇有两个羟基,加入水溶液中,降低了混合溶剂的介电系数和晶体颗粒的ζ电位,从而引起晶粒表面吸附乙二醇分子,起到空间位阻的作用,阻止晶粒的聚集,因此得到的产物颗粒分散较好、粒径较小。尺寸较小的球形颗粒不仅有利于制作正极浆料和涂覆电极片,还有利于碳包覆,从而提高材料的电化学性能。纳米球形颗粒的比表面积大,有利于Li+在颗粒中的脱出、转移和嵌入,使材料的性能更好[1];样品b和c的颗粒尺寸较小,为100~150 nm,而样品a的颗粒尺寸约为200 nm,说明PVP和PEG-400在合成体系当中起到了分散剂的作用,吸附在晶粒表面,阻止了晶粒聚集。过量的PVP高分子和PEG-400低分子会在溶液中形成定量的胶束,导致样品b和c的团聚现象。
2.5 电化学性能
不同LiFePO4/C样品在0.1 C和1.0 C的首次充放电曲线见图5。
从图5可知,在0.1 C时,各样品都在3.4 V左右出现了平缓的充放电平台,接近于LiFePO4颗粒平台电压的理论值3.45 V;放电平台电压的差值很小,说明材料的动力学性能良好;样品a、b和c的首次放电比容量分别为131.6 mAh/g、154.1 mAh/g和145.6 mAh/g。在1.0 C时,只有样品b在约3.4 V处具有平缓的充放电平台,样品c的平台不是很平缓,在测试过程中电压下降较快,而样品a几乎没有平台;样品a的放电比容量只有35.0 mAh/g,样品c有87.9 mAh/g,样品b的最大,达到100.0 mAh/g。由此可见,PVP和PEG-400介入到制备LiFePO4的过程中,提高了材料的比容量,说明粒径更小的颗粒材料具有更高的放电性能;各样品的放电性能与包覆碳的含量一致,碳含量越高,放电性能越好,原因是碳包覆提高了材料的导电性能,在一定程度上克服了纯LiFe-PO4电导率低的缺陷。材料放电性能的提高,还可能得益于颗粒的团聚提高了材料的导电性能。
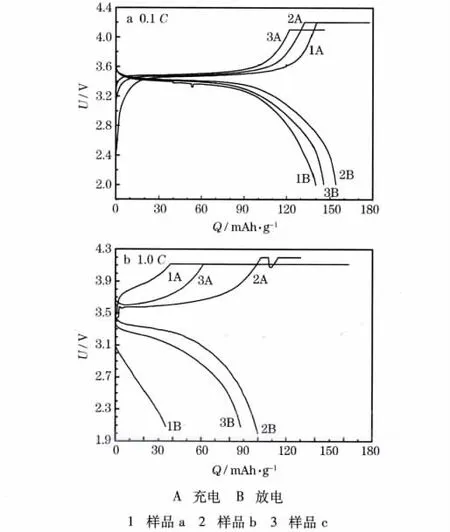
图5 LiFePO4/C样品在0.1 C和1.0 C时的首次充放电曲线Fig.5 Initial charge-discharge curves of LiFePO4/C samples at 0.1 C and 1.0 C
LiFePO4样品在0.1 C、0.5 C和1.0 C时的循环性能见图6。
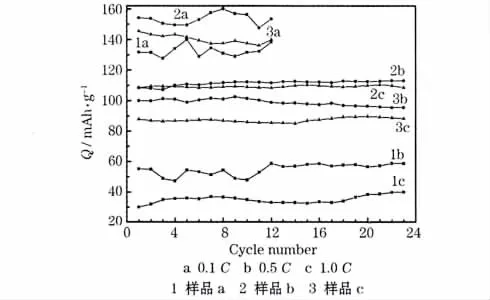
图6 LiFePO4/C样品在0.1 C、0.5 C和1.0 C时的循环性能Fig.6 Cycle performance of LiFePO4/C samples at 0.1 C,0.5 C and 1.0 C
从图6可知,在0.1 C时,样品b的放电比容量高于样品c和样品a,比容量最高可达160.0 mAh/g,接近 LiFePO4的理论值169 mAh/g,说明PVP分子的添加,提高了材料的放电性能。在0.5 C时,样品b和样品c的放电比容量分别对应为0.1 C时的71%和75%左右,样品a只有42%;样品b和样品c在1.0 C时的放电比容量分别对应为0.1 C时的65%和62%左右,而样品a仅为23%,说明PVP和PEG-400的介入改善了材料高倍率下的充放电性能,原因是粒径较小,团聚也可能提高了材料的导电性能。在0.1 C时循环12次,样品a的容量没有衰减,样品b仅衰减0.5%,样品c衰减3.8%;在0.5 C时,样品a没有衰减,样品b出现上升趋势,样品c衰减0.6%;在1.0 C时,样品a的容量出现上升的趋势,样品b衰减4.5%,样品c衰减2.3%。由此可见,样品b和样品c的循环性能在中、低倍率下表现较好,而在1.0 C时略有降低,但均比样品a有改善,得益于样品颗粒的较小尺寸和改进的导电性能。
LiFePO4/C样品的电化学阻抗谱见图7。
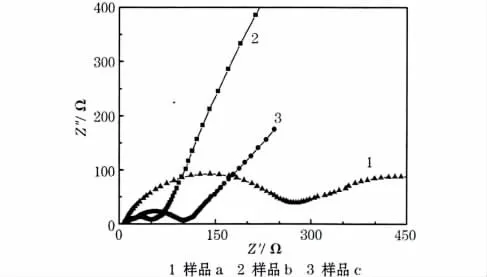
图7 LiFePO4/C样品的电化学阻抗谱Fig.7 Electrochemical impedance spectra of LiFePO4/C samples
从图7可知,3个样品的阻抗谱形状相似,都是由中高频区的一个半圆和低频区的一条直线组成。高频区圆弧的半径对应电极表面的电荷转移过程(半圆的半径对应电荷转移阻抗的大小),低频区直线的斜率代表扩散阻抗。样品a、c和b的电荷转移阻抗逐渐减小,对应电导率逐渐增加,说明电化学性能逐渐提高。电池体系内电荷的转移过程对于电化学性能具有决定性的作用,表面活性剂PVP和PEG-400的介入,可提高LiFePO4/C样品表面的碳含量,提高材料的导电性能和电化学性能。
3 结论
本文作者以 FeSO4·7H2O、H3PO4、LiOH·H2O 和柠檬酸为原料,以水和乙二醇的混合溶液为溶剂,采用水热法制备结晶好、纯度高、粒径较小且粒度均匀的球形LiFePO4/C粉体材料。
PVP和PEG-400的介入,提高了LiFePO4/C复合材料中的碳含量和导电性能,改善了材料的充放电性能和循环性能。在0.1 C时,使用PVP和PEG-400制备的LiFePO4材料具有较高的放电比容量,首次放电时分别为154.1 mAh/g和145.6 mAh/g;在0.5 C时,首次放电比容量分别为108.4 mAh/g和108.5 mAh/g;在1.0 C时,其首次放电比容量分别为 100.0 mAh/g和87.9 mAh/g。
[1]Padhi A K,Nanjundaswamy K S,Goodenough J B.Phospho-olivines aspositive electrode materials for the re-chargeable lithium batteries[J].J Electrochem Soc,1997,144(4):1 188 -1 194.
[2]YANG Shu-ting(杨书廷),LIU Yu-xia(刘玉霞),YIN Yan-hong(尹艳红),et al.镁离子掺杂对LiFePO4/C电化学性能和结构的影响[J].Journal of Inorganic Materials(无机材料学报),2007,22(4):627 -630.
[3]Qian J,Zhou M,Cao Y L,et al.Template-free hydrothermal synthesis of nanoembossed mesoporous LiFePO4microspheres for highperformance lithium-ion batteries[J].J Phys Chem C,2010,114(8):3 477-3 482.
[4]GUO Xin(郭忻),LU Zhou-guang(卢周广),TANG You-gen(唐有根).LiFePO4纳米棒的合成与电化学性能[J].Battery Bimonthly(电池),2012,42(5):239 -241.
[5]Takahashi M,Takei K,Tobishima S,et al.Characterization of LiFePO4as the cathode material for rechargeable lithium batteries[J].J Power Sources,2001,97-98:508 -511.
[6]Yang S F,Song Y N,Zavalij P Y,et al.Performance of LiFePO4as lithium battery cathode and comparison with manganese and vanadium oxides[J].J Power Sources,2003,119 - 121:239 - 246.
[7]Cao Y L,Yu L H,Li T,et al.Synthesis and electrochemical characterization of carbon-coated nanocrystalline LiFePO4prepared by polyacrylates-pyrolysis route[J].J Power Sources,2007,172(2):913-918.
