D-半乳糖致衰老豚鼠声带老化特征研究
2013-01-10李翠娥陶泽璋周涛屈季宁詹娜
李翠娥 陶泽璋 周涛 屈季宁 詹娜
目前,国内外学者常用的动物衰老模型主要有自然衰老模型、SMAP系小鼠衰老模型[1]、臭氧损伤衰老模型[2]、去胸腺衰老模型[2]、D-半乳糖衰老模型等[3],自然衰老的动物模型比较符合人类衰老的特点, 但由于饲养时间过长、成本高、个体差异较大、干扰较多,使其应用受到一定的限制。D-半乳糖衰老模型由我国学者龚国清于1991年首次报道,他采用D-半乳糖0.12 mg/g给3月龄小鼠眼球后注射一个月后,发现该模型鼠的一系列生理生化变化与21月龄小鼠接近,说明该方法造成的动物衰老模型可较好地模拟自然老化过程[3]。与其他几种动物衰老模型相比较,该模型造模方法简单易行、结果稳定、价格低廉,目前已成为国内外公认的动物衰老模型,并得到了广泛应用[4~6]。在耳鼻咽喉科领域,D-半乳糖衰老动物模型主要用于老年性聋方面的研究,并已取得一定的研究成果[7],但在喉科学领域应用较少,因此,本研究拟通过观察D-半乳糖致衰老豚鼠声带的老化特征,探讨该模型应用于喉科学尤其是老年嗓音研究的可行性,为研究老年嗓音的发生机制及防治奠定一定基础。
1 材料与方法
1.1实验动物及分组 选取健康4月龄豚鼠12只,雌雄不拘,体重300~550 g,适应性饲养一周后,随机分为青年组(对照组)和D-半乳糖致衰老模型组(模型组),每组6只。另选自然衰老的2年龄豚鼠6只作为老年组,体重600~900 g。实验动物由四川泸州医学院实验动物中心提供。
1.2实验方法
对照组和老年组动物均常规饲养,不作任何处理,模型组动物常规饲养的同时,颈背部皮下注射D-半乳糖致其亚急性衰老。
1.2.1D-半乳糖致衰老模型组动物造模方法 给予模型组豚鼠颈背部皮下注射D-半乳糖(C6H1206,AID SCIENCE,中国)300 mg·kg-1·d-1(40 mg/ml),每天一次,连续注射6周,动物每日称体重以调整药量。在饲养过程中,仔细观察各组豚鼠的外观及行为学表现。
1.2.2喉部取材及标本制备方法 模型组给药6周造模成功后,三组动物分别用10%的水合氯醛按350 mg/kg剂量腹腔注射麻醉后,断头处死,快速取出喉部,用4%的多聚甲醛固定,常规脱水,石蜡包埋,连续切片,片厚5 μm;各组先分别取部分切片做HE染色,以确定所取为喉部组织并观察声带组织的形态学变化,然后将各组每只豚鼠的喉部组织另一部分切片再分为2部分,分别用Alcian blue染色和Masson三色染色观察透明质酸和胶原蛋白在其喉部的表达。
1.2.3Alcian blue染色 切片脱蜡至水后,先用Alcian blue染液染10~20分钟,稍水洗,然后用核固定染液复染5~10分钟,稍水洗,常规脱水透明,中性树胶封固,光镜下观察。透明质酸阳性染色为蓝色,蓝色越深含量越高。
1.2.4Masson三色染色 切片脱蜡至水,Weigert铁苏木素(Weigert铁苏木素A、B等比例混合液)染5~10分钟,流水稍洗;1%盐酸酒精分化,流水冲洗数分钟;丽春红酸性品红染色液5~10分钟,流水稍洗;磷钼酸溶液处理约5分钟,不用水洗直接用苯胺蓝染液复染5分钟;1%冰醋酸处理约5分钟,95%酒精脱水多次; 无水酒精脱水、二甲苯透明,中性树胶封固,光镜下观察。阳性染色呈蓝色,蓝色染色越深,胶原蛋白含量越高。
1.3统计学方法 选取各组动物声带部位的图像,用Image-Pro Plus 6.0 For Window(IPP6.0)(Media Cybernetics 公司 )图像分析软件处理,取各图片的平均值,数值越大表达越强,三组豚鼠声带透明质酸和胶原蛋白的表达差异显著性检验采用多因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1豚鼠外观及一般状态 模型组豚鼠自造模4周起出现精神萎靡,倦怠嗜睡,进食减少,皮肤松弛,行动迟缓,自主活动减少。造模成功后(6周),模型组和老年组豚鼠毛色枯槁无光泽,头颈部、背部、腹部掉毛严重。对照组外观及一般状态同实验前。
2.2三组豚鼠声带HE染色结果 老年组声带粘膜鳞状上皮部分萎缩,部分上皮肥厚,上皮脚延长,同时伴不全角化或完全角化,固有层腺体减少或消失;模型组声带粘膜鳞状上皮部分萎缩伴角化不全,固有层腺体减少,可见慢性炎性细胞浸润及肉芽组织形成;对照组声带组织结构清楚,依次可见喉粘膜鳞状上皮、粘膜固有层及固有层腺体、肌层等,未见上述老化改变(图1)。
2.3各组豚鼠声带透明质酸的表达 光镜下见老年组和模型组声带组织中透明质酸蓝色染色较对照组明显变浅,对照组、老年组、模型组透明质酸表达的灰度值分别为0.798 351 、0.694 163和0.724 869,可见对照组的表达量明显高于模型组和老年组,差异有统计学意义(P<0.05),模型组与老年组之间差异无统计学意义(P>0.05)(图2)。
2.4各组豚鼠声带胶原蛋白的表达 老年组和模型组胶原蛋白蓝色染色较对照组明显加深,对照组、老年组、模型组胶原蛋白表达的灰度值分别为0.632 295、0.711 47和 0.768 211,可见其表达量依次为对照组< 老年组<模型组,三组间差异均有统计学意义(P<0.05)(图3)。
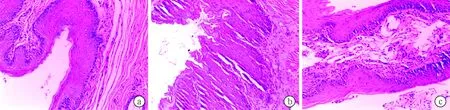
图1 三组豚鼠声带HE染色结果 a、b、c分别为对照组、老年组和模型组(HE染色×200)

图2 三组豚鼠声带透明质酸的表达 a、b、c分别为对照组、老年组和模型组(Alcian blue染色×200)

图3 三组豚鼠声带胶原蛋白的表达 a、b、c分别为对照组、老年组和模型组(Masson三色染色×200)
3 讨论
D-半乳糖是哺乳动物体内一种普通的代谢产物,动物从乳糖中获得半乳糖, 通过Leloir 通路、醛糖还原酶通路及半乳糖氧化酶通路三种途径代谢。当细胞内大量半乳糖堆积, 不能通过Leloir和醛糖还原酶通路及时代谢时, 在半乳糖氧化酶作用下,生成醛类和H2O2以及在反应过程中产生超氧阴离子, 这些物质不能被细胞进一步代谢, 细胞中脂质、蛋白和核酸产生的氧化应激-自由基损伤、非酶糖基化作用等导致细胞肿胀和功能障碍, 引起全身各器官受损、系统功能衰退等一系列病理变化, 最终促成衰老发生[8,9]。因此,在一定时间内给予大剂量D-半乳糖, 可诱导动物出现类似自然衰老的整体早衰, 其可能机制为[9]:①氧化应激-自由基损伤、钙稳态失调与线粒体老化;②非酶糖基化反应;③端粒缩短及端粒酶的活性下降;④免疫功能障碍。但D-半乳糖导致机体免疫衰老的真正原因并不十分清楚, 有待进一步探究。
目前,利用D-半乳糖制备鼠衰老模型时,可以腹腔注射,也可以颈背部皮下注射,注射剂量为50~500 mg·kg-1·d-1,连续用药6~8周[10]。造模完成后,通过行为学、生化、形态学以及分子生物学等方面评价造模效果,结果都证实D-半乳糖所致动物衰老模型确实能在一定程度上模拟动物老化过程,但与自然衰老动物也有一定差异,因为自然衰老是一个多因素的过程,其机制还涉及自由基-线粒体衰老学说、褪黑素-松果体衰老学说、羟基毒化衰老学说、端粒学说以及基因衰老学说等[11,12]。
Kosztyla-Hojna等[13]研究了下咽癌而声带未受侵者行喉全切除术后的声带标本,发现老年人的嗓音质量与声带黏膜的形态学变化有关,声带黏膜胶原纤维数量增加,基质中可见成纤维细胞和慢性炎症表现,上皮细胞空泡样变,角化,细胞间隙增大,并有大量的血管,说明老年嗓音患者存在声带水肿;而上皮层变薄,基质透明化,炎症浸润,大量胶原纤维和少量血管提示声带黏膜萎缩;并指出声带黏膜的水肿和萎缩是老年嗓音患者最常见的形态学变化;水肿在老年女性更多见,萎缩在老年男性更多见。本研究中三组豚鼠声带HE染色光镜下可见,老年组和模型组声带粘膜鳞状上皮部分萎缩伴角化不全,固有层腺体减少,模型组声带还可见慢性炎性细胞浸润,而对照组未见这些改变,说明老年组和模型组声带确实发生了老化改变。
大量研究[14~17]表明,透明质酸和胶原蛋白在决定声带的生物力学性能方面有重要作用,老年声带中透明质酸减少,胶原蛋白增加,改变了声带的粘弹性能,可能与嗓音发生年龄相关性改变有关,从而可以部分解释老年嗓音的机制。从文中结果看,与青年豚鼠比较,D-半乳糖致衰老豚鼠喉部透明质酸含量降低,胶原蛋白含量增加,与自然衰老豚鼠变化一致,结合模型组声带的组织病理改变,说明本研究采用D-半乳糖注射制备的衰老动物模型喉部出现了老化改变,其声带组织中透明质酸及胶原蛋白含量的变化可能是喉部衰老的机制之一,该模型用于老年嗓音机制及防治的研究是可行的;另外,本研究结果显示模型组声带组织中透明质酸降低的程度低于老年组,胶原蛋白增加的程度高于老年组,说明两者老化程度有一定差异,一方面可能与两者的衰老机制不同有关,另一方面也可能与模型组D-半乳糖注射的剂量有关。因此,为使衰老模型豚鼠喉部老化程度更接近自然老年豚鼠,D-半乳糖注射制备用于喉部衰老研究的动物模型剂量还需进一步探索;如何从发声功能方面证实模型鼠的喉功能确实发生了老化改变,也是今后研究的目标之一。
(致谢:感谢四川泸州医学院附属医院耳鼻咽喉头颈外科的殷泽登教授对本实验的支持与帮助!)
4 参考文献
1 Chen GH, Wang YJ, Wang XM, et al. Effect of aging on species typical behaviors in senescence-accelerated mouse[J].Physiol Behav , 2005, 85 : 536.
2 崔美芝,刘浩,李春艳.衰老动物模型的建立及评价[J].中国比较医学杂志, 2006,16: 118.
3 龚国清,徐黻本.小鼠衰老模型研究[J].中国药科大学学报,1991,22:101.
4 Jeong K, Shin YC, Park S,et al. Ethanol extract of scutellaria baicalensis Georgi prevents oxidative damage and neuroinflammation and memorial impairments in artificial senescense mice[J]. Journal of Biomedical Science, 2011,18:14.
5 Anand KV, Mohamed Jaabir MS, Thomas PA,et al. Protective role of chrysin against oxidative stress in d-galactose-induced aging in an experimental rat model[J]. Geriatr Gerontol Int,2012 .Epub ahead of print.
6 Yoo DY, Kim W, Kim IH, et al. Combination effects of sodium butyrate and pyridoxine treatment on cell proliferation and neuroblast differentiation in the dentate gyrus of D-galactose-induced aging model mice[J]. Neurochem Res,2012,37:223.
7 谢仕津,殷泽登,李君梅,等.电针耳穴对D-半乳糖致年龄相关性听力损失豚鼠听觉中枢丙二醛表达的影响[J].听力学及言语疾病杂志,2012,20:254.
8 朱亚珍,朱虹光.D-半乳糖致衰老动物模型的建立及其检测方法[J].复旦学报医学版,2007,34:617.
9 邢秋娟, 施杞, 王拥军. D-半乳糖诱导衰老动物模型的机制及其在中医药方面的应用[J]. 上海中医药大学学报,2010,24:93.
10 Zhang Q, Huang YG, Li XK, et al . GM 1 ganglioside prevented the decline of hippocampal neurogen esis associat ed w ith D-galactose[J].Neuropharmacol and Neurotoxicol , 2005, 16 : 1 297.
11 欧芹, 魏晓东, 王丹, 等.马齿苋水提液对D- 半乳糖致衰老模型小鼠心肌线粒体的保护作用[J].中国组织工程研究与临床康复,2007,11:1 570.
12 秦红兵,杨朝晔,范忆江,等. D-半乳糖诱导衰老小鼠模型的建立与评价[J].中国组织工程研究与临床康复,2009,13:1 275.
13 Kosztya-Hojna1 B, Andrzejewska A, Rutkowski R,et al. Morphological aspect of voice disturbances of aged persons coexisting hypopharynx cancer[J]. Folia Histochemica Et Cytobiologica,2007,45: 221.
14 Abdelkafy WM, Smith JQ, Henriquez OA. Age-related changes in the murine larynx: initial validation of a mouse model[J]. Ann Otol Rhinol Laryngol, 2007 ,116:618.
15 Roberts T, Morton R, Al-Ali S. Microstructure of the vocal fold in elderly humans[J]. ClinicalAnatomy, 2011,24:544.
16 Kolachala VL, Torres-Gonzalez E, Mwangi S, et al. A senescence accelerated mouse model to study aging in the larynx[J]. Otolaryngology Head and Neck Surgery,2010,142:879.
17 Ohno T, Hirano S, Rousseau B,et al. Age-associated changes in the expression and deposition of vocal fold collagen and hyaluronan[J]. Ann Otol Rhinol Laryngol ,2009,118:735.
