Apollon反义核酸促进肝癌HepG2细胞凋亡机制的探讨
2013-01-07黎毓光何金花谢杏仪陈顺仪陈武嘉黄国贤
黎毓光,何金花,王 莉,谢杏仪,陈顺仪,陈武嘉,黄国贤
(广州市番禺区中心医院检验科,广东广州511400)
凋亡抑制蛋白(inhibitor apoptosis protein,IAP)最早从杆状病毒中分离,此后在酵母、昆虫、人和其他哺乳动物组织中都有发现,是近年来发现的具有抗凋亡作用的蛋白家族。目前共发现IAP 家 族 中 有 XIAP、c-IAP1、c-IAP2、NIAP、Apollon、Livin、Survivin、ILP-2 等 8 个 成员[1]。Apollon/BRUCE是IAP家族中最大的蛋白,相对分子质量为530×103,含有4 830个氨基酸,是高尔基体外膜蛋白,具有一个杆状病毒IAP重复序列(BIR)结构域及一个泛素结合酶(ubiquitin conjugating enzyme,UBC)结构域。其中BIR结构域位于IAP的氨基端,是其抑制半胱氨酸蛋白酶(Caspase)活性、抗凋亡的重要结构;UBC结构域位于羧基端,能够加强Apollon的抗凋亡作用。Apollon在人体多种恶性肿瘤中高表达[2]。在前期的研究中,我们筛选出的 IAP家族 Survivin、XIAP、Apollon和 Livin反义核酸(antisense oligodeoxynucleotide,ASO)能抑制人消化系肿瘤细胞增殖并促进凋亡[3]。本研究重在探讨Apollon ASO促进肝癌细胞凋亡及其机制,期望为肝癌的靶向基因治疗提供试验依据。
材料和方法
一、主要试剂
DMEM/F12培养基购自Gibco公司,脂质体LipofectamineTM2000购自 Invitrogen公司,CCK-8(Cell Count Kit-8)试剂购自日本同仁化学研究所。细胞色素C单克隆抗体(cell signaling公司),RIPA细胞裂解液(上海申能博彩生物科技有限公司),二辛可酸蛋白测定试剂盒(北京博奥森生物技术有限公司),鼠抗beta-actin多抗(武汉博士德生物工程有限公司),电化学发光试剂盒(碧云天生物技术研究所)。
二、ASO
Apollon ASO(序列 5'-AGCCGCAGCCGCCA TCTTCCG-3')、随机序列反义核酸(random oligodeoxynucleotide,RODN,序 列 5'-GAGTCGGGA GTCCGATGGCA-3')由北京赛百盛生物工程技术服务有限公司合成,全硫代修饰,聚丙烯凝胶电泳纯化,冻存于-20℃,使用前用无血清的DMEM/F12培养液配制成100 μmol/L的浓度备用。
三、细胞培养及转染
人肝癌HepG2细胞由暨南大学生化教研室惠赠。细胞培养体系:DMEM/F12培养液含10%新生牛血清,置37℃ 5%CO2培养箱,每2~3天用0.25%胰蛋白酶消化传代培养。试验选用对数生长期、台盼蓝拒染率>95%的细胞。试验时按照脂质体 LipofectamineTM2000(μL)∶ASO(μg)为2.5∶1的比例配制。先用无血清DMEM/F12培养液分别将脂质体和ASO稀释至等体积,室温孵育5 min,然后将脂质体与ASO在室温下混合20 min,再将混合物逐滴加入细胞培养板中。
四、WST-8法检测Apollon ASO对HepG2细胞的增殖抑制
取对数生长期 HepG2细胞,用无血清的DMEM/F12培养液调细胞浓度为4×104个/mL,接种96孔板,每孔100 μL,设对照组、ASO 组(终浓度0.05、0.10、0.15、0.20 μmol/L)、RODN 组(终浓度0.20 μmol/L),48 h后每孔加入 CCK-8试剂10 μL,室温温育90 min,多功能酶标仪(Bio-Rad)测定吸光度(A)值(激发波长450 nm,参比波长655 nm),计算细胞的增殖抑制率。增殖抑制率=(对照组A值-试验组A值)/对照组A值×100%。
五、Annexin V-FITC/PI双染色法检测细胞凋亡
以1.0×106/孔的密度将人HepG2细胞接种12孔培养板,1 mL/孔,12 h后加入药物,设3组即对照组、RODN 组(终浓度 0.20 μmol/L)、ASO组(终浓度 0.05、0.10、0.15、0.20 μmol/L),培养48 h后消化收集细胞,采用试剂盒提供的染色缓冲液重悬,加入FITC-AnnexinV试剂和 PI试剂,避光孵育15 min,加入200 μL染色缓冲液,流式细胞仪检测各组细胞早期凋亡率,试验重复3次,计算均值。
六、Hochest 33258染色观察凋亡细胞形态学变化
以1.0×106/孔的密度将人HepG2细胞接种于12孔板,总体积1 mL,12 h后加入药物,设3组即对照组、RODN组 (终浓度0.20 μmol/L)、ASO组(终浓度0.20 μmol/L),培养48 h后消化收集细胞,磷酸盐缓冲液离心洗2次,涂片,室温干燥,甲醇-冰醋酸 (3∶1)固定15 min,晾干后于暗处用Hochest33258染色10 min,双蒸水冲洗,甘油封片,荧光显微镜观察。
七、线粒体膜电位检测
以1.0×106/孔的密度将人HepG2细胞接种于12孔板,总体积1 mL,12 h后加入药物,设3组即对照组、RODN组 (终浓度0.20 μmol/L)、ASO组(终浓度0.20 μmol/L),培养48 h后消化收集细胞,磷酸盐缓冲液洗涤,取500 μL JC-1工作液将细胞悬浮,置37℃ 5%CO2培养箱中孵育20 min后,孵育缓冲液洗2次,取500 μL孵育缓冲液重悬细胞,滴1滴细胞悬液于载玻片上,盖上盖玻片,于荧光显微镜下观察。
八、实时荧光定量逆转录聚合酶链反应(polymerase chain reaction,PCR)
以1.0×106/孔的密度将人HepG2细胞接种于12孔板,总体积1 mL,设3组即对照组、RODN组(终浓度 0.20 μmol/L)、ASO 组(终浓度0.05、0.10、0.15、0.20 μmol/L),12 h 后加入药物,培养48 h消化收集各组细胞,Trizol试剂提取RNA。采用 M-MLV逆转录酶逆转录为 cDNA。作为PCR的模版,Apollon上游引物 5'-CCAAA GGTGGTGAGCTTCA-3',下游引物 5'-TCTACC CAGCATGGAGGAAC-3',扩增片段大小 214 bp。GAPDH上游引物5'-AGTGCCAGCCTCGTCTC ATA-3',下游引物 5'-TTGAACTTGCCGTGGG TAGA-3',扩增片段大小296 bp。取模板DNA采用SYBRgreen掺入法进行荧光定量PCR,条件如下:95 ℃ 15 s预变性,95 ℃ 4 s,60 ℃ 15 s,72 ℃15 s,共45个循环。所有样本检测均包含一个不加模板的阴性对照,以排除假阳性结果。计算参照文献[4]运用2-△△Ct值来比较对照组和试验组的目的基因mRNA相对表达量的差异。
九、Caspase-3、Caspase-9 活性测定
以1.0×106/孔的密度将人HepG2细胞接种于12孔板,总体积1 mL,设3组即对照组、RODN组(终浓度0.20 μmol/L)、ASO 组(终浓度0.05、0.10、0.15、0.20 μmol/L),12 h 后加入药物,培养48 h消化收集各组细胞。按细胞裂解液(RIPA)说明书提取细胞蛋白。用二辛可酸蛋白定量试剂盒进行蛋白定量,根据定量结果对各蛋白质样本进行校正,并调整蛋白浓度为2.0 μg/μL。每孔吸取50 μL含100 μg蛋白的细胞裂解液上清,同时取50 μL Lysis Buffer作为空白对照,每50微升2×Reaction Buffer加入0.5 μL二硫苏糖醇,每孔吸取50 μL已配制 2 ×Reaction Buffer,再加入5 μL Caspase-3 Substrate 或 Caspase-9 Substrate,37℃避光温育4 h,酶标仪测定A405mm。
十、蛋白免疫印迹技术检测细胞内蛋白的相对表达水平
以1.0×106/孔的密度将人HepG2细胞接种于12孔板,总体积1 mL,设3组即对照组、RODN组(终浓度 0.20 μmol/L)、ASO 组(终浓度0.05、0.10、0.15、0.20 μmol/L),12 h 后加入药物,培养48 h消化收集各组细胞。按RIPA说明书提取细胞蛋白。用二辛可酸蛋白定量试剂盒进行蛋白定量,根据定量结果对各蛋白质样本进行校正。加入样本溶解液和样本,置沸水中煮5 min。不连续的聚丙烯酰胺凝胶电泳(10%聚丙烯酰胺分离胶和5%聚丙烯酰胺浓缩胶),电压80 V,进入分离胶后改为120 V,40 min。将凝胶上的蛋白条带转到硝酸纤维素膜上,半干式转膜15 V 18 min;TBST洗膜5 min,5%牛血清白蛋白封闭缓冲液室温封闭1 h,TBST洗膜3次,每次5 min。4℃过夜孵育一抗。TBST洗膜3次,每次5 min。37℃孵育二抗1 h。TBST洗膜3次,每次5 min。加入电化学发光试剂,显影。BI-2000型图像分析软件分析细胞色素 C和 GAPDH的积分光密度,以GAPDH作为内参。
十一、统计学方法
结 果
一、Apollon ASO对HepG2细胞增殖的影响
Apollon ASO作用于HepG2细胞48 h后,在ASO组中,0.05 μmol/L的Apollon ASO可抑制细胞的增殖,随着ASO浓度的增高,对细胞的增殖抑制率增加,并呈剂量依赖性;与RODN组比较,差异均有统计学意义(P<0.05)。见图1。

图1 不同浓度Apollon ASO对HepG2细胞增殖抑制的比较
二、Apollon ASO诱导HepG2细胞凋亡
Apollon ASO作用于HepG2细胞48 h后,与RODN组及对照组比较,ASO组的早期凋亡率明显增高 (P<0.05),且存在剂量-效应关系。当ASO浓度为0.20 μmol/L时,HepG2细胞早期凋亡细胞率为29.3% ±0.46%。见图2、3。
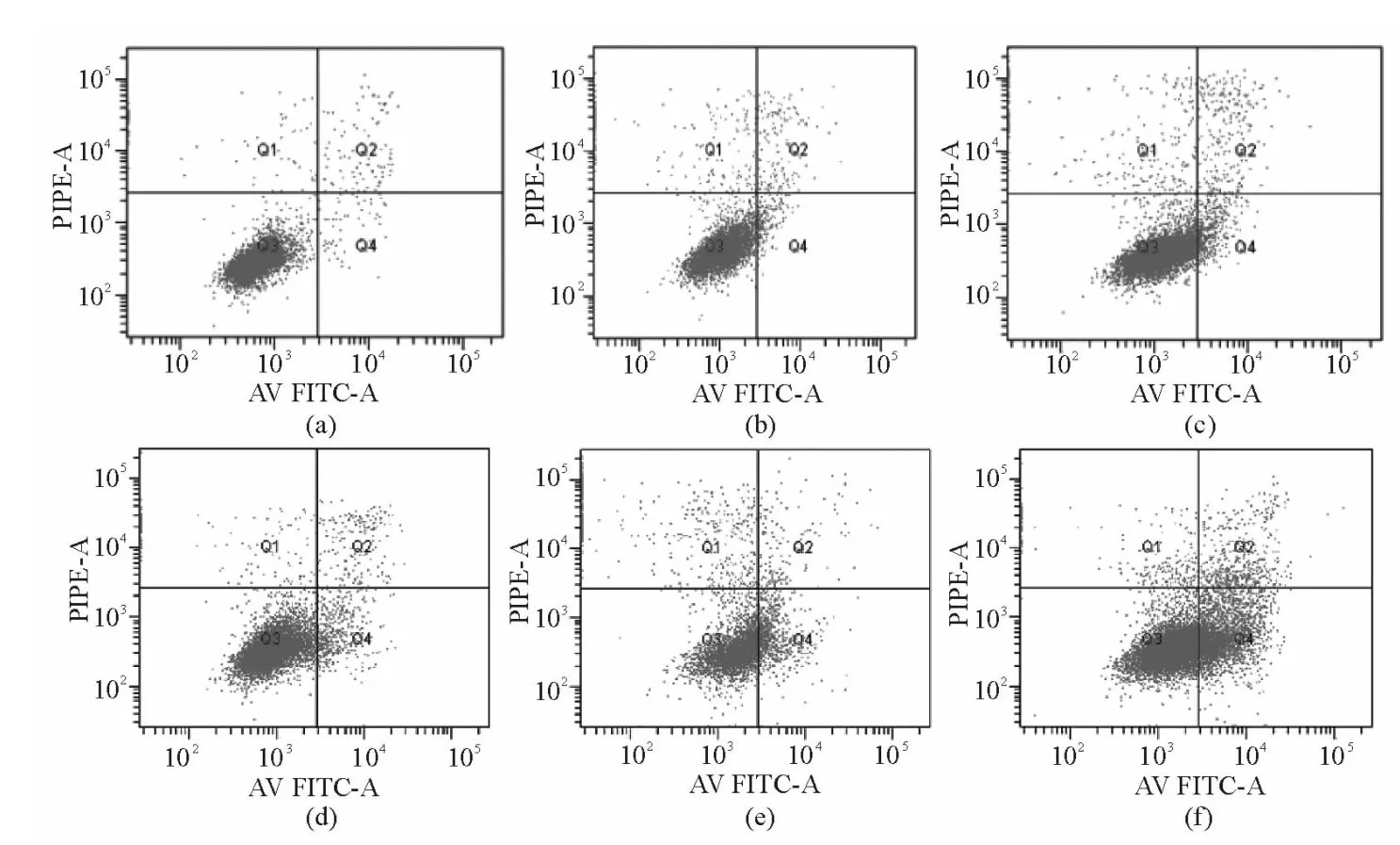
图2 不同浓度Apollon ASO诱导HepG2细胞早期凋亡流式图
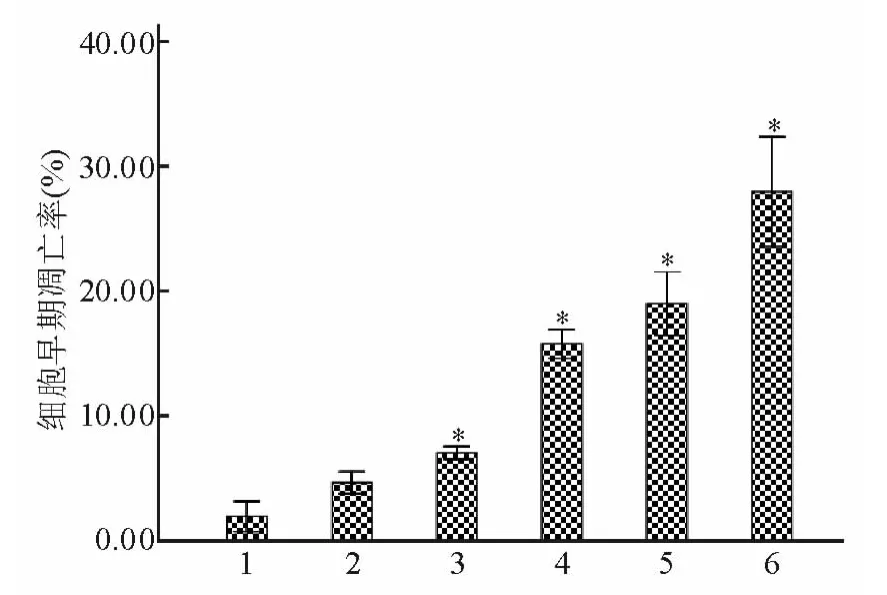
图3 不同浓度Apollon ASO诱导HepG2细胞早期凋亡率的比较
三、凋亡细胞形态学变化
Apollon ASO作用于HepG2细胞48 h后,对照组细胞形态完整,呈低强度荧光;RODN组与对照组相比未见明显差异;而ASO组呈高强度荧光,细胞可见核固缩、边聚、裂解等细胞凋亡形态学变化。见图4。
四、线粒体膜电位变化
细胞发生凋亡时,线粒体跨膜电位被去极化,JC-1从线粒体内释放,线粒体内红光强度减弱(590 nm),以单体的形式存在于胞液内而发绿色荧光(527 nm)。因此在双色滤光片下观察,正常细胞为高绿高红,凋亡细胞为高绿低红。RODN组与对照组细胞相似,都表现为++绿++红(即高绿高红),而ASO组细胞表现为++绿+红(即高绿低红)。见图5。
五、Apollon mRNA的相对表达水平
Apollon基因PCR产物的熔解曲线峰值在78℃,GAPDH的峰值在85℃。熔解曲线分析可见只有单峰值,排除了非特异性扩增。Liva等[4]设计了一种比较阈值法来测定目的基因的相对表达量 (目的基因的相对表达量 =2-ΔΔCt)。Ct值的含义是:每个反应管内的荧光信号到达所设定的阈值时所经历的循环数,ΔΔCt=(Ct目的基因-Ct管家基因)试验组-(Ct目的基因-Ct管家基因)对照组,表示基因的差异表达倍数。不同浓度Apollon ASO作用HepG2细胞48 h后,均具有下调其mRNA表达水平的作用。目的基因mRNA的相对表达量随用药浓度的增加而减少,具有剂量-效应关系。见图6。

图4 Apollon ASO诱导HepG2细胞早期凋亡的形态学变化(×40)

图5 Apollon ASO作用于HepG2细胞线粒体膜电位的变化(×100)
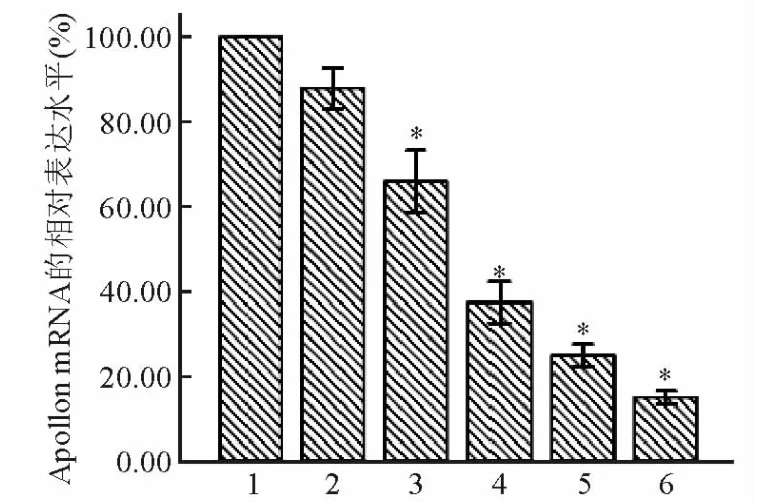
图6 不同浓度Apollon ASO组细胞内Apollon mRNA相对表达水平的比较
六、Caspase-3、Caspase-9 活性
Caspase-3、Caspase-9在正常状态下以酶原的形式存在于胞浆中,没有活性,但在细胞发生凋亡阶段被激活,裂解相应的胞浆胞核底物,最终导致细胞凋亡。随着 ASO浓度的增高,Caspase-3、Caspase-9的活性明显增高,与对照组和RODN组比较,差异具有统计学意义(P<0.05)。见图7。
七、细胞色素C蛋白的相对表达水平
Apollon ASO作用于HepG2细胞48 h后,随着Apollon ASO浓度的增加,细胞色素C蛋白表达水平也增加,表明Apollon ASO促进肝癌细胞凋亡活化了细胞色素C。见图8。
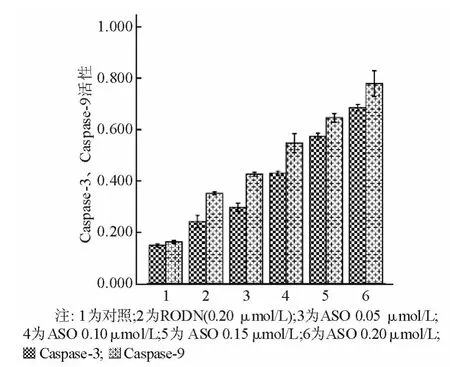
图7 不同浓度Apollon ASO组细胞内Caspase-3、Caspase-9活性的比较

图8 不同浓度Apollon ASO组细胞内细胞色素C蛋白相对表达水平的比较
讨 论
Apollon/BRUCE的抑制凋亡机制尚不十分清楚。有研究发现Apollon主要通过结合Smac、HtrA2以及Caspase等3种机制发挥其抑制凋亡的作用[5]。Sokka等[6]在离体和在体培养的海马神经元细胞培养中发现,Apollon表达水平被红藻氨酸迅速下调。Caspase-3活化、Apollon表达下降,导致神经元细胞死亡。Apollon在红藻氨酸导致的神经退行性病变中起作用,红藻氨酸通过下调 Apollon的表达启动细胞死亡。Lopergolo等[7]发现,靶向 Apollon的 siRNA诱导乳腺癌细胞凋亡与P53稳定性、Caspase-3活性相关。Qiu等[8]发现,Nrdp1/FLRF是一个含有RING环的泛素连接酶,Nrdp1与 BRUCE/Apollon有关。Apollon含有泛素载体蛋白 E2结构域。E2、UbcH5c、Nrdp1催化 Apollon泛素化。Apollon抑制细胞凋亡。RNAi技术抑制Apollon表达,促进细胞凋亡,Apollon将成为肿瘤治疗的靶点[9]。
细胞色素C是第1种被发现的线粒体释放的促凋亡蛋白。细胞色素C与凋亡蛋白酶活化因子(apoptotic prafease activating factor-1,APaf-1)以2∶1的比例结合,形成细胞色素 C/APaf-1复合体。该复合体可使无活性的Caspase-9原发生自身活化,继而形成细胞色素 C/APaf-1/Caspase-9复合体。此复合体继续作用于下游的Caspase-3活化。活化的Caspase-3可以作用于胞质中的细胞骨架蛋白,或作用于细胞核中DNA酶,引起 DNA 断裂,引发凋亡[10]。为了探讨Apollon ASO促进肝癌细胞凋亡的机制,本研究运用Apollon ASO作用于肝癌细胞48 h后,通过荧光染色观察线粒体膜电位改变,比色法测定Caspase-3与Caspase-9的活性及蛋白质免疫印记技术检测细胞色素C的蛋白表达水平。结果显示,Apollon ASO组细胞发生凋亡时,线粒体跨膜电位被去极化,荧光减弱;而 Caspase-3与Caspase-9活性明显增强,细胞色素C蛋白水平表达也增加。本研究结果表明,Apollon ASO促进肝癌细胞发生凋亡可通过线粒体介导的途径,是否通过其他途径,还需进一步试验验证。
近年来,新的靶向治疗药物及反义技术的应用已经为肝癌的治疗开辟了新的前景。反义技术的基本原理就是根据碱基互补原则,用人工合成或生物体表达的特定互补的DNA或 RNA片段(ASO)抑制或封闭专一靶基因表达[11]。本研究运用IAP家族中的Apollon ASO转染肝癌HepG2细胞,结果表明Apollon ASO通过下凋 Apollon mRNA基因来抑制肝癌HepG2细胞增殖,并通过线粒体介导的途径促进其凋亡。但本研究只采用一株肝癌细胞为试验对象,存在一定的局限性,在今后的试验中我们将继续采用不同的肝癌细胞株作为研究对象,进一步研究 Apollon ASO与Apollon siRNA促肝癌细胞凋亡及机制,期望Apollon为肝癌的治疗提供一个新的靶点。
[1]Dubrez-Daloz L,Dupoux A,Cartier J.IAPs:more than just inhibitors of apoptosis proteins[J].Cell Cycle,2008,7(8):1036-1046.
[2]Ismail EA,Mahmoud HM,Tawfik LM,et al.BIRC6/Apollon gene expression in childhood acute leukemia:impact on therapeutic response and prognosis[J].Haematol,2012,88(2):118-127.
[3]何金花,陈顺仪,王 莉,等.Survivin、xiap、apollon和livin反义寡核苷酸对人消化系肿瘤细胞增殖及凋亡的影响[J].中国药理学通报,2011,27(3):367-372.
[4]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402-408.
[5]Sekine K,Hao Y,Suzuki Y,et al.HtrA2 cleaves Apollon and induces cell death by IAP-binding motif in Apollon-deficient cells[J].Biochem Biophys Res Commun,2005,330(1):279-285.
[6]Sokka AL,Mudo G,Aaltonen J,et al.Bruce/apollon promotes hippocampal neuron survival and is downregulated by kainic acid[J].Biochem Biophys Res Commun,2005,338(2):729-735.
[7]Lopergolo A,Pennati M,Gandellini P,et al.Apollon gene silencing induces apoptosis in breast cancer cells through p53 stabilisation and caspase-3 activation[J].Br J Cancer,2009,100(5):739-746.
[8]Qiu XB,Goldberg AL.The membrane-associated inhibitorofapoptosis protein,BRUCE/Apollon,antagonizes both the precursor and mature forms of Smac and caspase-9[J].J Biol Chem,2005,280(1):174-182.
[9]Pennati M,Millo E,Gandellini P,et al.RNA interference-mediated validation of survivin and Apollon/BRUCE as new therapeutic targets for cancer therapy[J].Curr Top Med Chem,2012,12(2):69-78.
[10]胡 辉,荆绪斌,蔡先彬,等.姜黄素氧化损伤线粒体诱导肝癌SMMC-7721细胞凋亡的研究[J].重庆医学,2012,41(3):269-270.
[11]蒋建伟,吴风云,何金花,等.靶向 Bcl-2、Bcl-xl、Mcl-1、Bcl-w、A1反义核酸抑制消化系肿瘤细胞增殖效果的差异[J].中国药理学通报,2010,26(8):1093-1098.
