基于MetaCoreTM分析维吾尔族宫颈癌患者潜在血浆标志物分析*
2013-01-07刘开江哈丽丹热依木武贵臻阿布力孜阿布杜拉
郭 霞 刘开江 哈丽丹·热依木 武贵臻 阿布力孜·阿布杜拉
新疆地区维吾尔族妇女宫颈癌发病率高(490~526/10万例),死亡率是其他民族平均水平的3~4倍,被列为新疆特高发肿瘤之一[1]。研究开发最终筛选出特异灵敏的血浆肿瘤标志物,是建立无创伤性早期诊断标准的重要切入点[2]。蛋白质组学作为生命科学与技术的新一代引擎,带动了大量相关学科领域的快速发展。通过蛋白质组学高通量表达特征谱和差异谱的分析,能够从整体水平上获得大量的信息。但是只有通过有针对性的数据挖掘和整合分析,才能从大量表达谱数据中提取出有生物学意义的信息,构建出综合性生物信号网络与关系以及探测早期预警的标记物,进而达到解释数据所蕴含的重要的分子机制的目的[3]。本研究依托MetaCoreTM在线生物信息学分析平台探讨维吾尔族患者宫颈癌的发生与癌变机理以及寻找血浆预警蛋白。
1 材料与方法
1.1 仪器与试剂
MetaCore(MetaCoreTMAnalysis)在线生物信息学分析平台是美国GeneGo公司产品。
1.2 差异蛋白的MetaCoreTM生物信息学分析
基于前期研究针对维吾尔族宫颈癌患者血浆蛋白质组学筛查和IPA@(Ingenuity Pathway Analysis)在线生物信息学软件富集分析,最终获得43个核心差异蛋白[4],将其上传至MetaCore数据库,进行蛋白质功能注释与富集分析、信号调控网络的构建分析进行分析。主要分析如下:1)蛋白质功能注释与富集分析(protein functional annotation and enrichment analysis),基于基因本体论(gene ontology)、京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)和在线人类孟德尔遗传数据库(online mendelian inheritance in man,OMIM),对差异蛋白进行功能注释(protein functional annotation)、细胞内组成(cellular component)以及在机体中所负责的生物学加工进程(biological process)进行富集分析(enrichment analysis),理解差异蛋白质在已知的研究成熟的通路里其相互作用关系,鉴别对细胞和疾病表型有显著影响的蛋白,并了解蛋白是如何影响表型的。2)信号调控网络的构建分析(network construction and analysis),根据软件提供的网络分析算法,设置网络大小和关联参数对该网络生物相关背景进行分析,创建差异蛋白质的相互作用及调控网络,以便可以洞察与推测蛋白的分子作用机制。3)生物标志物预测与评估(biomarker assessment),是鉴于Meta-CoreTM数据库的信息,通过使用“子宫颈疾病”进行过滤,基于那些与研究发现最相关的生物特征,进行有计划地优化与已知疾病相匹配的蛋白质组学数据,找到与实验数据最相关及最有可能的候选生物标记。
2 结果
2.1 宫颈癌差异蛋白的MetaCoreTM生物信息学分析
2.1.1 蛋白质功能注释与富集分析结果 为了阐释差异蛋白质的生物特征和所影响的生物进程,对每一个差异蛋白进行生物功能注释,并对差异蛋白进行以下三个方面分析,以P<0.1为有意义。
1)参与的生物学加工进程:发现这些差异蛋白的生物学功能多样,而蛋白分布最为集中的主要生物学功能包括:细胞内构成的负调节、胆固醇反向转运、应激反应的负调节等共计24个(图1A)。
2)细胞内组成:在细胞内的组成主要集中于高密度脂蛋白颗粒、血浆脂蛋白颗粒和脂蛋白复合体(图1B)。
3)GeneGo网络分布:基于对差异蛋白各种功能的富集分析,构建出主要参与的功能网络,发现主要参与脂代谢中的胆汁酸代谢调节和受体依赖的胆汁酸浓缩负调节、炎症补体系统、细胞骨架肌动蛋白纤维、ESR1膜受体转导途径和炎症反应IL-6途径(图2)。
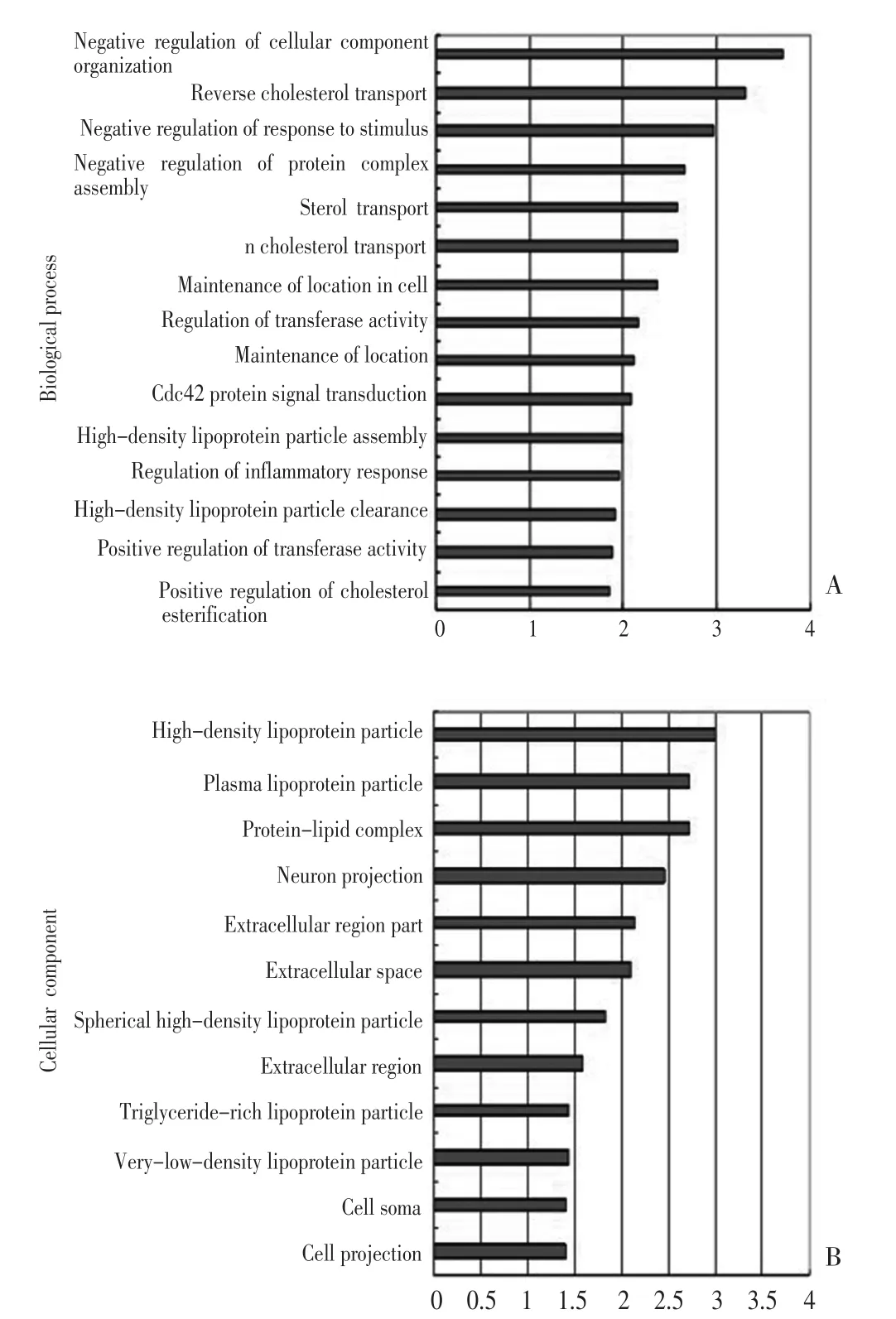
图1 差异蛋白负责的生物学加工进程(A)和机体细胞内组成(B)Figure1 Biological process of selected proteins(A)and cellular component distribution(B)
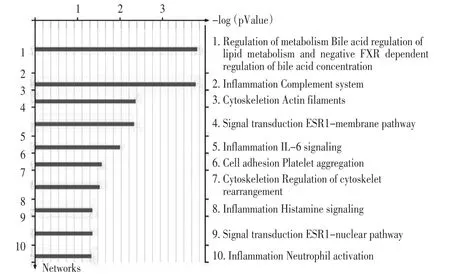
图2 差异蛋白的GeneGo网络分布的富集分析Figure2 GeneGo network distribution of selected proteins
2.1.2 信号调控网络的构建分析结果 通过Meta-Core最短路径算法分析构建出差异蛋白功能和相互作用网络图(图3)。
2.1.3 生物标志物的筛选分析 通过生物标志物的筛选与优化候选生物标记分析,从43个核心差异蛋白中找到与宫颈病变与宫颈癌最相关及最有可能的4个候选生物标记(表1),分别是抗凝血酶Ⅲ(AntithrombinⅢ,ATⅢ)、凝集素(clusterin,CLU)、绒毛蛋白1(villin 1,VIL1)和免疫球蛋白κ(immunoglobulin kappa locus,IGKκ),如表1所示信息,并且构建出这4个蛋白相互作用图(图4),图中清楚地标示出其主要调节蛋白。
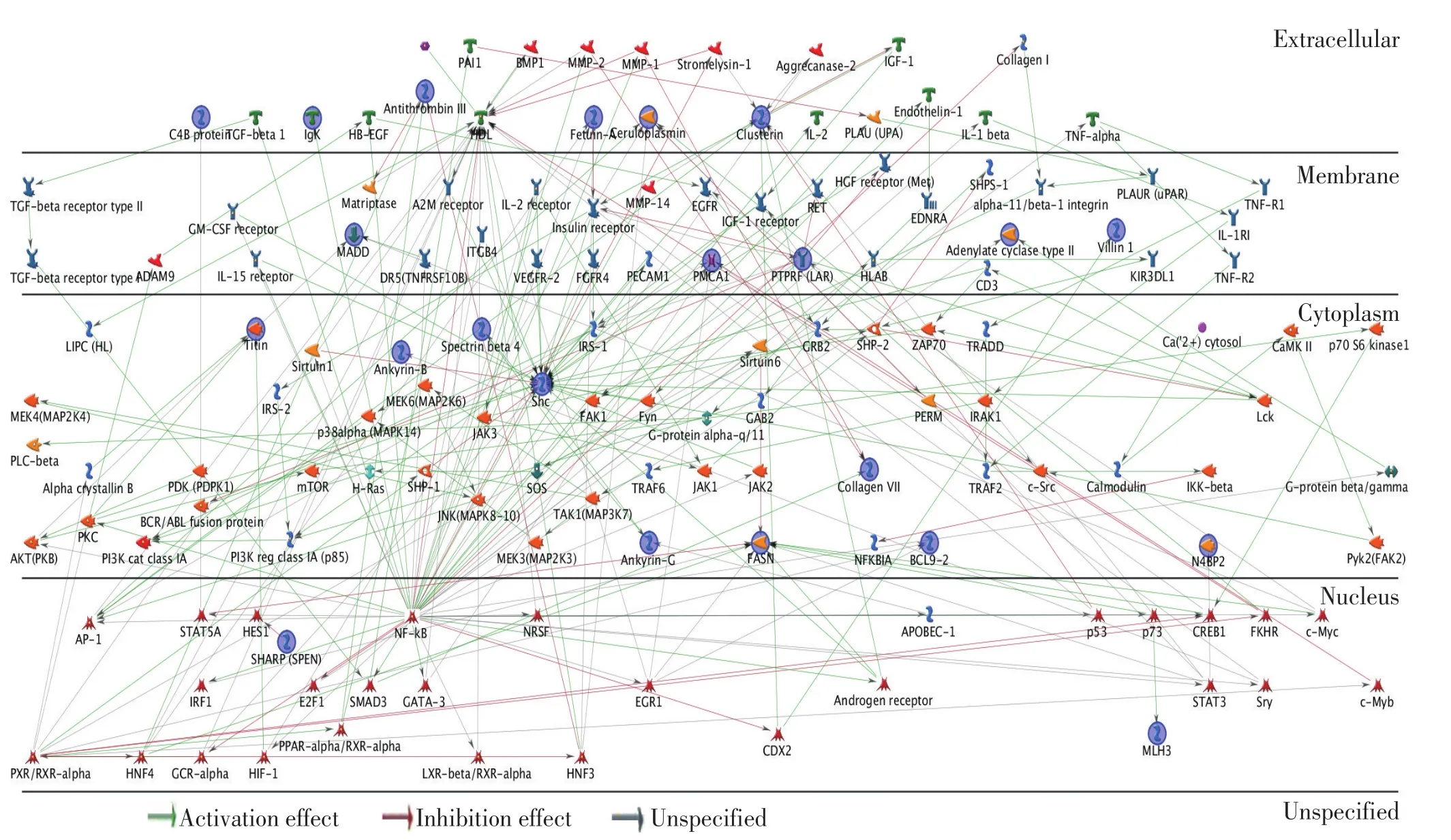
图3 通过MetaCore最短路径算法分析构建差异蛋白功能和相互作用网络图Figure3 MetaCore network of selected proteins constructed using shortest path algorithm

表1 宫颈癌患者血浆生物标志物的筛选分析Table1 Biomarker filter analysis of the differentially expressed proteins of plasma proteome between patients with cervical cancer and cervicitis
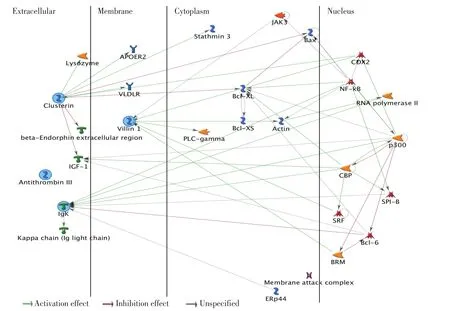
图4 宫颈疾病候选生物标志物的网络构建图Figure4 Networks of candidate biomarkers of uterine cervical diseases
3 讨论
本研究运用的MetaCoreTM的分析平台是基于一个独特的、申请专利的、高质量的人工修正的数据库,包括各种蛋白-蛋白和蛋白-DNA相互作用网络、各种转录因子、信号转导和代谢反应通路以及各种生物活性分子的数据,整合了“数据挖掘”工具包,能够提供可信的资源在一个复杂的生物学系统中解释实验数据。
本研究分析发现在宫颈癌阶段机体的物质代谢尤其是脂代谢调节发生紊乱。并且分析推测,长期的慢性炎症和人乳头瘤病毒(human papillomavirus,HPV)感染并存,导致细胞微环境的改变,炎症补体系统和通路激活,活化下游不同的效应物转录因子,扰动了机体各个方面的调节,激活了恶性转化的细胞学与分子学机制,诱导细胞增殖、永生和迁徙,是宫颈癌发生与发展的始动因素[5]。
通过生物标志物的筛选分析,筛查出与宫颈癌最相关及最有可能的4个候选生物标记,分别是ATⅢ、CLU、VIL1和IGK@,构建了它们之间的相互作用图。发现CLU、VIL1和IGK@均对NFκB和COX-2有激活作用,而NF-κB等这些转录因子均是炎症持续相关的重要介质释放的主要调控器,这些通路的活化会形成恶性循环。又发现CLU通过BCL-XL和BAX蛋白,IGK@通过BCL-6抑制细胞的凋亡,因此最终不仅导致细胞增殖又抑制细胞凋亡,促使炎症加重、恶化和肿瘤形成。
抗凝血酶Ⅲ(ATⅢ)能够灭活多种凝血酶而发挥抗凝功能,本研究筛查出其在宫颈癌患者血浆中表达降低,认为在肿瘤阶段可能出现复杂的凝血-抗凝-纤溶系统的改变,总体的抗凝功能降低,表现为复杂的血栓前状态,这种状态有利于癌栓形成,易于癌细胞的黏附、浸润和转移[6]。近年研究发现,抗凝血酶具有抗血管新生、抑制细胞增殖等抗肿瘤的作用[7]。凝集素(CLU)是一种异源二聚体硫酸化糖蛋白,涉及衰老、肿瘤的发生发展、血管损伤等多种生理和病理过程,在多种恶性肿瘤和癌前病变中上调表达,可作为其早期预警以及肿瘤预后评价的参考指标[8]。IGK@蛋白目前的研究报道很少,但是在多种体液蛋白质组学研究中都被筛查出[9]。本研究结果表明其在宫颈癌患者血浆中表达上调,可以为后续该蛋白的研究提供例证。绒毛蛋白1(VIL1)是钙调节肌动蛋白结合蛋白家族的成员,具有肌动丝封盖,切断,捆绑功能[10]。最近报道证明绒毛蛋白1是上皮性细胞抗凋亡蛋白,可以用来辅助明确转移性肿瘤的来源,是肠上皮细胞分化和转移性肠腺癌[11]、宫颈腺癌[10]相对敏感的特异性标志。
综上所述,本研究基于生物信息学对蛋白质组学数据挖掘分析,阐释了宫颈癌发生的机理,筛选出的ATⅢ、CLU、IGK@和VIL1可以作为宫颈癌的早期预警候选标志蛋白。
1 拉莱·苏祖克,彭玉华,周 康,等.新疆不同民族宫颈癌发病趋势分析[J].新疆医科大学学报,2006,29(7):569-571.
2 Landegren U,Vänelid J,Hammond M,et al.Opportunities for Sensitive Plasma Proteome Analysis[J].Anal Chem,2012,84(4):1824-1830.
3 Liu FJ,Hua XF,Wang WJ.A new bioinformatics insight into human cancer-associated proteins[J].OncolRep,2012,27(6):1932-1936.
4 Guo X,Abliz G,Reyimu H,et al.The association of a distinct plasma proteomic profile with the cervical high-grade squamous intraepithelial lesion of Uyghur women:a 2D liquid-phase chromatography/mass spectrometry study[J].Biomarkers,2012,17(4):352-361.
5 de Freitas AC,Gurgel AP,Amaral CM,et al.Susceptibility to cervical cancer:An overview[J].Gynecol Oncol,2012,126(2):304-311.
6 张 琳,唐沪强.胃癌患者凝血指标变化及临床意义[J].检验医学与临床,2012,9(2):166-167.
7 陈 楠,徐 昆.肝素抗凝血酶Ⅲ在肿瘤治疗中的应用与展望[J].重庆医学,2011,40(20):2062-2064.
8 Lee S,Hong SW,Min BH,et al.Essential role of clusterin in pancreas regeneration[J].Dev Dyn,2011,240(3):605-615.
9 Wang HY,Tian YF,Chien CC,et al.Differential proteomic characterization between normal peritoneal fluid and diabetic peritoneal dialysate[J].Nephrol Dial Transplant,2010,25(6):1955-1963.
10 Nakamura E,Iwakawa M,Furuta R,et al.Villin1,a novel diagnostic marker for cervical adenocarcinoma[J].Cancer Biol Ther,2009,8(12):1146-1153.
11 Suh N,Yang X J,Tretiakova M S,et al.Value of CDX2,villin,and alpha methylacyl coenzyme A racemase immunostains in the distinction between primary adenocarcinoma of the bladder and secondary colorectal adenocarcinoma[J].Mod Pathol,2005,18(9):1217.
