胃癌组织中TRβ1和β-catenin的表达及其临床意义
2013-01-05杨小敏徐晓武郭群袁吟迅陈艳梅潘丹
杨小敏,徐晓武,郭群,袁吟迅,陈艳梅,潘丹
(1.温州市人民医院 病理科,浙江 温州 325000;2.温州医科大学附属第二医院 肿瘤外科,浙江温州 325027)
胃癌的发生、发展是一个多步骤、多基因改变的过程,受多基因调控[1]。近来研究发现甲状腺激素受体β1(TRβ1)在抑制肿瘤方面起重要作用。在肝脏、乳腺[2]等部位的癌组织都发现TRβ1表达异常。目前对TRβ1、β连环蛋白(β-catenin)与胃癌各临床指标相关性的研究较少。本研究通过SP法和RT-PCR技术检测胃癌组织中TRβ1和β-catenin的表达情况,并分析两者与临床病理指标的关系,探讨其在胃癌发生、发展过程中的作用机制,为判断预后及指导临床治疗提供依据。
1 材料和方法
1.1 标本来源 收集2010年1月-2012年6月在我院行手术治疗的胃癌手术标本80例,其中男45例,女35例,年龄30~85岁,平均(58.3±11.6)岁。高、中分化腺癌22例,低分化腺癌58例。所有病例术前均未进行化疗或放疗。无癌胃黏膜40例,取自上述胃癌标本距癌组织10 cm以上的切缘,经石蜡切片证实无癌浸润。所有标本均经4%中性甲醛固定,石蜡包埋,连续切片厚4μm,均经病理确诊。1.2 方法
1.2.1 免疫组化主要试剂及染色:TRβ1(Clone J51;Santa Cruz)、β-catenin(Sigma);SP 二步法染色试剂盒购自基因科技有限公司。操作步骤如下:烤片,68 ℃,30 min。4μm石蜡切片脱蜡水化,PBS洗涤3次;3%过氧化氢阻断内源性过氧化物酶15 min,pH 8.0的EDTA缓冲溶液高温高压抗原热修复2.5 min;PBS洗涤3次,分别滴加一抗(TRβ1)或β-catenin抗体(稀释度分别为1:50、1:200,PBS稀释),4 ℃过夜孵育。过夜孵育后室温再孵育30 min,PBS洗涤3次,滴加通用型二抗室温孵育30 min;PBS洗涤3次后DAB显微镜下控制显色,苏木素复染细胞核,水洗蓝化后乙醇脱水,中性树胶封片。
1.2.2 结果判断:根据其细胞内分布特征,分别作如下界定:TRβ1阳性染色为胞核浅棕色至深棕色,H-score法[3]依据阳性细胞的百分比和染色强度(1+,2+,或3+)的乘积之和计算总分,即H=(%1+)×1+(%2+)×2+(%3+)×3,如果切片染色评分H≤0.1(<10% 细胞呈轻微阳性)判定为阴性,如果H>0.1判定为阳性。β-catenin阳性染色为细胞膜或细胞浆出现棕黄色细小颗粒,参照文献[4-5],将染色记为0~3分:细胞膜、细胞浆均未染色为0分;细胞浆染色为主为1分;异质性染色(细胞膜、细胞浆混合染色)为2分;连续的细胞膜染色为3分。细胞如果无连续的细胞膜染色被视为异常,即0~2分为阳性表达。
1.3 RT-PCR技术检测TRβ1和β-catenin mRNA表达 Trizol总RNA抽提纯化及RT-PCR试剂盒均购自宝生物工程(大连)有限公司。TRβ1及β-catenin的引物经Gene Bank检索,利用Primer5.0软件设计,引物购自北京三博远志生物技术有限公司。TRβ1上游引物5’-TACTTAGACAAGGACGAGC-3’,下游引物5’-GTAATCCAGCACCAAATC-3’,产物305 bp;βcatenin上游引物5’-GGGCGGCACCTTCCTACTTC-3’,下游引物5’-AGCTCCCTCGCGGTTCAT-3’,产物128 bp。β-actin上游引物5’-GTGGGGCGCCCCAGGCACCA-3’,下游引物5’-CTCCTTAATGTCACGCACGATTTC-3’,产物498 bp。退火温度分别为53、57、53.5 ℃。反应条件均为94 ℃ 预变性4 min 30 s;94 ℃变性30 s,72 ℃延伸3 min,共35个循环;最后72 ℃延伸10 min。β-actin作为内参。PCR产物于2%的琼脂糖凝胶电泳观察并应用Gel-Pro 4400凝胶分析系统进行电泳图像采集;应用Gel-Pro analyzer软件对TRβ1、β-catenin及β-actin PCR产物进行光密度值分析,根据胃癌组及无癌胃黏膜组TRβ1或β-catenin与β-actin光密度的比值标示TRβ1和β-catenin mRNA相对表达量。
1.4 统计学处理方法 采用SPSS 17.0统计软件包进行统计学分析。计量数据用±s表示,组间比较用Scheffe检验法,计数资料用x2检验。P<0.05为差异有统计学意义。
2 结果
2.1 TRβ1蛋白的表达 无癌胃黏膜组织细胞核染色呈强阳性,偶尔胞浆也着色(见图1a); 胃癌组织细胞核染色呈阴性或弱阳性(见图1b)。胃癌组织TRβ1的阳性表达率明显低于无癌胃黏膜组织(P<0.01),阳性表达率分别为16.25%(13/80)、80.00%(32/40)。
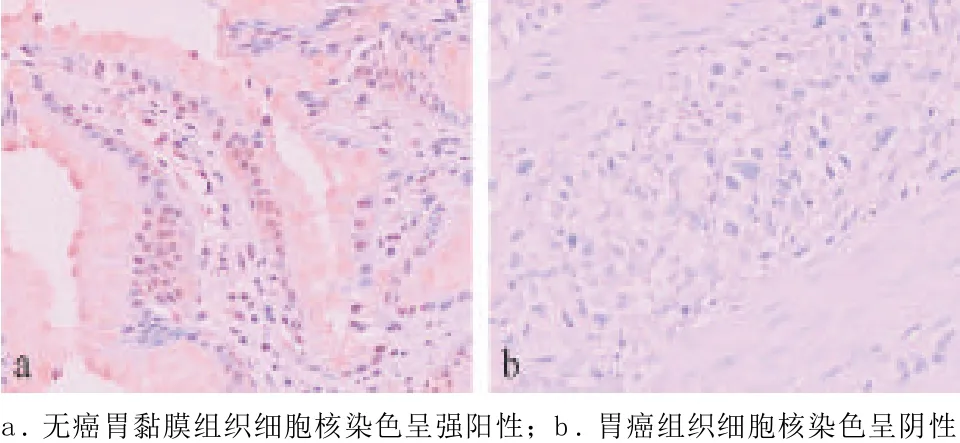
图1 TRβ1蛋白在无癌胃黏膜和胃癌组织中的表达(SP法,×200)
2.2 β-catenin的异常表达 无癌胃黏膜组织βcatenin表达几乎全部定位于细胞膜上,仅有个别标本细胞浆有弱染色,未见细胞核表达,异常表达率为0(见图2a)。胃癌组织中细胞膜表达显著减少,细胞浆表达明显增加,异常表达50例,阳性率为62.50%(50/80)(见图2b),两者差异有统计学意义(P<0.01)。
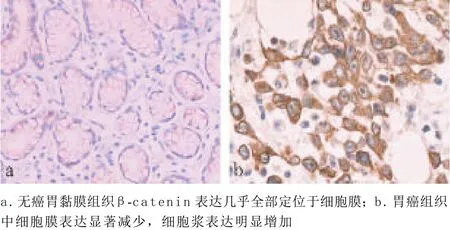
图2 β-catenin蛋白在无癌胃黏膜组织和胃癌组织中的表达(SP法,×200)
2.3 TRβ1和β-catenin mRNA的表达 TRβ1 mRNA在无癌胃黏膜组织的表达量高于胃癌组织 ,差异有统计学意义(P<0.01);β-catenin mRNA的表达量则呈现相反的趋势,即在胃癌组织中的表达量要高于无癌胃黏膜组织(P<0.01)。见图3、表1。

图3 TRβ1和β-catenin mRNA表达电泳图
表1 TRβ1和β-catenin mRNA在胃癌组织和无癌胃黏膜组织中的表达(±s)

表1 TRβ1和β-catenin mRNA在胃癌组织和无癌胃黏膜组织中的表达(±s)
与胃癌组织比:aP<0.01
组织胃癌组织无癌胃黏膜组织n 80 40 TRβ1 mRNA 0.16±0.04a 0.61±0.21a β-catenin mRNA 0.68±0.22a 0.39±0.16a
2.4 TRβ1和β-catenin mRNA表达与临床病理指标的关系 TRβ1 mRNA表达水平在细胞分化程度低、淋巴结转移、肿瘤浸润T3~T4及TNM分期III~IV期患者的肿瘤组织中较细胞分化程度较高、无远处淋巴结转移、肿瘤浸润T1~T2及TNM分期I~II期患者显著降低(P<0.05),β-catenin mRNA则相反(P<0.05)。而两者与患者性别、年龄及肿瘤大小均无关(P>0.05),见表2。
3 讨论
Guigon等[6]研究表明,TRβ能与T3结合,使βcatenin和TRβ复合体之间的相互作用减弱,从而使β-catenin游离,随后β-catenin通过GSK3β调解途径或p53诱导途径降解。突变的TRβ也能与βcatenin形成复合体,但是失去了与T3结合的功能,因此即使存在T3,β-catenin也不能从复合体解离,使得β-catenin不能及时降解,从而引起细胞内βcatenin大量蓄积。β-catenin作为Wnt/β-catenin信号通路的第二信使,是Wnt信号通路的核心成分。β-catenin在细胞质内的聚积不仅是Wnt通路激活的标志,还成为恶性肿瘤中的常见事件之一[7]。在正常情况下,β-catenin在细胞膜中表达,细胞质中很少表达。若细胞质内β-catenin含量升高,会导致细胞核内含量增多,促使下游靶基因,如CyclinDl和c-myc等的持续激活,最终加强了细胞增殖活性。
表2 TRβ1和β-catenin mRNA表达与临床病理指标的关系(±s)
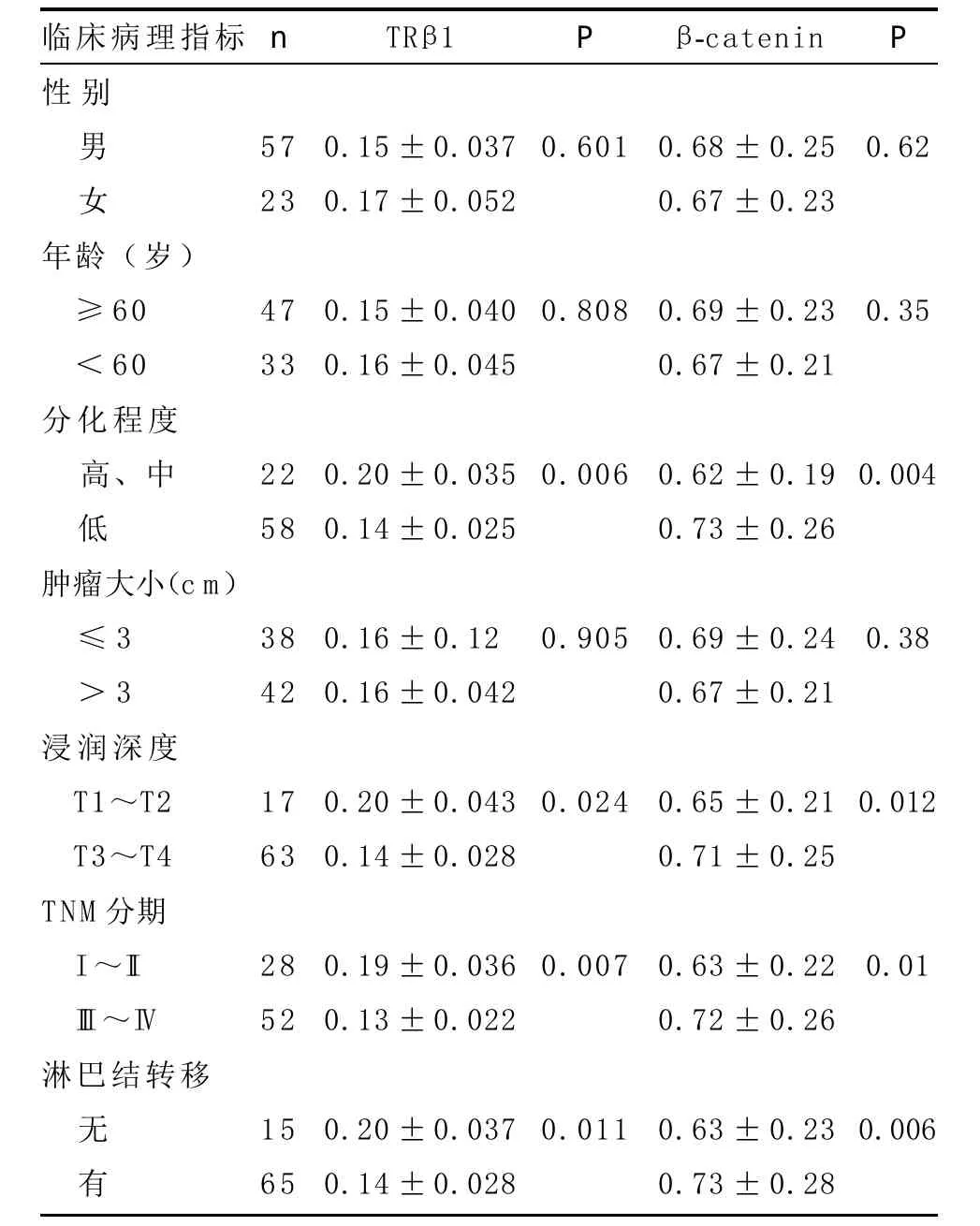
表2 TRβ1和β-catenin mRNA表达与临床病理指标的关系(±s)
临床病理指标性别n TRβ1P β-catenin P男 女57 23 0.15±0.037 0.17±0.052 0.6010.68±0.25 0.67±0.23 0.62 47 33 0.15±0.040 0.16±0.045 0.8080.69±0.23 0.67±0.21 0.35 22 58 0.20±0.035 0.14±0.025年龄(岁)≥60<60分化程度高、中低肿瘤大小(cm)≤3>3浸润深度T1~T2 T3~T4 TNM分期I~II III~IV淋巴结转移0.0060.62±0.19 0.73±0.26 0.004 38 42 0.16±0.120 0.16±0.042 0.9050.69±0.24 0.67±0.21 0.38 17 63 0.20±0.043 0.14±0.028 0.0240.65±0.21 0.71±0.25 0.012 28 52 0.19±0.036 0.13±0.022 0.0070.63±0.22 0.72±0.26 0.01无 有15 65 0.20±0.037 0.14±0.028 0.0110.63±0.23 0.73±0.28 0.006
本研究通过免疫组化SP法检测TRβ1和β-catenin蛋白在胃癌组织和无癌胃黏膜组织中的表达情况,结果发现,胃癌组织TRβ1的阳性表达率明显低于无癌胃黏膜组织(P<0.01),阳性表达率分别为16.25%、80.00%。无癌胃黏膜组织β-catenin表达几乎全部定位于细胞膜上,仅有个别细胞浆有弱染色,未见细胞核表达,异常表达率为0。胃癌组织中细胞膜表达显著减少,细胞浆表达明显增加,异常表达率为62.50%,两者差异有统计学意义(P<0.01)。
为了进一步证实TRβ1和β-catenin在胃癌组织和无癌胃黏膜组织中的表达情况,本研究又采用RT-PCR法对两者的mRNA含量进行检测,结果发现,TRβ1 mRNA在无癌胃黏膜组织中的表达量高于癌组织(P<0.05),β-catenin mRNA的表达量则呈现相反的趋势,即在癌组织中的表达量要高于无癌组织(P<0.05)。
结合以往及本研究结果,推测在胃癌的发生发展过程中有可能也发生了TRβ1突变,导致正常TRβ1 mRNA及其蛋白表达下降。突变的TRβ1使β-catenin得不到及时降解,使其在细胞内大量蓄积,导致下游靶基因的持续激活,从而引起细胞持续增殖。
有关TRβ1、β-catenin与肿瘤的临床病理特性关系的研究较少。有研究表明,两者与淋巴结转移、临床分期等有关[8-9]。本研究发现TRβ1和β-catenin mRNA的表达量与肿瘤的分化程度、有无淋巴结转移、肿瘤浸润深度及TNM 分期有关(P<0.05),而与年龄、性别、肿瘤大小无关(P>0.05),这可能是由于TRβ1的突变致使β-catenin在细胞膜中表达减少,从而使细胞失去黏附功能导致细胞分散,癌细胞表型改变获得高侵袭性,易于发生浸润与转移[10]。
[1] 周宏众, 韩少良, 余作黔, 等. p73和COX-2在胃腺癌中的表达及其预后意义[J]. 温州医学院学报, 2008, 38 (6): 541-543.
[2] Martínez-Iglesias O, Garcia-Silva S, Tenbaum SP, et al. Thyroid hormone receptorβ1 acts as a potent suppressor of tumor invasiveness and metastasis[J]. Cancer Res, 2009,69(2): 501-509.
[3] McCarty KS Jr, Szabo E, Flower JL, et al. Use of a monoclonal anti-estrogen receptor antibody in the immunohistochemical evaluation of human tumors[J]. Cancer Res,1986, 46(8 Suppl): 4244s-4248s.
[4] Jawhari A, Jordan S, Poole S, et al. Abnormal immunoreactivity of the E-cadherin-catenin complex in gastric carcinoma: relationship with patient survival[J]. Grastroenterology, 1997, 112(1): 46-54.
[5]王渝, 柯昌庶, 赵秋, 等. E-cadherin,β-catenin, CyclinD1在胃腺癌中的表达及临床意义[J]. 世界华人消化杂志, 2007, 15(4): 403-407.
[6] Guigon CJ, Zhao L, Lu C, et a1. Regulation ofβ-catenin by a novel nongenomic action of thyroid hormoneβ receptor[J]. Mol Cell Biol, 2008, 28(14): 4598- 4608.
[7] 云波, 刘淑萍, 王海生, 等. Wnt通路中β-catenin在恶性肿瘤中的异常表达[J]. 科学技术与工程, 2010, 10(20): 5027-5030.
[8] 彭旭升, 石怀银. 甲状腺激素受体β1 在甲状腺滤泡癌的预后价值[J]. 军医进修学院学报, 2012, 33(6): 602-603, 606.
[9] 俞敏, 冯一中, 高璀乡. 胃腺癌中PAR-2,β-catenin和COX-2的表达及其意义[J]. 临床与实验病理学杂志, 2011, 27(6): 590-593.
[10]Hrkk TT, Tuppurainen K, George SM et al. Thyroid hormone receptorβ1 in normal colon and colorectal cancerassociation with differentiation, polypoid growth type and K-ras mutations[J]. Int J Cancer, 2006, 118(7): 1653-1659.
