光纤溶出仪对不同厂家酮洛芬缓释胶囊的体外释放度考察
2013-01-04蔡丹宁徐华丽胡敏湖北省食品药品监督检验研究院湖北武汉430064湖北中医药大学湖北武汉430065
蔡丹宁,徐华丽,胡敏 (.湖北省食品药品监督检验研究院,湖北 武汉430064;.湖北中医药大学,湖北 武汉430065)
酮洛芬(ketoprofen)为2-芳基丙酸非甾体抗炎药,广泛用于治疗风湿、类风湿性关节炎、脊髓炎及痛风。酮洛芬缓释胶囊半衰期较普通制剂更长,避免了频繁服药,临床使用更加方便[1]。国内共有5家生产企业,3个规格(75 mg,0.1 g,0.2 g),其质量标准中释放度检查的试验方法、溶出介质、转速、取样时间点、限度均不相同。为比较各厂家生产的酮洛芬缓释胶囊的释放行为,采用光纤药物溶出原位过程监测仪,参考美国药典34版(USP34)及相关文献[2],对收集到的3个厂家的酮洛芬缓释胶囊(另外2个厂家现近期生产)进行了释放度考察。
1 材料
FODT-601FX光纤药物溶出度仪(新疆富科思生物技术公司);AL204电子天平(瑞士梅特勒-托利多公司);U-3900紫外可见分光光度计(日本日立公司)。
酮洛芬缓释胶囊(厂家A:规格0.2 g,批号100703;厂家B:规格75 mg,批号100101226;规格0.1 g,批号101001300;规格0.2 g,批号101101;厂家C:规格0.2 g,批号110301)。
酮洛芬对照品(中国食品药品检定研究院,批号10337-0001);纯化水自制;磷酸二氢钾、氢氧化钠、磷酸二氢钾及无水磷酸氢二钠均为分析纯。
2 方法
2.1 释放度测定 试验采用FODT-601FX六通道型光纤药物溶出度实时测定仪,以磷酸盐缓冲液(pH6.8)为释放介质,介质体积1 000 mL;采用篮法,转速为100 r·min-1;设定测定波长260 nm、参比波长为550 nm。将光纤探头(75 mg及0.1 g采用1 mm探头,0.2 g规格采用0.5 mm 探头)浸入盛有溶出介质的溶出杯中,待扫描空白后于6个溶出杯中分别投入酮洛芬缓释胶囊,对其溶出过程进行实时监测获得完整的溶出曲线图。取样间隔为10 min,8 h后结束采集,参考USP34考察第1,4,8 h的释放量(限度分别为10%~25%、55%~80%及80%以上)。
2.2 检测波长的选择及空白胶囊干扰试验 取酮洛芬对照品适量,采用磷酸盐缓冲液(pH6.8)配制质量浓度为10μg·mL-1的溶液,在200~300 nm范围内扫描,由图1可见,酮洛芬在260 nm处有最大吸收。故将测定波长确定为260 nm,参比波长为550 nm。
采用磷酸盐缓冲液(pH6.8),配制本次所收集到3个厂家不同规格酮洛芬缓释胶囊的空白胶囊溶液,与溶出度测定时溶出杯中浓度一致。在200~800 nm的波长范围内扫描,可见各空白胶囊壳在测定波长处无明显吸收,不干扰测定。

图1 紫外吸收图谱Fig 1 The absorption spectrum of UV
2.3 标准曲线制备 取酮洛芬对照品适量,精密称定,加2.1项下使用的释放介质溶解并制成每1 mL中约含75μg(75 mg,溶出介质为1 000 mL)或100μg(0.1 g,溶出介质为1 000 mL)或200μg(0.2 g,溶出介质为1 000 mL)的溶液作为对照品溶液。取上述溶液,照紫外-可见分光光度法(中国药典2010年版二部附录IVA),在258 nm或260 nm波长处测定吸收度A,求得各标准对应的线性方程(Y=bX+a;Y:累积释放百分数,X:吸收度)的系数a,b值,见表1。

表1 6个通道的线性方程系数的a,b值Tab 1 The value of a and b for 6 channels linear equation coefficients
3 结果
3.1 不同厂家同一规格酮洛芬缓释胶囊的释放度结果 本文对收集到的3个厂家同一规格(0.2 g)的酮洛芬缓释胶囊的实时释放度进行了监测,见图2。
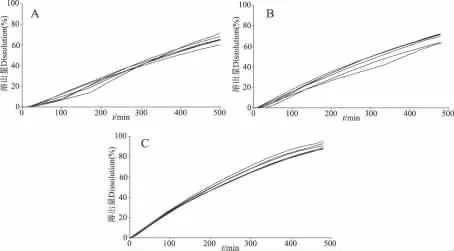
图2 不同厂家相同规格样品释放曲线Fig 2 The release curve lines of the samples of different manufacturers
由于B厂该品种系由A厂转让,两者的处方、工艺基本相同,故两者释放行为极为相似。A、B厂样品的释放曲线均在初始时略有延迟,然后才开始释放。且某些曲线出现转折,系实验中颗粒间黏连,导致释放速度减缓,随后颗粒逐渐分离,释放速度随之上升所致。另外A、B厂同一批次6粒样品的释放曲线有一定差异,提示其批内质量稳定性仍需进一步优化。C厂样品的释放量随时间延长逐渐增加,且6粒样品的释放行为接近。
将酮洛芬缓释胶囊的累积释放百分率对时间分别按零级、一级和Higuchi方程拟合,确认两者产品的释放行为符合零级动力学(r=0.997 9;r=0.997 8)。厂家C产品累积释放百分率对时间的拟合结果表明,其释放行为符合一级动力学(r=0.9914)。C厂产品释放行为与A、B厂差异较大,应与其处方中缓释材料种类与组成不同有关。
根据实测的释放度数据计算溶出参数,结果见表2,仅C厂产品能符合USP34的相关规定;而A、B厂的产品在各时间点释放量均低于USP34的相关规定。

表2 光纤溶出度仪实测酮洛芬缓释胶囊的体外释放参数Tab 2 The release parameters of FODT measured ketoprofen sustained-release capsules
3.2 同一厂家不同规格酮洛芬缓释胶囊的释放度结果 B厂样品规格有75 mg、0.1 g及0.2 g3个规格,故对该厂家不同规格的样品进行了释放度考察和比较,结果见图3。由结果可见,规格越小,释放越快,但最终的累积释放百分数相差不大。
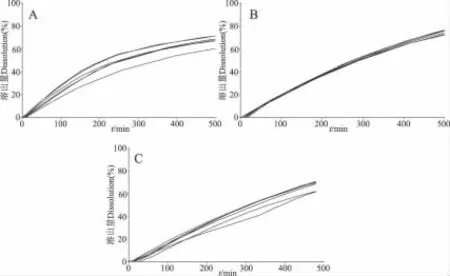
图3 不同规格样品释放曲线(厂家B)Fig 3 The release curve lines of different specifications of the sample(manufacturer B)
3.3 2种测定方法的比较 为验证本法与紫外对照品法的一致性,在采用光纤溶出度仪在线监测的同时,于最后1个采样时间点,测定样品的吸收值,采用紫外对照品法计算样品的累积释放度。结果见表3,光纤药物溶出度法与紫外对照品法测定的结果无显著差异。
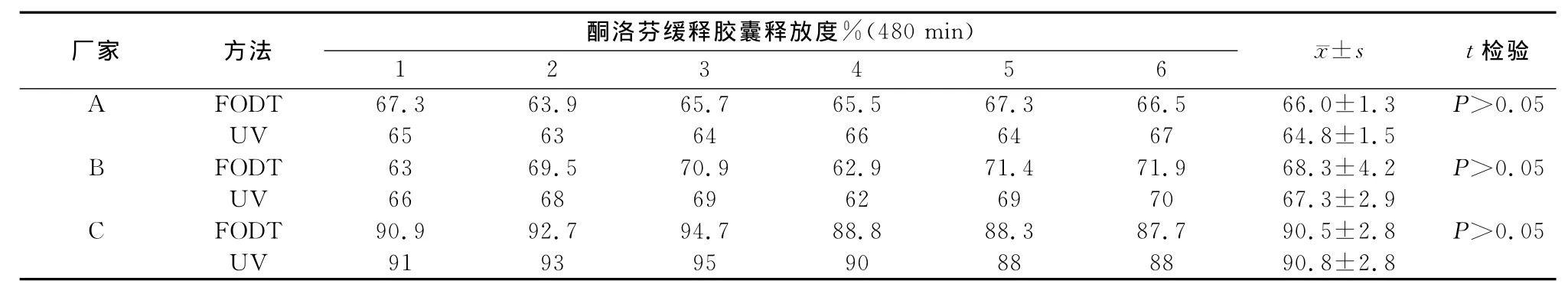
表3 酮洛芬缓释胶囊FODT法与紫外对照品法的累积释放度比较(%)Tab 3 Comparison of cumulative release rate in FODT method and UV reference method(%)
4 讨论
由本实验结果可见,不同厂家同一规格的药物释放行为有所差异,相同厂家不同规格药物的释放行为也有所不同,可以推测生产酮洛芬缓释胶囊的制剂工艺存在差异。且部分厂家同一批药物存在不均一性,提示生产厂家应注意生产工艺的稳定性与可控性。
FODT法与传统紫外法相比优势明显。传统紫外法需在规定的时间点抽取一定体积的样品溶液,必要时须经过滤、稀释后测定吸光度,经计算得到结果。此过程繁杂,容易引入人为操作误差。而FODT法简便易行,它可以原位、连续监测药物的体外溶出行为,溶液无需过滤、稀释等操作,极大地降低了劳动强度,提高了分析检测的准确性和精密度。且FODT法可以完整地绘制产品精细溶出曲线,增加了信息量,T50、Td等参数可直接提取,无需复杂的参数计算,且计算机技术的应用,可以很方便地计算出评价溶出曲线一致性的f2因子,极大地提高了工作效率,对评价药物的体外溶出行为提供了有力手段[3-7]。
[1]陈琰,晋红,范国荣,等.酮洛芬的制剂研究[J].药学进展,2001,5(4):219-223.
[2]王汝兴,张宇丽,陈大为.酮洛芬渗透泵型控释片的体外释放与犬体内吸收的相关性[J].中国医药工业杂志,2006,37(2):95-98.
[3]孔爱英,谢沐风,郭长君,等.卡马西平片溶出度方法比较以及溶出曲线评价方法的探讨[J].中国药事,2011,25(2):162-165.
[4]王绯,任重远,周怡.辛伐他汀片的实时溶出度对比分析研究[J].药物分析杂志,2008,28(3):506-510.
[5]李新霞,陈坚.光纤药物溶出度过程分析仪的应用[J].中国医药工业杂志,2011,2(1):70-72.
[6]王宝全,刘忠良,赵庆华.光纤药物溶出度实时测定仪监测氢氯噻嗪片的溶出度[J].药物分析杂志,2011,31(4):796-798.
[7]蔡梅,袁静楠,蔡美明,等.用光纤药物溶出仪对萘哌地尔片溶出度的考察[J].药物分析杂志,2009,29(6):944-946.
