兔胫骨骨膜下注射转化生长因子(TGF)β1和β2促进骨膜生发层细胞增殖的研究
2012-12-31荆立忠跃林郭秦炜张继英
荆立忠 胡 跃林 郭秦炜 张继英
(北京大学第三医院运动医学研究所,北京 100191)
骨膜由纤维层和生发层两部分构成,生发层含有大量干细胞,在特定环境下可分化为软骨细胞。骨膜移植作为修复软骨缺损的常见术式之一已有多年历史[1,2],其主要优点在于操作简单、可以整体移植等。但随着年龄的增长,骨膜生发层厚度及干细胞数量会逐渐减少[3],是导致骨膜移植修复软骨损伤效果不佳的原因之一。促进骨膜生发层干细胞的增殖,增强其成软骨能力,成为移植前要解决的重要问题。大量实验已证实,转化生长因子(transforming growth factor,TGF)β具有促进干细胞增殖、调节细胞分化等作用。在骨膜移植前通过微量注射器局部注射TGF以促进骨膜生发层细胞增殖具有微创、作用直接等优点。本实验通过比较单次注射TGFβ1或TGFβ2对骨膜生发层细胞增殖效应的异同,初步探讨促进骨膜生发层细胞增殖的可行性及规律,以期提高成年动物骨膜生发层细胞的成软骨能力。
1 材料与方法
1.1 实验动物和材料
4月龄的成年新西兰大白兔22只,(3.0±0.5)kg,雌雄不限(北京大学医学部实验动物科学部提供,许可证编号:SCXK京2011-0008)。
实验材料:Hamilton微量注射器(容量10μl,针头30 gauge)为瑞士Hamilton公司生产;TGFβ1与TGFβ2为美国 Peprotech公司生产(catalog:100-21;100-35)。
1.2 方法
1.2.1 实验设计与操作 沿兔耳缘静脉缓慢推注20%乌拉坦全身麻醉,术前肌注1 ml氯胺酮。以胫骨结节最高点为骨性标志,在其内侧5 mm处做一5 mm的纵行皮肤切口,勿伤及深层组织,使用微量注射器于胫骨结节最高点内侧5 mm注射一针,于第一针以远5 mm处注射第二针(图1)。将大白兔分为3组:①对照组,于两位置分别注射10μl Tris溶液(Tris pH=8.0,Sigma公司);②TGFβ1 实验组:于两位置分别注射20 ng(10 μl)TGFβ1;③TGFβ2实验组:于两位置分别注射20 ng(10μl)TGFβ2。

图1 示注射部位
2个实验组各8只兔,对照组6只,每组两侧胫骨均纳入操作。TGFβ1组:首先对全部8只兔的左侧胫骨进行注射操作,于第3天对其中4只右侧胫骨进行注射操作,第5天处死,从而得到3天、5天两个时间点的标本;于第4天对另外4只右侧胫骨进行注射操作,第10天处死,从而得到7天、10天两个时间点的标本。对照组和TGFβ2组操作与TGFβ1组相同,只是对照组每次3只。大体观察后取胫骨近端附带骨膜的骨皮质标本做组织学切片(每块标本包含2个注射点),这样实验组的每个时间点即可获得8个观察数据,对照组为6个。
1.2.2 大体观察 术后第3天、5天、7天、10天将全部兔通过注射过量乌拉坦处死,分离胫骨近端内侧骨膜表面深筋膜等软组织,大体观察各组注射位置骨膜的增生、肿胀情况。
1.2.3 标本的处理 用骨刀切取胫骨近端附带骨膜的骨皮质标本(包含2个注射点),面积约10 mm×10 mm,修切整齐,立即浸入4%多聚甲醛固定24小时,生理盐水冲洗,然后放入10%甲酸脱钙液脱钙5~7天,将标本切成两块(每块包含1个注射点),石蜡包埋后切片,厚度5μm。
1.2.4 组织化学染色及显微镜下观察 将各组标本切片脱蜡,进行HE染色。应用Image-Pro PLUS医学图像分析系统对标本进行成像,低倍镜放大200倍,测量生发层厚度(μm)、计算细胞密度(×104/cm2);高倍镜放大400倍,观察细胞大体形态。为保证结果可靠,测量3次取平均值。
1.2.5 统计学方法 采用SPSS16.0统计学软件进行数据处理。数据以±s表示,多组之间采用单因素方差分析检验进行比较,两两之间比较采用LSD。P<0.05表示差异有显著性意义。
2 结果
大体观察各组注射部位,与外周相比,2个实验组5天、7天时间点的注射部位略显肿胀,间或见注射器刺激骨膜后形成的微血管网。2个实验组3天、10天及对照组仅可见微血管网,无明显肿胀。各组骨膜注射部位表面均有光泽。
低倍镜下观察,骨膜分为两层:浅层纤维层胶原纤维排列紧密,细胞呈长梭形,细胞数量少;深层(即生发层)细胞呈圆形或椭圆形,细胞数量相对较多。
各组不同时点生发层厚度比较(表1):对照组注射后各时点差异无显著性(P>0.05);TGFβ1组和TGFβ2组注射后第5天生发层厚度较第3天明显增加,最大厚度均出现在注射后第7天(P<0.05),注射后第10天与第3天差异无显著性(P>0.05)。3组间生发层厚度比较(表 1):注射后第3天、第10天差异无显著性(P>0.05);注射后第5天、第7天TGFβ1和 TGFβ2组均明显高于对照组,且注射后第5天TGFβ2组厚度明显大于TGFβ1组(P=0.017)。细胞密度比较(表 1):3组注射后不同时点以及3组间差异均无显著性(P>0.05)。

表1 注射TGFβ1和TGFβ2后不同时间段生发层厚度、细胞密度的比较
高倍镜下观察,对照组(图2a)生发层细胞核呈椭圆形,蓝色深染,细胞数较少。TGFβ1组注射第3天(图2b)、第10天(图2e)与对照组生发层细胞形态类似,第7天(图2d)骨膜生发层细胞增殖显著,胞核增大呈圆形或椭圆形,蓝色深染,胞浆基质丰富,细胞数目多。TGFβ2组第3天(图2 f)、第10天(图2i)生发层细胞形态与 TGFβ1组第3天(图2b)、第10天(图2e)类似,第5天(图2g)与第7天(图2h)细胞形态与 TGFβ1第7天(图2d)类似。
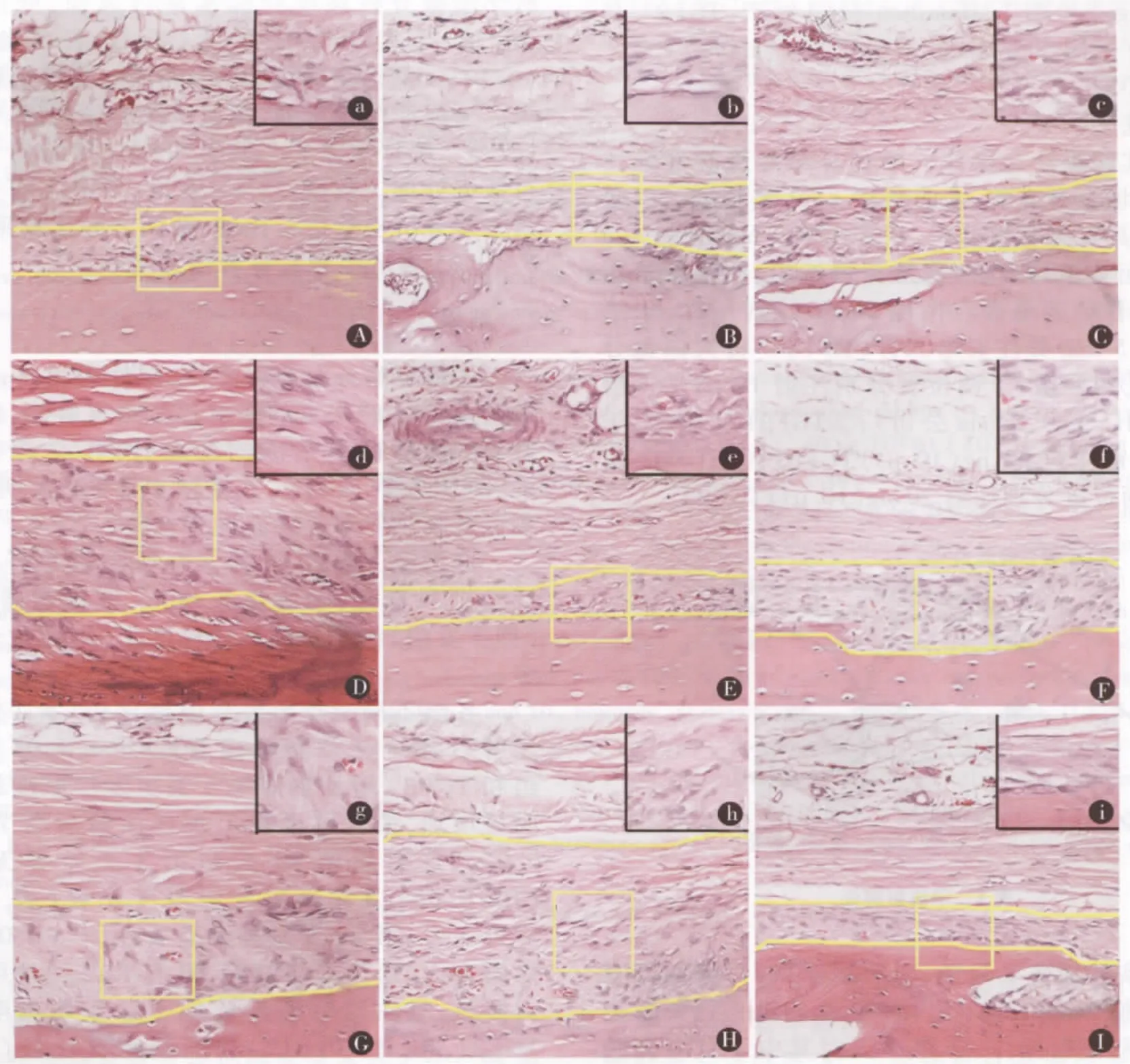
图2 注射TGFβ后不同时间点骨膜HE染色 A为空白对照组(×200);B~E分别为注射TGFβ1后第3天、5天、7天、10天组(×200);F~I分别为注射 TGFβ2后3天、5天、7天、10天组(×200);右上角 a~i分别为放大400倍图像
3 讨论
关节软骨缺损的修复一直是运动医学及骨关节外科研究的难点及重点。利用骨髓、脂肪组织等来源的干细胞修复软骨损伤的实验室研究显示了较满意的结果,但由于需进行体外培养、二次手术与污染风险等因素限制了其在临床上的应用。将骨膜应用于各种软骨缺损的修复已有多年历史[1,2]。其主要优点在于可以整体移植,同时包含干细胞和各种细胞因子,无需体外培养,从而更加简单易行。骨膜生发层干细胞在一定条件下可以分化为软骨细胞,但随年龄增长,其增殖分化潜能会逐渐下降[3]。因此,对于成年患者,其自身骨膜很难在细胞数量及密度上达到移植的标准[4],这就有必要提高骨膜生发层干细胞的数量,从而提高骨膜的软骨修复能力。近年大量实验研究探讨了不同细胞因子对细胞增殖分化的影响,并且证实TGFβ具有促进细胞增殖、调节细胞分化等作用[5,6]。
本实验证实,单次注射TGFβ时细胞的增殖是短暂的、一过性的。这一结论与Reinholz等[7]的研究类似。Reinholz等观察到向成年大白兔胫骨骨膜下单次注射TGFβ1后可以刺激骨膜生发层细胞增殖。其最大效应出现在注射后第7天,表现为生发层厚度最大,细胞数目最多。不同之处在于本实验第3天实验组与对照组相比虽略有增加,但并无明显差异。此外,本研究2个实验组注射后10天与对照组也无明显差别。这就进一步提示干预后间隔时间的长短将影响到骨膜生发层的增殖,时间过长或过短均达不到理想的效果。单次注射不同于连续注射,后者往往可以诱导软骨细胞生成[8,9],但也容易导致骨组织的生成[8],因此并不利于软骨缺损的修复。本研究表明,在TGF的干预下,骨膜生发层细胞(包括干细胞)会出现一过性增殖。在此时间段上,如果将TGF诱导的骨膜移植到关节内,保持持续性的刺激及适宜的微环境,则可能促进骨膜生发层细胞进一步向软骨分化。
不同TGFβ亚型对不同的细胞或组织效应各异[8]。本实验比较了骨膜下单次注射 TGFβ1和TGFβ2后对生发层细胞增殖效应的异同。结果显示单次注射两者后生发层细胞数量均会一过性增加,并且TGFβ2对生发层细胞的增殖效应更为明显。多数研究是通过幼年动物[8,9]或体外[10]进行的,结果虽然也证明两者可以促进生发层细胞的增殖和分化,并且TGFβ2诱导软骨细胞分化的能力强于 TGFβ1,但成年动物体内 TGFβ1和TGFβ2 促生发层细胞增殖效应的异同尚无研究报道。本实验中TGFβ2的促增殖效应之所以相对较好,原因可能在于 TGFβ2可以诱导合成TGFβ1[8],两者共同作用于生发层细胞产生协同效应,从而导致更为明显的增殖效应。Pombo-Suarez等[11]观察到在骨性关节炎患者的软骨细胞内,TGFβ1与TGFβ2的基因表达存在强烈的相关性,从而更进一步证实了这种可能性。
本文的不足之处在于没有对生发层细胞的性质做鉴定,毕竟生发层内包括成骨细胞、骨原细胞、成纤维细胞、纤维细胞等较多的细胞成分。因此,注射TGFβ后增殖细胞的性质,还有待于通过流式细胞技术对其细胞表面标志物如 CD90、CD105 等[12,13]进行进一步的验证。此外,本实验虽然初步确定了注射TGFβ后生发层细胞增殖的时间窗,观察到注射后时间过短或过长增殖效应均不明显,但对于注射生长因子更长时间后生发层细胞的变化还有待于进一步研究。
1 Emans PJ,Surtel DA,Frings EJ,et al.In vivo generation of cartilage from periosteum.Tissue Eng,2005,11(3 -4):369 -377.
2 O’Driscoll SW,Fitzsimmons JS.The role of periosteum in cartilage repair.Clin Orthop Relat Res,2001,391(Suppl):S190-S207.
3 O’Driscoll SW,Saris DB,Ito Y,et al.The chondrogenic potential of periosteum decreases with age.JOrthop Res,2001,19(1):95 -103.
4 Jansen EJ,Emans PJ,Guldemond NA,et al.Human periosteumderived cells from elderly patients as a source for cartilage tissue engineering?JTissue EngRegen Med,2008,2(6):331 -339.
5 Mara CS,Sartori AR,Duarte AS,et al.Periosteum as a source of mesenchymal stem cells:the effects of TGF-beta3 on chondrogenesis.Clinics(Sao Paulo),2011,66(3):487 -492.
6 Olivos-Meza A,Fitzsimmons JS,Casper ME,et al.Pretreatment of periosteum with TGF-beta1 in situ enhances the quality of osteochondral tissue regenerated from transplanted periosteal grafts in adult rabbits.Osteoarthritis Cartilage,2010,18(9):1183 -1191.
7 Reinholz GG,Fitzsimmons JS,Casper ME,et al.Rejuvenation of periosteal chondrogenesis using local growth factor injection.Osteoarthritis Cartilage,2009,17:723 -734.
8 Joyce ME,Roberts AB,Sporn MB,et al.Transforming growth factorbeta and the initiation of chondrogenesis and osteogenesis in the rat femur.JCell Biol,1990,110(6):2195 -2207.
9 Critchlow MA,Bland YS,Ashhurst DE.The effects of age on the response of rabbit periosteal osteoprogenitor cells to exogenous transforming growth factor-beta 2.J Cell Sci,1994,107(Pt 2):499-516.
10 Barry F,Boynton RE,Liu B,et al.Chondrogenic differentiation of mesenchymal stem cells from bone marrow:differentiation-dependent gene expression of matrix components.Exp Cell Res,2001,268(2):189-200.
11 Pombo-Suarez M,Castano-Oreja MT,Calaza M,et al.Differential upregulation of the three transforming growth factor beta isoforms in human osteoarthritic cartilage.Ann Rheum Dis,2009,68(4):568 -571.
12 Csaki C,Matis U,Mobasheri A,et al.Chondrogenesis,osteogenesis and adipogenesis of canine mesenchymal stem cells:a biochemical,morphological and ultrastructural study.Histochem Cell Biol,2007,128(6):507-520.
13 Adesida AB,Mulet-Sierra A,Jomha NM.Hypoxiamediated isolation and expansion enhances the chondrogenic capacity of bone marrow mesenchymal stromal cells.Stem Cell Res Ther,2012,3(2):9 -20.
