新型杀虫晶体蛋白Cry7Ab4空间结构的计算机解析
2012-12-27洪雪梅林毅
洪雪梅,林毅
(1.华侨大学 信息科学与工程学院,福建 厦门 361021;2.华侨大学 化工学院,福建 厦门 361021)
新型杀虫晶体蛋白Cry7Ab4空间结构的计算机解析
洪雪梅1,林毅2
(1.华侨大学 信息科学与工程学院,福建 厦门 361021;2.华侨大学 化工学院,福建 厦门 361021)
采用一级结构分析,二级结构预测及同源比对建模的方法,模拟出新型杀虫晶体蛋白Cry7Ab4的空间结构,并进行动力学优化.结合其杀大猿叶甲活性数据与蛋白结构比对分析,发现Cry7Ab4与Cry7Aa1的活性差异主要归因于α3,α4上疏水性氨基酸的不同.
苏云金芽孢杆菌;杀虫晶体蛋白;Cry7Ab4;空间结构;构效关系
苏云金芽孢杆菌(Bacillus thuringiensis,Bt)伴孢晶体蛋白Cry7在对鳞翅目、鞘翅目和直翅目等害虫的生物防治方面有着广阔的前景.如Cry7Aa杀马铃薯甲虫(Leptinotarsa decemlineata),其半数致死浓度(LC50)为13.1μg·mL-1[1];Cry7Ba1杀小菜蛾(Plutella xylostella),3d的 LC50值为0.095 7μg·mL-1;Cry7Ca1杀蝗虫,72h的LC50值为3.19μg·mL-1[2].Cry7基因杀虫活性高,但Cry7Ab4对鳞翅目的小菜蛾、甜菜夜蛾(Spadoptera exigua)、亚洲玉米螟(Ostrinia furnacalis)、马铃薯甲虫(Leptinotarsa decemlineata)、榆蓝叶甲(Pyrrhalta aenescens)和直翅目的东亚飞蝗(Oroental migratory locust)基本无杀虫活性,仅对鞘翅目的大猿叶甲(Colaphellus bowvingi Baly)有杀虫活性,其LC50值为293.79μg·mL-1[3].未做酶解的蛋白基本无杀虫活性,有活性的只有trypsin酶解的蛋白.在Cry7Ca基因也有相似情况:酶解蛋白72h的LC50值为3.19μg·mL-1,而未酶解蛋白72h的LC50值为9.4μg·mL-1,酶解蛋白比未酶解蛋白活性高了3倍[2].因此,解析Cry7蛋白的空间结构,探讨构效关系,具有重大意义.Cry7Ab4是从苏云金芽孢杆菌HQ40中克隆的一个新基因(登录号为EU380678),其编码产物的蛋白酶解液对鞘翅目的大猿叶甲有杀虫活性,其LC50值为293.79μg·mL-1[3].为探讨其构效关系,本研究采用同源建模并经动力学优化获得了Cry7Ab4的空间结构,通过与Cry7Aa1的比较分析,发现其对大猿叶甲的活性差异主要归因于α3,α4上疏水性氨基酸的不同.
1 材料与方法
1.1 材料
供试蛋白质(Cry7Ab4)序列为文献[3]实验筛选测序获得的.
1.2 分析方法
蛋白质二级结构的预测采用PHD(http:∥www.embl2.heidelberg.de/predict.protein/p-redictpro2tein.html),利用protparam(http:∥au.expasy.org/tools/protparam.html)进行蛋白质理化性质的预测,利用SWISS-MODEL服务器(http:∥www.expasy.org/swiss-mod/-SWISS-MODEL.html)进行同源建模.SMART服务器(http:∥smart.embl-heidelberg.de/)进行对结构域分析,包括3个DOMAIN的位置.SeqFacts服务器(http:∥bip.weizmann.ac.il/sqfbin/seqfacts)CDD v2.10服务器(http:∥www.ncbi.nlm.n-ih.gov/Structure/cdd/cdd.shtml)可找出提交序列的保守区域.分子模型优化采用ICM软件.图片编辑采用可视化工具Chimera,Spdbv与Rasmol.BLAST(http:∥www.ncbi.nlm.nih.gov/blast/)进行序列比对,或利用Clustal X软件进行多序列比对.
2 结果与分析
2.1 杀虫晶体蛋白Cry7Ab4氨基酸序列分析
2.1.1 杀虫晶体蛋白Cry7Ab4氨基酸组成 将杀虫晶体蛋白Cry7Ab4的一级序列提交给Protparam服务器,可得到该蛋白(核心毒蛋白,已截去C端和N端的部分序列)的氨基酸组成,如图1所示.该蛋白含585个氨基酸,其中异亮氨(Ile)、亮氨酸(Leu)、丝氨酸(Ser)、酪氨酸(Tyr)的比例(γ)最高,分别为7.52%,7.86%,8.03%,7.69%.该蛋白相对分子质量为66.79kDa,理论上的pI值为5.86,是弱酸性蛋白.
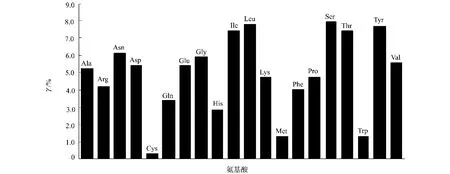
图1 杀虫蛋白Cry7Ab4核心毒蛋白的20种氨基酸组成Fig.1 Amino acids composition of core toxic protein of Cry7Ab4
2.1.2 杀虫晶体蛋白Cry7Ab4二级结构预测 采用PHD程序对杀虫晶体蛋白Cry7Ab4二级结构进行预测.结果表明,在该蛋白中各二级结构元件的摩尔分数:α-螺旋(177AA)为27.96%,延伸链(144AA)为22.75%,随机卷曲(312AA)为49.29%.在含585个氨基酸残基的Cry7Ab4蛋白中,大概存在7个较长的α-螺旋区域,这些区域(约30~260)主要分布在该蛋白的N-端,其后区域则为β-折叠和无规则卷曲,β-折叠相对较对较密地分布在C-端.
2.1.3 杀虫晶体蛋白Cry7Ab4的结构域及功能位点 采用SMART(正常形式)用于发现和注释遗传可移动蛋白多肽中的结构域(domain)及分析结构域(domain)的体系结构,结果如图2所示.

图2 杀虫蛋白Cry7Ab4的结构域信息Fig.2 Information of Cry7Ab4domains
根据已知的几种杀虫晶体蛋白的结构,提出如下列推测.Cry蛋白DomainⅠ的长疏水和亲水脂螺旋可能参与中肠上皮溶细胞孔洞的形成;DomainⅡ的3个β-折叠顶部暴露在表面的环结构,由于与免疫球蛋白抗原结合位点相似,其中可能含有毒素结合到昆虫中肠刷状缘膜上特异性受体的决定性因子,参与起始与受体结合.定点诱变与片段互换研究都支持这一推断[4];DomainⅢ的β-“三明治”结构具有多种功能,在毒素分子的生物化学上,可以维持毒素分子三维结构的完整[5],毒素与受体的相互作用导致形成孔洞.研究表明:β-“三明治”结构能够参与受体结合[6]、膜穿透[7]和离子通道功能[8].
2.2 杀虫晶体蛋白Cry7Ab4空间结构的同源建模及优化
将杀虫晶体蛋白Cry7Ab4序列提交到Swiss Model服务器,在Tools中的Template Identification中寻找到具有晶体结构的模板,发现其同源性最高为40%,PDB的ID号1dlcA(insecticidal crystal protein Cry2Aa).将杀虫晶体蛋白Cry7Ab4与模板1dlcA_B2的氨基酸序列比对,由于同源性较低,在进行同源建模时可采用比对建模,其模板为1dlcA.提交杀虫晶体蛋白Cry7Ab4与模板1dlcA的氨基酸序列比对结果到Swiss-Model服务器,进行自动建模,同源模建返回的初始结构在ICM可视化.
对同源模建的Cry7Ab4初始三维结构进行结构优化和动力学模拟,先用最陡下降法 (steepest descent)在CVFF(consistent-valence forcefield)力场下进行100步的结构松弛计算,接着采用200步的共轭梯度法(conjugate gradient)进行结构优化,最终把Ramachadran Plot得分控制在92%以上,得到一个比较可靠的三维结构图,如图3所示.
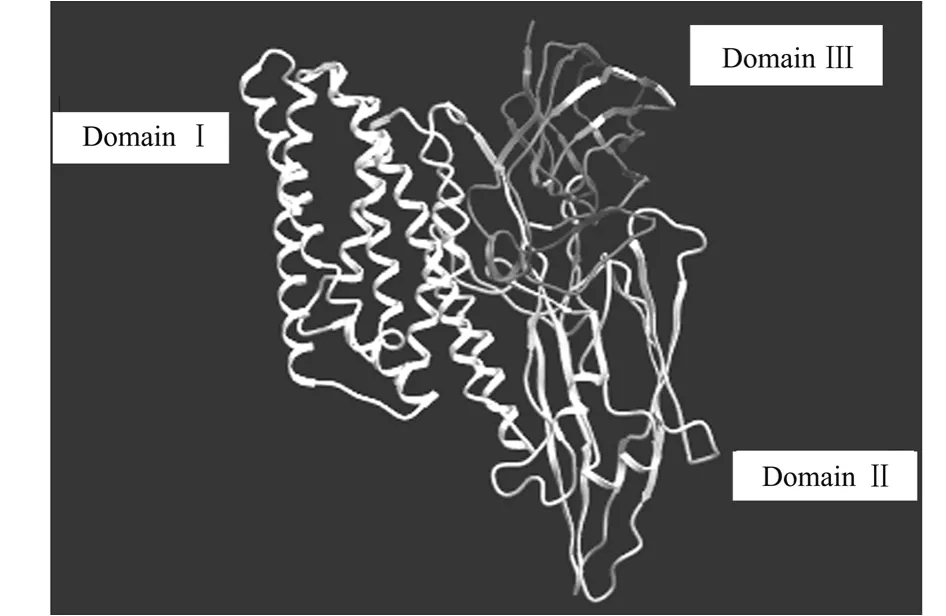
图3 同源模建修正后Cry7Ab4三维结构Fig.3 Tertiary structure of Cry7Ab4 modified by homologous modeling
2.3 Cry7Ab4与Cry7Aa1的结构差异
目前已发现的Cry7A类基因共6种,其中Cry7Ab基因共5种.在这些已发现的Cry7A类基因中,杀虫活性生测比较多的是Cry7Aa1,它对马铃薯甲虫有较强的杀虫活性,其他蛋白杀虫活性未见报道.通过序列比对(图4),Cry7Ab4与Cry7Aa1的同源性为93.84%,部分差异氨基酸如表1所示.

图4 杀虫晶体蛋白Cry7Ab4与Cry7Aa1多序列比对结果Fig.4 Alignment of the amino acid sequence between Cry7Ab4and Cry7Aa1toxins
由表1可知:杀虫晶体蛋白Cry7Ab4与Cry7Aa1主要氨基酸差异多处位于结构域Ⅰ,共有41个氨基酸差异,Cry7Ab4蛋白有17个亲水性氨基酸,占差异氨基酸总数的41.46%,Cry7Ab1蛋白有21个亲水性氨基酸,占差异氨基酸总数的51.22%.Cry7Ab4中亲水性氨基酸明显低于Cry7Aa1,低了9.7个百分点.

表1 Cry7Ab4与Cry7Aa1空间结构上对应的氨基酸差异Tab.1 Amino acid difference between Cry7Ab4and Cry7Aa1in single domains
在这两个模型中的共同点是结构域Ⅰ与蛋白在害虫细胞膜上的钻孔活动有关,α5,α6和顶部的环状结构为疏水性氨基酸与钻孔有关,其他部分为亲水性氨基酸,位于周围液态环境中,促进钻孔后与细胞膜的结合稳定性.这部分的氨基酸亲水性越强,杀虫晶体蛋白与细胞膜的结合越稳定,所以杀虫活性相对也就强.
比较Cry7Ab4与Cry7Ab1的空间结构时,发现它们之间的氨基酸差异主要分布在α3,α4两个亲水性螺旋上,如图5所示.在本研究中,可以发现Cry7Ab4的杀虫活性(LC50)为293.79μg·mL-1,而Cry7Ab1的杀虫活性(LC50)为 13.1μg·mL-1,Cry7Ab1的杀虫活性高于Cry7Ab4,其原因可能与这部分氨基酸的亲水性有关.
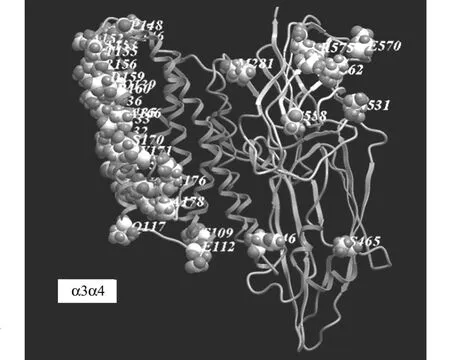
图5 差异氨基酸在Cry7Ab4中的分布图Fig.5 Distribution of the diversity amino acids in Cry7Ab4
3 讨论
杀虫活性模型有两个,一是“umbrella”模型,Cry蛋白DomainⅠ的疏水α4,α5螺旋形成发夹结构起始孔洞的形成.1997年,Schwartz等[9]在 Cry1Ab蛋白 DomainⅠ和DomainⅠ与DomainⅡ之间引入二硫键限制分子内运动.研究结果表明:α4,α5螺旋的发夹结构插入上皮膜,DomainⅠ的其他部分以“伞状”平铺于膜表面.1999年,Yaoi等[10]分析了 Cry1Aa蛋白与家蚕(Bombyx mori)氨肽酶(Aminopeptidase N,APN)的结合区,证明是位于DomainⅠ的135-Ile和198-Pro之间,也就是α4,α5螺旋.Masson等[11]研究了Cry1Aa蛋白DomainI的α4螺旋的各位点突变对小菜蛾(Plutella xylostella)结合的影响,发现α4螺旋带电荷的Asp-136是维持Cry1Aa对小菜蛾毒性最重要的位点.2000年,Gerber等[12]进一步诱变Cry1Ac DomainⅠ的α4,α5螺旋间的loop,也证明α4,α5螺旋与孔洞形成有关.
另一个模型是1990年Hodgman和Ellar[13]提出的“铅笔刀”模型.疏水α5,α6加上顶部的环状结构,打开成“铅笔刀”形式插入上皮膜,其余部分在膜或受体表面.目前这个模型的证据较少.这两个模型都表明杀虫晶体蛋白空间结构上的αα螺旋是非常关键的区域.
本研究通过系统的分析发现,Cry7Ab4与Cry7Ab1之间的氨基酸差异主要分布在α3,α4两个亲水性螺旋上,据此推测其杀虫活性差异主要归因于α3,α4螺旋的亲水性差异.研究结果与上述两个模型所揭示的αα螺旋是Cry蛋白上极其关键的区域的事实相吻合.今后可围绕Cry7Ab蛋白的的αα螺旋区域,实施随机和定点突变,进一步深入探讨其构效关系.
[1]LAMBERT B,THEUNIS W,AGUDA R,et al.Nucleotide sequence of gene cryⅢDencoding a novel coleopteranactive crystal protein from strain BTI109Pof Bacillus thuringiensis subsp.kurstaki[J].Gene,1992,110(1):131-132.
[2]SONG L,GAO M,DAI S,et al.Specific activity of a Bacillus thuringiensis strain against Locusta migratoria manilensis[J].J Invertebr Pathol,2008,98(2):169-176.
[3]邓淑,束长龙,林毅,等.新型Cry7Ab基因的鉴定、克隆、表达与杀虫活性[J].农业生物技术学报,2009,5:908-913.
[4]SCHNEPF E,CRICKMORE N,VAN RIE J L,et al.Bacillus thuringiensis and its pesticidal crystal protein[J].Microbiol and Molecular Biology Review,1998,62(3):775-806.
[5]LI J,CARROLL J,ELLAR D J.Crystal structure of insecticideδ-endotoxin from Bacillus thuringiensis at 2.5Å resolution[J].Nature,1991,353:815-821.
[6]CHOE S,BENNETT M J,FUJII G,et al.The crystal structure of diphtheria toxin[J].Nature,1992,357:216-222.
[7]OJCIUS D M,YOUNG J D E.Cytolytic pore-forming proteins and peptides:Is there a common structural motif?[J].Trends in Biochemical Sciences,1991,16(6):225-229.
[8]YOOL A J.Block of the inactivating potassium channel by clofilium and hydroxylamine depends on the sequence of the pore region[J].Molecular Pharmacology,1994,46(5):970-976.
[9]SCHWARTZ J L,JUTEAU M,GROCHULSKI P,et al.Restriction of intramolecular movements within the Cry1Aa toxin molecule of Bacillus thuringiensis through disulfide bond engineering[J].FEBS Letters,1997,410(2/3):397-402.
[10]YAOI K,NAKANISHI K,KADOTANI T,et al.Bacillus thuringiensis Cry1Aa toxin-binding region of Bombyx mori aminopeptidase N[J].FEBS Letters,1999,463(3):221-224.
[11]MASSON L,MAZZA A,GRINGORTEN L,et al.Specificity domain localization of Bacillus thuringiensis insecticidal toxins is highly dependent on the bioassay system[J].Molecular Microbiology,1994,14(5):851-860.
[12]GERBER D,SHAI Y.Insertion and organization within membranes of theδ-endotoxin pore-forming domain,helix 4-loop-helix 5,and inhibition of its activity by a mutant helix 4peptide[J].The Journal of Biological Chemistry,2000,275(31):23602-23607.
[13]HODGMAN T C,ELLAR D J.Models for the structure and function of the Bacillus thuringiensisδ-endotoxins determined by compilational analysis[J].DNA Sequence,1990,1(2):97-106.
Structural Analysis of a Novel Insecticidal Crystal Protein Cry7Ab4
HONG Xue-mei1,LIN Yi2
(1.College of Information Science and Engineering,Huaqiao University,Xiamen 361021,China;2.College of Chemical Engineering,Huaqiao University,Xiamen 361021,China)
The initial spatial structure of a novel insecticidal crystal protein Cry7Ab4was constructed by primary structure analysis,secondary structure prediction and homologous alignment modeling,and then optimized by molecular mechanics method.In addition,the structural difference between Cry7Ab4and Cry7Ab1was compared by NCBI Blastp.It showed that the hydrophobic amino acids inα3,α4were responsible for their difference of insecticidal activities against Colaphellus bowringi.
Bacillus thuringiensis;insecticidal crystal protein;Cry7Ab4;spatial structure;structure-activity relationship
钱筠 英文审校:刘源岗)
Q 518.1;TP 311.1
A
1000-5013(2012)01-0060-05
2011-09-13
林毅(1976-),男,教授,主要从事伴孢晶体蛋白的基因克隆与信息学的研究.E-mail:lyhxm@hqu.edu.cn.
教育部科学技术研究重点项目(211205);福建省高等学校新世纪优秀人才支持计划项目(2006年度);福建省自然科学基金资助项目(2011J01221);植物病虫害生物学国家重点实验室开放基金资助项目(2007IP7)
