猕猴神经干细胞的诱导分化、干性维持及同种脑内移植
2012-12-25董锦润郭立云瞿家桂戚仁莉王文超肖春杰王正波
董锦润, 郭立云, 瞿家桂, 戚仁莉, 王文超, 肖春杰, 王正波,*
(1. 中国科学院生物物理研究所 脑与认知国家重点实验室, 北京 100101; 2. 中国科学院昆明动物研究所, 云南 昆明 650223; 3. 云南大学 生命科学院, 云南 昆明 650223; 4. 昆明医学院第四附属医院 眼科, 云南 昆明 650021; 5. 中国科学技术大学 生命科学学院, 安徽 合肥230026)
猕猴神经干细胞的诱导分化、干性维持及同种脑内移植
董锦润1,2,3,+, 郭立云4,+, 瞿家桂1,2,5, 戚仁莉1,2,5, 王文超1,2, 肖春杰3,*, 王正波1,2,*
(1. 中国科学院生物物理研究所 脑与认知国家重点实验室, 北京 100101; 2. 中国科学院昆明动物研究所, 云南 昆明 650223; 3. 云南大学 生命科学院, 云南 昆明 650223; 4. 昆明医学院第四附属医院 眼科, 云南 昆明 650021; 5. 中国科学技术大学 生命科学学院, 安徽 合肥230026)
为探索猕猴神经干细胞分化及特性维持, 推进神经干细胞临床应用研究, 该实验以绿色荧光蛋白(green fluorescence protein, GFP)为标记探讨猕猴胚胎干细胞向玫瑰花环(rosettes)结构神经干细胞的分化及其碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)和表皮生长因子(epidermal growth factor, EGF)的扩增培养。结果表明:1)建立了稳定高效的猕猴神经干细胞分化体系, 在该分化体系下, GFP标记猕猴胚胎干细胞在分化的第12天时, 95%以上的细胞分化为神经干细胞; 2)分化得到的Rosettes结构神经干细胞经bFGF/EGF扩增后, 能够较好地维持其Rosettes结构; 3)经bFGF/EGF扩增后的rosettes结构神经干细胞移植到猕猴脑内后能够较好的存活并向神经元分化,即bFGF/EGF扩增培养能较好地维持Rosettes结构的神经干细胞, 且移植到猕猴脑内的该细胞亦能够较好地存活并向神经元分化,该结果为神经干细胞应用于临床提供了基础理论依据。
猕猴;神经干细胞;玫瑰花环结构;碱性成纤维细胞生长因子;表皮生长因子
由于神经干细胞具有自我更新、多潜能分化(Gage, 2000)、迁移功能、良好的组织融合性(Amar et al, 2003)以及低免疫源性(Modo et al, 2003), 为许多难以治愈的神经系统疾病提供了新的治疗途径。神经干细胞分化技术的完善和人工诱导多潜能干细胞(induced pluripotent stem cells, IPS)方法的出现(Okita et al, 2007), 使细胞替代治疗神经系统疾病成为了研究热点。
体外培养条件下, 猕猴胚胎干细胞(embryonic stem cell, ESC)能够分化为神经前体细胞、神经元(Calhoun et al, 2003; Chen, 2003; Kuai, 2009)及胶质细胞(Chen, 2008);但是,随着对神经干细胞研究的深入, Pankratz et al (2007)发现在胚胎干细胞向神经干细胞分化时, 形成的玫瑰花环(rosettes)结构细胞,才是真正意义上的早期全能神经前体细胞,而胚胎干细胞来源的神经前体细胞的特性维持是该领域的研究热点和难点。
碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)是Gospodarowicz (1975)在1974年从牛脑中分离纯化出的一种多肽因子。bFGF在胚脑及成年脑中均有分泌, 是一种重要的有丝分裂原, 它能通过作用于细胞表面相应的受体促进神经干细胞的增殖和分化。表皮生长因子(epid-ermal growth factor, EGF)是Cohen(1962)首次在小鼠的颌下腺中发现的一种小分子蛋白, 也具有广泛的促丝裂增殖的作用。当前普遍采用bFGF和EGF进行扩增培养神经干细胞(Murphy et al, 1990; Studer et al, 1998), 而bFGF/EGF扩增是否影响干细胞特性存在争议(Du&Zhang, 2004; Elkabetz &Studer 2008; Hong et al, 2008; Koch et al, 2009)。
猕猴在遗传和生理上都优于啮齿类且与人类更为接近(Wolf et al, 2004), 所以,猕猴胚胎干细胞的神经分化可为探索人类胚胎发育过程中的神经发生提供参考, 同时可用于神经疾病药物筛选以及开展神经干细胞临床治疗的相关研究。Li et al (2005)将由猕猴胚胎干细胞分化得到的神经干细胞移植至大鼠脑内的研究,由于异种移植而存在种属差异性。因此, 本研究拟通过建立猕猴神经干细胞诱导分化体系, 探讨bFGF/EGF扩增能否维持神经干细胞Rosettes结构特性, 并在同物种猕猴上进行移植实验, 为神经干细胞移植更好的应用于临床提供基础理论依据。
1 材料及方法
1.1 猕猴胚胎干细胞培养
tauGFP-rESCs细胞系LYON-ES野生型(LYONES-WT)(Wianny et al, 2008)(法国里昂干细胞与脑科学研究所馈赠, 试验所用细胞传代至第8~20代)培养在丝裂霉素C(Sigma, 5 µg/mL, 2 h)处理的CF1小鼠饲养层(CF1-MEF, 购自ATCC)上, 其培养方法参照文献 Wianny et al (2008)的报道进行。培养基为80% Knockout DMEM(invitrogen)+20% Knockout serum replacement(KO-SR, invitrogen)+1% 非必需氨基酸(Gibco)+1% PSG(invitrogen)+0.1 mM β-巯基乙醇(sigma)+5 ng/mL bFGF(chemicon)。
1.2 GFP标记猕猴胚胎干细胞向神经干细胞分化
参照Pankratz et al(2007)的神经分化方法, 建立综合拟胚体(embryoid Body, EB)法和单层法的分化体系。将胚胎干细胞克隆通过手工挑选, 切割成1 000个细胞左右的细胞团块, 悬浮培养, 形成EB。悬浮培养基为:DMEM/F12(1:1, Gibco)、Neural basal medium(Gibco)、1×N2 supplement (Gibco)、2 mmol/L谷氨酰胺(Sigma)和50 U/mL 青−链霉素(Sigma)。将形成的EBs转移到经ECM(Sigma)处理成分限定的神经分化培养基(neural differentiation culture medium, NDCM)中继续培养。NDCM成分为:F12+ITS-x+2 µg/mL heparin+2 mmol/L glutamine (Sigma) +50 U/ mL 青−链霉素(Sigma)。
1.3 GFP标记猕猴神经干细胞扩增
手工挑选培养皿中Rosettes结构神经干细胞,按1:3经NDCM培养基添加20 ng/mL的bFGF/EGF扩增后维持培养。分化培养实验的传代方法同干细胞培养传代方法, 只是不添加bFGF/EGF。
1.4 神经干细胞的猕猴移植
两只成年(5 a)肢体残疾猕猴(由斗殴引起)由中国科学院昆明动物研究所实验动物中心提供, 用于神经干细胞移植实验。
实验猕猴术前24 h禁食, 适量饮水, 常规麻醉(10 mg/kg体重盐酸氯胺酮+20~30 mg/kg体重戊巴比妥钠+0.3 mg/kg体重阿托品)。待动物充分麻醉后行相关术前准备, 剃毛并常规消毒头皮后,由猴立体定位仪定位。采用30#汉密尔顿微量注射器, 将经过bFGF/EGF扩增后维持培养3代的5 µL(1×105个/ µL)神经干细胞移植到猕猴海马区。注射速度为0.5 µL/min, 停针1 min后, 缓慢退针。移植后每天肌注免疫抑制剂环孢霉素A(CSA)10 mg/kg。
1.5 免疫组织化学染色
贴壁培养的细胞用PBS洗涤2遍、4%多聚甲醛(Sigma)室温下固定20 min、0.4% Triton X-100 (Sigma)透膜15 min、PBS洗涤2遍; 加入5%的BSA室温下封闭1 h, 然后加入一抗4 ℃孵育过夜; 去掉一抗后, PBS冲洗3遍, 然后加入二抗室温下孵育1 h; PBS洗涤3次后用hochest33342标记细胞核。一抗包括:Nestin 鼠抗单克隆抗体(1:200; Chemicon)、βⅢ-tubulin 鼠抗单克隆抗体(1:200; Millipore)及神经胶质原纤维酸性蛋白(GFAP)鼠抗单克隆抗体(1:1 000; Chemicon)。
细胞移植2个月后, 麻醉猕猴(方法同前)。0.9%生理盐水经心脏灌流、4%多聚甲醛灌流固定、取脑; 4%多聚甲醛后固定3~4 d 经15%、20%、30%梯度蔗糖脱水; LeicaCM1850冰冻切片机冰冻切片;免疫组织化学染色, 方法同细胞免疫组化染色。一抗为βⅢ-tubulin 鼠抗单克隆抗体(1:50; Millipore)
细胞免疫组化和脑片组化结果均在共聚焦显微镜下(Zeiss, LSM 510 META)检测。
2 结 果
在该实验分化体系下, Lyon-ES在分化第12天时, 95%以上的细胞为神经干细胞, 细胞排列具有典型的玫瑰花型结构(图1A, B, E, F)。细胞免疫组化实验结果表明, 几乎所有的细胞都呈现为神经干细胞蛋白标记物Nestin(图1B)和Pax6(图1F)阳性。
分化得到的Rosettes结构神经干细胞经手工挑选后贴壁培养, 若同时添加bFGF/EGF, 可维持其Rosettes结构2个月(图2, 三角符号所示), 90%以上的细胞保持不分化特性(图3);若不添加bFGF/EGF培养, 部分细胞将开始分化(图4)。经细胞组织化学实验, Rosettes结构神经干细胞在分化第21天时, 大量细胞表达神经元蛋白标记物β -tublin-Ⅲ(图5B), 在分化第56天时, 大多数细胞表达神经胶质细胞蛋白标记物GFAP(图5F)。
将经bFGF/EGF扩增后的Rosettes结构神经干细胞移植到两只猕猴海马后两个月, 发现移植细胞能够较好的在猕猴脑内存活(图4A), 且能够表达神经元蛋白标记物β-tublin-Ⅲ(图4B), 表明这些细胞已经分化为神经元。
3 讨 论
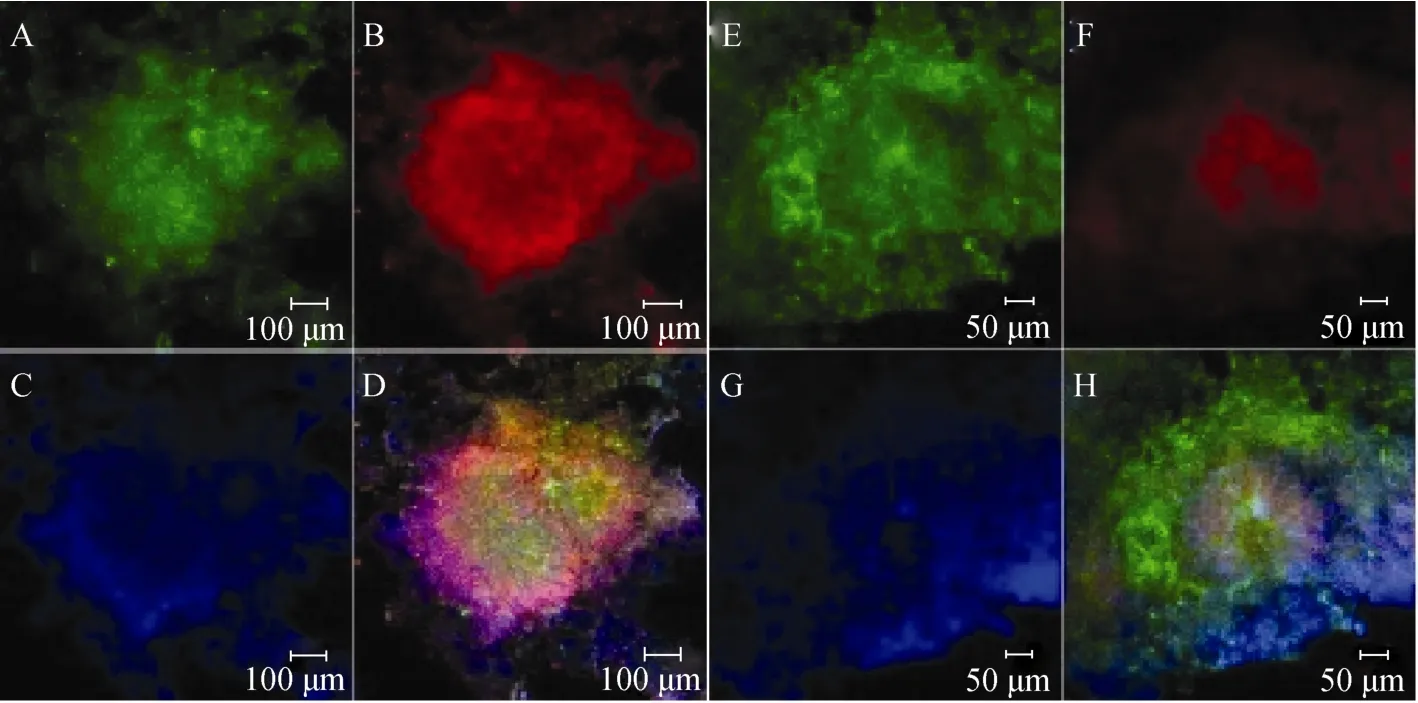
图1 LYON-ES细胞在神经分化第12天分化为神经干细胞Fig.1 LYON-ES cells differentiated into neural stem cells at the 12th day

图2 Rosettes结构神经干细胞经(RNSCs)bFGF/EGF扩增Fig.2 Rosettes neural stem cells(RNSCs) proliferate with bFGF/EGF

图3 手工挑选Rosettes结构神经干细胞经bFGF/EGF扩增传代培养Fig.3 The Rosettes neural stem cells proliferation and differentiation with bFGF and EGF
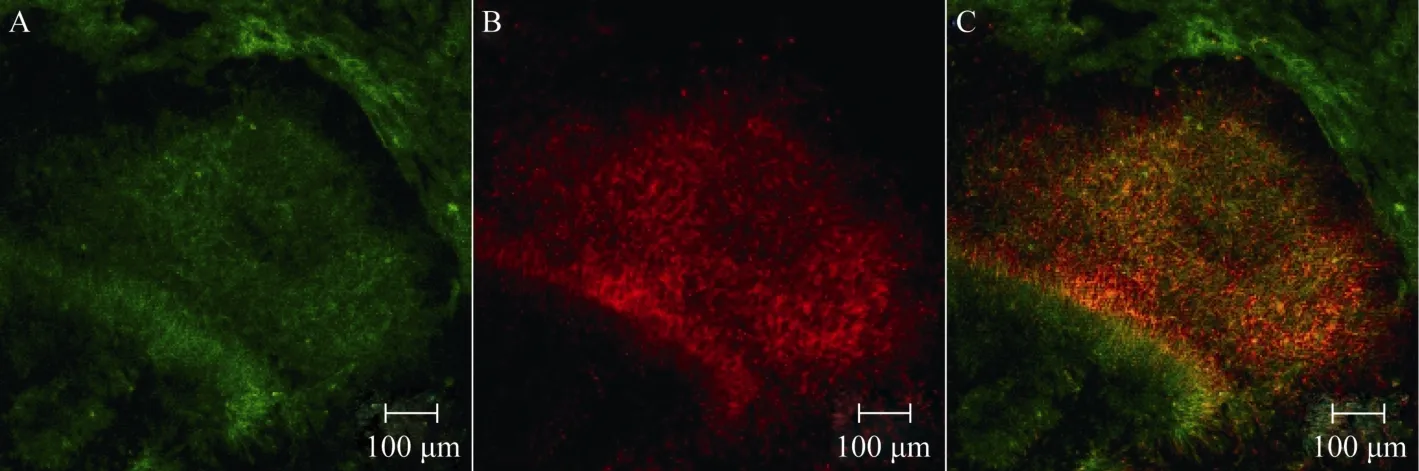
图4 手工挑选Rosettes结构神经干细胞经扩增传代培养(无bFGF/EGF)Fig.4 The Rosettes neural stem cells proliferation and differentiation without bFGF and EGF
ESCs具有分化为身体的所有类型细胞的能力。长期以来, ESCs向神经细胞的分化一直是研究热点。目前, 体外定向诱导ESCs向神经分化的方法多样, 依据分化原理可以分为以下几种:化学物质诱导法(Bain et al, 1995)、EB形成法(Reubinoff et al, 2001; Kuo et al, 2003; Itsykson et al, 2005)、共培养或条件培养基诱导法(Takagi et al, 2005;Yan et al, 2005)、基因修饰法和单层培养诱导分化法Nestin (Andressen et al, 2001)、Sox2(Li et al, 1998)、Nurr1(Kim et al, 2002)、bHLH(Kanda et al, 2004)等。其中EB形成法又称谱系选择法, 是目前胚胎干细胞向神经细胞分化研究中最常用的方法。该分化方法具有三维结构, 可以模拟早期胚胎发育的许多特点, 广泛应用在灵长类神经分化研究中(Reubinoff Et al, 2001; Kuo et al, 2003; Itsykson et al, 2005)。本实验参照Pankratz et al ( 2007)建立的综合EB法和单层法优点的分化体系, 建立了稳定高效的神经干细胞分化体系, 该体系分化采用无血清培养基, 得到了Nestin和Pax6高表达的神经干细胞。
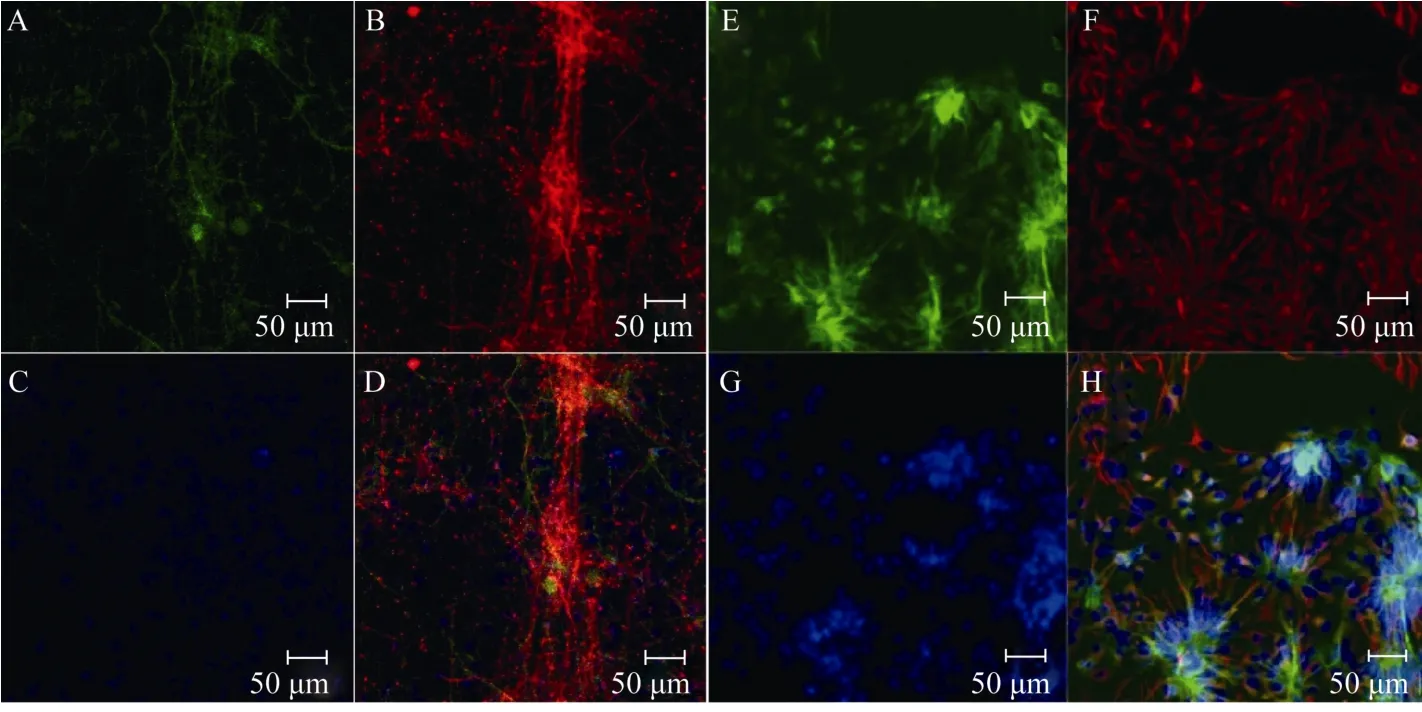
图5 经bFGF/EGF扩增后的Rosettes神经干细胞向神经细胞分化Fig.5 The Rosettes neural stem cells proliferate with bFGF/EGF and differentiate into neurons and glia cells

图6 经bFGF/EGF扩增后的Rosettes神经干细胞猕猴脑内移植Fig.6 The rosettes neural stem cells proliferated by adding bFGF/EGF were transplanted into rhesus monkey brain
Rosettes结构的NSCs(R-NSCs)具有广泛的发育潜能。因此, 如何扩增和维持R-NSCs是开展神经疾病细胞替代性治疗研究的关键。Li et al(2008)发现肝细胞生长因子(hepatocyte growth factor, HGF)能协同bFGF促进猕猴胚胎干细胞来源的神经前体细胞的增殖。虽然bFGF和EGF是常用的扩增和维持NSCs的关键生长因子(Murphy et al, 1990 ; Studer et al, 1998), 可有些学者认为, 当R-NSCs在bFGF/ EGF存在时, 会引起Rosettes结构的改变从而导致其向终端分化。bFGF具有诱导喙尾(rostro-caudal)轴广泛类型细胞分化的能力, 经过bFGF长期扩增的细胞将很难分化成特定区域的神经元(Du&Zhang, 2004)。也有学者认为, 经过bFGF/EGF扩增后依然能够长期维持其干细胞特性(Hong et al, 2008; Koch et al, 2009)。本实验中, 手工挑选的R-NSCs经过bFGF/EGF扩增传代2个月后,仍然能够较好的维持Rosettes结构特性, 表明bFGF/EGF扩增能够较好的维持干细胞的分化特性。
当前进行的神经干细胞移植实验研究中, 多数都通过bFGF/EGF扩增, 移植后细胞的存活、分化及迁移效果良好(Muotri et al, 2005)。由猕猴胚胎干细胞分化得到的神经干细胞在大鼠上异种移植也能够存活并分化(Li et al, 2005)。本实验中, 经bFGF/ EGF扩增的猕猴Rosettes结构神经干细胞经同种移植后2个月, 仍然能够较好地存活并向神经元分化。
总之, 通过bFGF/EGF扩增的神经干细胞能够较好地维持其干细胞特性, 移植后能够在宿主脑内存活并向神经细胞分化, 这为将来人类神经干细胞移植提供了更具参考价值的数据。
Amar AP, Zlokovic BV, Apuzzo ML. 2003. Endovascular restorative neurosurgery: a novel concept for molecular and cellular therapy of the nervous system[J]. Neurosurgery,52(2): 402–413.
Andressen C, Stöcker E, Klinz FJ, Lenka N, Hescheler J, Fleischmann B, Arnhold S, Addicks K. 2001. Nestin-specific green fluorescent protein expression in embryonic stem cell-derived neural precursor cells used for transplantation[J]. Stem Cells,19(5): 419–424.
Bain G, Kitchens D, Yao M, Huettner JE, Gottlieb DI. 1995. Embryonic stem cells express neuronal properties in vitro[J]. Dev Biol,168(2): 342–357.
Calhoun JD, Lambert NA, Mitalipova MM, Noggle SA, Lyons I, Condie BG, Stice SL. 2003. Differentiation of rhesus embryonic stem cells to neural progenitors and neurons[J]. Biochem Biophys Res Commun,306(1): 191–197.
Chen HW, Mao Y, Li B, Wei Q, Zhang J, Wang JH, Wang JH, Wang SF, Tan T, Zhang XZ, Li J, Ma YY, Ji WZ. 2008. Neural lineage development of rhesus monkey embryonic stem cells: Insight of neurogenesis and gliogenesis in vitro[J]. Cell Res,18(S1): s148.
Chen SS, Revoltella RP, Papini S, Michelini M, Fitzgerald W, Zimmerberg J, Margolis L. 2003. Multilineage differentiation of rhesus monkey embryonic stem cells in three-dimensional culture systems[J]. Stem Cells,21(3): 281–295.
Cohen S. 1962. Isolation of a mouse submaxillary gland protein accelerating incisor eruption and eyelid opening in the new-born animal[J]. J Biol Chem,237: 1555–1562.
Du ZW, Zhang SC. 2004. Neural differentiation from embryonic stem cells: which way?[J]. Stem Cell Dev,13(4): 372-381.
Elkabetz Y, Studer L. 2008. Human ESC-derived neural rosettes and neural stem cell progression[J]. Cold Spring Harb Symp Quant Biol,73: 377–387.
Gage FH. 2000. Mammalian neural stem cells[J]. Science,287(5457): 1433-1438.
Gospodarowicz D. 1975. Purification of a fibroblast growth factor from bovine pituitary[J]. J Biol Chem,250(7): 2515–2520.
Hong SH, Kang UJ, Isacson O, Kim KS. 2008. Neural precursors derived from human embryonic stem cells maintain long-term proliferation without losing the potential to differentiate into all three neural lineages, including dopaminergic neurons[J]. J Neurochem,104(2): 316–324.
Itsykson P, Ilouz N, Turetsky T, Goldstein RS, Pera MF, Fishbein I, Segal M, Reubinoff BE. 2005. Derivation of neural precursors from human embryonic stem cells in the presence of noggin[J]. Mol Cell Neurosci,30(1): 24–36.
Kanda S, Tamada Y, Yoshidome A, Hayashi I, Nishiyama T. 2004. Over-expression of bHLH genes facilitate neural formation of mouse embryonic stem (ES) cells in vitro[J]. Int J Dev Neurosci,22(3): 149–156.
Kim JH, Auerbach JM, Rodríguez-Gómez JA, Velasco I, Gavin D, Lumelsky N, Lee SH, Nguyen J, Sánchez-Pernaute R, Bankiewicz K, McKay R. 2002. Dopamine neurons derived from embryonic stem cells function in an animal model of Parkinson's disease[J]. Nature,418(6893): 50–56.
Koch P, Opitz T, Steinbeck JA, Ladewig J, Brüstle O. 2009. A rosette-type, self-renewing human ES cell-derived neural stem cell with potential for in vitro instruction and synaptic integration[J]. Proc Natl Acad Sci USA,106(9): 3225–3230.
Kuai XL, Gagliardi C, Flaat M, Bunnell BA. 2009. Differentiation of nonhuman primate embryonic stem cells along neural lineages[J]. Differentiation,77(3): 229–238.
Kuo HC, Pau KY, Yeoman RR, Mitalipov SM, Okano H, Wolf DP. 2003. Differentiation of monkey embryonic stem cells into neural lineages[J]. Biol Reprod,68(5): 1727–1735.
Li M, Pevny L, Lovell-Badge R, Smith A. 1998. Generation of purified neural precursors from embryonic stem cells by lineage selection[J]. Curr Biol,8(17): 971–974.
Li RR, Chen HW, Chen DL, Wang SF, Zhang J, Chen R, Ji WZ. 2008. Hepatocyte growth factor promotes the proliferation of the neural progenitors derived from rhesus monkey embryonic stem cells[J]. Zool Res,29(5): 518–528. (in Chinese)
Li T, Zheng J, Xie Y, Wang S, Zhang X, Li J, Jin L, Ma Y, Wolf DP, Zhou Q, Ji W. 2005. Transplantable neural progenitor populations derived from rhesus monkey embryonic stem cells[J]. Stem Cells,23(9): 1295–1303.
Modo M, Rezaie P, Heuschling P, Patel S, Male DK, Hodges H. 2003. Transplantation of neural stem cells in a rat model of stroke: assessment of short-term graft survival and acute host immunological response[J]. Brain Res,958(1): 70–82.
Muotri AR, Nakashima K, Toni N, Sandler VM, Gage FH. 2005. Development of functional human embryonic stem cell-derived neurons in mouse brain[J]. Proc Natl Acad Sci USA,102(51): 18644–18648.
Murphy M, Drago J, Bartlett PF. 1990. Fibroblast growth factor stimulates the proliferation and differentiation of neural precursor cells in vitro[J]. J Neurosci Res,25(4): 463–475.
Okita K, Ichisaka T, Yamanaka S. 2007. Generation of germline-competent induced pluripotent stem cells[J]. Nature,448(7151): 313–317.
Pankratz MT, Li XJ, Lavaute TM, Lyons EA, Chen X, Zhang SC. 2007. Directed neural differentiation of human embryonic stem cells via an obligated primitive anterior stage[J]. Stem Cells,25(6): 1511–1520.
Reubinoff BE, Itsykson P, Turetsky T, Pera MF, Reinhartz E, Itzik A, Ben-Hur T. 2001. Neural progenitors from human embryonic stem cells[J]. Nat Biotechnol,19(12): 1134–1140.
Studer L, Tabar V, Mckay R. 1998. Transplantation of expanded mesencephalic precursors leads to recovery in parkinsonian rats[J]. Nat Neurosci,1(4): 290–295.
Takagi Y, Takahashi J, Saiki H, Morizane A, Hayashi T, Kishi Y, Fukuda H, Okamoto Y, Koyanagi M, Ideguchi M, Hayashi H, Imazato T, Kawasaki H, Suemori H, Omachi S, Iida H, Itoh N, Nakatsuji N, Sasai Y, Hashimoto N. 2005. Dopaminergic neurons generated from monkey embryonic stem cells function in a Parkinson primate model[J]. J Clin Invest,115(1): 102–109.
Wianny F, Bernat A, Huissoud C, Marcy G, Markossian S, Cortay V, Giroud P, Leviel V, Kennedy H, Savatier P, Dehay C. 2008. Derivation and cloning of a novel rhesus embryonic stem cell line stably expressing tau-green fluorescent protein[J]. Stem Cells,26(6): 1444–1453.
Wolf DP, Kuo HC, Pau KY, Lester L. 2004. Progress with nonhuman primate embryonic stem cells[J]. Biol Reprod,71(6): 1766–1771.
Yan YP, Yang DL, Zarnowska ED, Du ZW, Werbel B, Valliere C, Pearce RA, Thomson JA, Zhang SC. 2005. Directed differentiation of dopaminergic neuronal subtypes from human embryonic stem cells[J]. Stem Cells,23(6): 781–790.
Rhesus monkey embryonic stem cells differentiation, proliferation and allotransplantation
DONG Jin-Run1,2,3,+, GUO Li-Yun4,+, QU Jia-Gui1,2,5, QI Ren-Li1,2,5, WANG Wen-Chao1,2, XIAO Chun-Jie3,*, WANG Zheng-Bo1,2,*
(1. State Kay Laboratory of Brain and Cognitive Science, Institute of Biophysics, the Chinese Academy of Sciences, Beijing 100101, China; 2. Kunming Institute of Zoology, the Chinese Academy of Sciences, Kunming 650223, China; 3.Life Sciences Faculty of Yunnan University, Kunming 650223, China; 4.Department of Ophthalmology, the Fourth Affiliated Hospital of Kunming Medical College, Kunming 650021,China; 5School of Life Science, University of Science and Technology of China, Hefei 230026, China)
To investigate the characteristics of rhesus monkey embryonic stem cells and to promote their clinical application, the differentiation and proliferation of rosettes neural stem cells from GFP marked rhesus monkey embryonic stem cells were studied The results showed that: 1) A stable and high-efficient neural differentiation system was established. More than 95% of the embryonic stem cells were differentiated into neural stem cells on the 12thdays of differentiation; 2) the rosettes neural stem cells differentiated from the rhesus monkey embryonic stem cells could maintain their rosettes-shape by proliferating with bFGF/EGF; 3) the neural stem cells could differentiate into neurons after transplanted into the rhesus monkey brain. In conclusion, the rosettes neural stem cells differentiated from rhesus monkey embryonic stem cells could maintain their characteristics after proliferation with bFGF/EGF and they could survive and differentiate into neurons after transplanted into the rhesus monkey brain, which strongly supports the clinical application of neural stem cells in the future.
Rhesus monkey; Neural stem cells; Rosettes; Basic fibroblast growth factor;Epidermal growth factor
董锦润, E-mail: vivid_run@126.com;郭立云,昆明医学院在读博士研究生, kitteyyun@yahoo.com.cn
Q959.848;Q421; Q813.7
A
0254-5853-(2012)01-0043-06
book=48,ebook=388
10.3724/SP.J.1141.2012.01043
2011-12-01;接受日期:2011-12-22
;“973”项目(947703);国家自然科学基金项目(31070963, 30670669)
∗通信作者(Corresponding authors), E-mail: wangzb@mail.kiz.ac.cn
+并列第一作者(Authors contributed equally to the work)
