基于接枝二茂铁介体的BOD 微生物传感器
2012-12-23胡磊,李轶
胡 磊,李 轶
(1.河海大学浅水湖泊综合治理与资源开发教育部重点实验室, 江苏南京 210098;2.河海大学环境学院, 江苏南京 210098)
生化需氧量(BOD)作为重要的衡量水与废水中有机污染程度的指标,在水污染控制中具有非常重要的作用。传统经典的BOD 测量方法需要5 d 时间,而且操作复杂、受外界影响大,不能满足对污染水体或污染源在线监测的要求[1]。自Karube 等[2]于1977 年最先研制出用于测量BOD 的微生物传感器后,国内外很多学者研发出各种基于不同菌种及混合菌种的BOD 传感器[3-6]。现有的基于微生物传感器的快速测定方法将测量时间从5 d 缩短到30 min,极大地满足了对水和废水BOD 监测的要求,但是也存在着对水样中DO 依赖大等问题。
近年来,越来越多的学者[7-9]研究利用氧化还原介体代替分子氧作为监测微生物分解代谢的最终电子受体。在微生物的生化反应中氧化态的介体失去电子,转变为还原态的介体,此过程的电子变化产生传感器电流响应,从而可以定量反应中氧化还原物质的量。很多利用介体促进微生物生化反应的研究,反应体系是水溶液,且介体的浓度很高,如达40 mmol/L[10]和55 mmol/L[11],导致介体的浪费。笔者针对以上问题,开发出基于接枝二茂铁介体的微生物传感器,将介体接枝到大分子材料中,并包埋于聚乙烯醇(PVA)中,保持了介体的性能并避免了介体的流失,很好地应用于测量废水中的BOD。
1 实验部分
1.1 材料与试剂
二茂铁(Fc),KH550 (3-aminopropyltriethoxysilane,3-APTES), 聚乙烯醇(PVA, 醇解度90%, 分子量22 000)购自南京曙光化学有限公司,其余试剂均采用分析纯试剂。磷酸盐缓冲溶液(PBS, pH =7.2)(由36 mL 的71.64 g Na2HPO412H2O 和14 mL 的31.21 g NaH2PO42H2O 混合配制而成)。BOD 标准校正溶液(GGA)[12],采用葡萄糖(150 mg/L)、谷氨酸(150 mg/L)混合溶液。
1.2 二茂铁介体的接枝
将Fc与微生物固定化于PVA 包埋材料中,在微生物对有机物的降解反应中代替氧为最终的电子受体。由于Fc 是小分子有机物,其分子的大小(nm 级)远远小于包埋材料的孔径(平均为μm 级),故需要与大分子有机物进行接枝。SBA-15 是一种具有巨大比表面积的介孔氧化硅材料,其丰富的表面羟基为接枝创造了良好的条件,其制备过程见文献[13] ,二茂铁甲酸的制备见文献[14] 。将6.9 g 二茂铁甲酸和6.63g KH550 溶解在50mL 氯仿和50mL N,N-二甲基甲酰胺的混合溶剂中,加入4.67 g 1-羟基苯并三唑,当上述溶液冷却到0 ℃时,加入6.68 g EDCI(1-Ethyl-3-[3-(dimethylamino)-propyl] carbodiimide hydrochloride)和3.6 g NMM(N-methylmorpholine)。将溶液从冰浴中取出,常温搅拌24 h,加入8 g SBA-15并继续搅拌48 h。过滤所得的混悬液,滤渣在索氏提取器中用氯仿过夜洗涤除去游离的成分,所得的固体真空干燥, 得到14.2 g 样品, 样品被标记为Fc-SBA-15。Fc-SBA-15 的合成步骤见图1。
1.3 微生物培养及固定化

图1 Fc-SBA-15 合成示意图
微生物选用从活性污泥(取自江心洲污水处理厂)分离出的混合菌种。将取来的活性污泥经双层纱布过滤后,在滤液(混合菌种)中投加好氧菌培养基,包含0.1%蛋白胨,0.1%牛肉膏及0.1%CaCl2。在30 ℃水浴中曝气培养24 h,菌液在550 nm 波长处的吸光度达到0.8 时,将菌液以7 200 r/min 离心5 min,离心后用pH 为7.2 的磷酸盐缓冲液(PBS)清洗,清洗后的菌液再次离心。重复此过程两遍后,将离心后的菌泥与Fc-SBA-15 介体悬浊液、10%的PVA 溶胶进行混合包埋,混合均匀后压制成片(厚度为0.3μm),室温晾干后裁剪成适合的大小,作为传感器的生物敏感材料。
1.4 传感器系统的构建
利用三电极系统作为电化学的换能器。分别用玻碳电极(截面直径6mm)为工作电极,Pt 电极为对电极,饱和甘汞电极为参比电极,以通路的电流值为测量指标。玻碳电极在使用前分别用1.0 μm、0.3μm和0.05 μm α-Al2O3打磨至光滑,每次打磨后均用去离子水仔细清洗。最后打磨好的玻碳电极在室温下晾干。和以前相关的研究[15]相比,本研究使用了更少的Fc 介体,并有效地阻止介体从包埋材料中流失。
2 结果和讨论
2.1 接枝Fc 样品的表征
分析Fc-SBA-15 和SBA-15 样品的红外光谱(图2),SBA-15 在3 750 cm-1处有清晰的振动谱带,此振动吸收为硅羟基吸收峰,Fc-SBA-15 在波数3 750 cm-1处此振动谱带明显退化,显示硅羟基被反应消耗。Fc-SBA-15在波数3 100 ~2 800 cm-1和1 550 ~1 250 cm-1处有明显的振动,此振动带归属于N—H和C—H 键[11],因为纯SBA-15 在此区域没有振动,而KH550 中含有N—H 和C—H 键,说明KH550 的骨架存在于Fc-SBA-15 中。另外,1 700 ~1 500 cm-1处的振动归属于酰胺基团,酰胺基团是KH550 的氨基与二茂铁甲酸的羧基缩合的结果,由此证明了Fc已被成功接枝到了SBA-15 上。

图2 Fc-SBA-15 和SBA-15 的红外谱图
由图3 可知,电极插入于0.01M 的PBS 溶液中,电位的扫描速度为50 mV/s,固定了Fc-SBA-15 的介体具有明显的氧化还原峰,而对照样SBA-15 则没有氧化还原峰,证明了在电化学反应中起电子传递作用的物质是Fc。

图3 介体的循环伏安
2.2 传感器的性能
在实验优化的条件下,用BOD5为50 m/L 的GGA标准溶液对传感器进行测试。结果表明,传感器的质量浓度线性范围为2 ~300 mg/L,单个传感器连续测量20 个标准样品的精密度为4.2%,传感器能连续稳定工作35 d(传感器响应电流衰减在15%以下)。
2.3 pH、温度和重金属离子的影响
溶液中的pH 值影响着微生物的生理状态。考察在一定的营养条件(ρ(BOD5)=100 mg/L,pH 为6~9)下传感器固定化微生物的活性。实验表明,传感器响应电流差ΔΙ随着pH 值的增加而逐渐增大,响应电流差ΔΙ在pH 值为7.2 时最大,然后逐渐下降。因此pH 值为7.2 时是最佳条件,具体见图4。
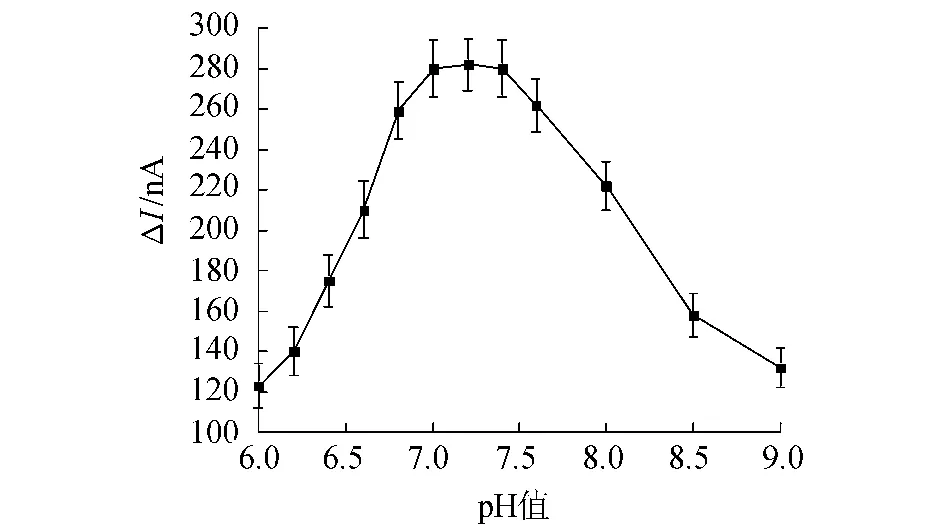
图4 pH 对传感器的影响
温度是影响微生物生理代谢的重要因素,适宜的温度能提高微生物的生理活性。在ρ(BOD5)=100mg/L,温度为20 ~40 ℃的营养条件下,考察了传感器的响应电流差。结果表明,随着温度的上升,传感器的响应电流差逐渐增大,温度达到30 ℃时响应值最高,随后响应值缓慢下降。结果表明温度为30 ℃时为系统微生物的最适宜温度,详见图5。

图5 温度对传感器的影响
生活污水和工业废水中会含有多种重金属。常见的重金属离子有Cu2+、Zn2+、Pb2+、Cr3+、Cd2+等。适量的重金属对微生物的生理影响不大,过量的重金属对微生物会产生抑制作用,降低微生物的生理活性,使微生物从分解代谢为主转为内源代谢为主,从而降低了传感器的响应电流值。笔者研究了Cu2+、Zn2+、Pb2+、Cr3+、Cd2+这5 种重金属离子对传感器的影响。结果表明, 在重金属浓度低于100 mmol/L 时,重金属对传感器响应无影响(抑制率小于5%)。重金属浓度大于500 mmol/L 时,对传感器的微生物有明显的抑制作用(抑制率大于15%)。5种重金属离子的抑制率由大到小顺序为:Pb2+、Cd2+、Cu2+、Cr3+、Zn2+。
2.4 实际废水监测
对污染河道河水,污水处理厂(江心洲污水处理厂)进水、出水及食品工业废水分别进行BOD 传感器快速测量,并与BOD5相对照(表1)。结果均表明Fc传感器法测得的BOD 值(BODs)与标准的五日法测定的值具有良好的可比性。相比而言,低浓度的河水水样和污水处理厂出水的相关度略差。可能是因为河水和污水处理厂出水中难生物降解的大分子有机物相对较多,微生物短时间难以降解。

表1 实际废水监测结果
3 结 论
a.与大分子材料SBA-15 接枝处理而得的介体Fc-SBA-15,在保持了电化学活性的同时,也阻止了介体从包埋材料中流失。
b.实验得出传感器的最优化工作条件为pH 7.2,温度30 ℃。废水中常见的Cu2+、Zn2+、Pb2+、Cr3+、Cd2+重金属离子在100 mmol/L 浓度下对传感器无影响。
c.传感器的线性范围为2 ~300mg/L,连续测量20 个样品的精密度为4.2%,能连续工作35 d,在线性范围内对低、中、高浓度实际废水测得的BOD 值,与BOD5均具有较好的相关度。
[1] LIU J,MATTIASON B.Microbial BOD sensors for wastewater analysis[J] .Water Res,2002,36(15):3786-3802.
[2] KARUBE I,MATSUNAGA T, MITSUDA S, et al.A microbial electrode BOD sensors[J] .Biotechnol Bioeng,1977,19(10):1535-1547.
[3] 李洛娜, 钮玉龙,李捷, 等.BOD 微生物传感检测仪中高效微生物膜的研究[J] .环境工程学报, 2009(3):437-441.
[4] LIU J,BJORNSSON L,MATTIASSON B.Immobilised activated sludge based biosensor for biochemical oxygen demand measurement[J] .Biosens Bioelectron, 2000, 14(12):883-893.
[5] 王建龙, 章一心.生物传感器BOD 快速测定仪的研究进展[J] .环境科学学报,2007(7):1066-1082.
[6] PANG H, KWOK N Y.CHAN P H, et al.High-throughput determination of biochemical oxygen demand(BOD)by a microplate-based biosensor[J] .Environ Sci Technol,2007, 41(11):4038-4044.
[7] RAMSAY G,TURNER A.Development of an electrochemical method for the rapid determination of microbial concentration and evidence for the reaction mechanism[J] .Anal Chim Acta,1988,215:61-69.
[8] ERTL P, ROBELLO E, BATTAGLINI F, et al.Ferricyanide reduction by escherichia coli:kinetics, mechanism, and application to the optimization of recombinant fermentations[J] .Anal Chem,2000, 72:4949-4956.
[9] ERTL P, ROBELLO E,BATTAGLINI F, et al.Rapid antibiotic susceptibility testing via electrochemical measurement of ferricyanide reduction by escherichia coli and clostridium sporogenes[J] .Anal Chem, 2000,72:4957-4964.
[10] NAKAMURA H,SUZUK K,ISHIKURO H, et al.A new BOD estimation method employing a double-mediator system by ferricyanide and menadione using the eukaryote Saccharomyces cerevisiae[J] .Talanta,2007, 72:210-216.
[11] MORRIS K, CATTERALL K, ZHAO H, et al.Ferricyanide mediated biochemical oxygen demand:development of a rapid biochemical oxygen demand assay[J] .Anal Chim Acta,2001,442:129-139.
[12] Japanese Industrial Standard Committee.Apparatus for the estimation of biochemical oxygen demand (BOD) with microbial sensor[P] .Tokyo:Japanese Standards Association,1990.
[13] ZHAO D Y, FENG J, HUO Q, et al.Triblock copolymer syntheses of mesoporoussilica with periodic 50 to 300 angstrom pores[J] .Science,1998,279(5350):548-552.
[14] 王世辉, 洪秀云, 孙蕊.二茂铁甲酸的合成[J] .应用化工, 2007,36(6):540-541.
[15] CHEN H, YE T, QIU B et al.A novel approach based on ferricyanide-mediator immobilized in an ion-exchangeable biosensing film for the determination of biochemical oxygen demand[J] .Anal Chim Acta,2008,612(1):75-82.
[16] SREYASHI J, BUDDHADEB D, RAJESH B, et al.Anchoring of copper complex in MCM-41 matrix:a high efficient catalyst for epoxidation of olefins by tert-BuOOH[J] .Langmuir, 2007,23:2492-2496.
