二氢黄酮醇-4-还原酶(DFR)基因在烟草中的过量表达
2012-12-23黄春国马素娴
黄春国,马素娴
(1.山西农业大学农学院,山西太谷030801;2.山西农业大学园艺学院,山西太谷030801)
在影响植物花色的各种因素中,花色素具有非常重要的作用。近年来,世界各国的学者对花色素作为影响花色的主要可调控因素这一研究课题投入了极大的关注。而花色素主要由3 种不同的花色苷构成,分别为甜菜红色素(Betalains)、类胡萝卜素(Carotenoids) 和花青素(Anthocyanins)[1]。因此,进一步研究花色素形成机理显得越来越重要,尤其是对花色素生物合成途径中各种有关酶的研究更是具有很重要的意义[2-4]。
二氢黄酮醇-4-还原酶(DFR)属于NADPH依赖性短链还原酶家族,具有专门的NADPH 结合域,在花色素苷生物合成过程中起着非常关键的作用。其最早发现于紫罗兰的一个突变体中,它在花色的修饰中起着很重要的作用,是花青素合成途径中的关键酶。在花色素苷生物合成代谢途径中,其主要作用就是将3 种二氢黄酮醇化合物(DHQ,DHK,DHM)还原成无色的花色素苷(Leucoanthocyanidin),并作为下一步骤中花色素苷合成酶(ANS)和类黄酮3-O-糖基转移酶(3GT)催化的底物,再进一步催化形成稳定的花色素苷,从而使植株花器官呈现出各种颜色[4-6]。
烟草(Nicotiana tabacum)为茄科(Solanaceae)烟草属(Nicotianacco)1 a 生草本植物,在我国南北均有种植,是我国一种重要的经济作物[7-8],也是我国国民经济收入的一个重要支撑。本研究采用植物转基因技术,将从野生型烟草中分离和克隆得到的NtDfr1,NtDfr2 基因,通过根癌农杆菌方法转入到栽培品种烟草中,得到阳性抗性植株后,收获种子并进行播种,最后对得到的转基因烟草植株中二氢黄酮醇-4-还原酶(DFR)进行分析研究,为探索花色素合成途径提供重要参考。
1 材料和方法
1.1 植物材料
试验所用野生型烟草品种为N. tobacco(SNN),N. sylvestins(N. s)和N. tomentosifornis(N.t),获得的转基因烟草品种分别为:dfr1-2,dfr1-5,dfr1-11 和dfr2-1,dfr2-2,dfr2-3。品种均由美国肯塔基大学烟草研究中心植物与土壤科学系重点实验室提供。
1.2 宿主菌
试验使用的大肠杆菌(Escherichia coli)TB1由美国肯塔基大学烟草研究中心植物与土壤科学系重点实验室提供。
1.3 质粒载体
试验所使用的质粒载体为:PGEM-T easy vector,PCAMBIA-2300 vector,PKYLX80 vector 和PCAMBIA-2301 vector。
1.4 PCR 引物
(1)35 S 启动子引物序列(500 bp)P1:CTT AC GCAGC AGGTC TCATC A;P2 CCACC TTCCT TTTCC ACTAT CTT。(2)烟草DFR 基因引物序列(full-length cDNA) F: 5′-GGC AGA TCT ATG GCA AGT GAA GCT CAT GCA-3′;R: 5′-ATG TCT AGA CTA GAT TTC CCC ATT GGT TGA-3′。(3)烟草DFR1 基因引物序列F:5′-AAC CAA CAG TCA GGG GAA TG-3′;R:5′-TTG GAC ATC GAC AGTTCC AG-3′。(4)烟草DFR2 基因引物序列F:5′-AAC CAA CAG TCA GGG GAA TG-3′;R:5′-TTG GGC ATC GAG AGT TCC AG-3′。(5)KAN 引物序列F:5′-ATG GGG ATT GAA CAA GAT GGA-3′;R:5′-TCA GAA GAA CTC GTC AAG AAG-3′。(6)GAPDH 引物序列F:5′-GGT GTC CAC AGA CTT CGT GG-3′;R:5′-GAC TCC TCA CAG CAG CAC CA-3′。
1.5 试验方法
采用SDS 法提取样本的总DNA 和总RNA[9]。利用Primer 3 软件设计引物,由Invitrogen 公司合成寡核苷酸片段。使用引物时可将公司合成的引物离心2 min 后,用10 mmol/L Tris-HCl 稀释为100 μmol/L 的引物原液,离心混匀。再将引物原液稀释为2.5 μmol/L 用于PCR 反应,离心后于-20 ℃冰箱保存备用。
2 结果与分析
2.1 野生型烟草中DFR 基因的鉴定
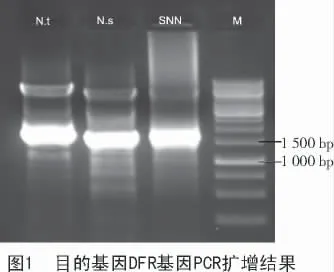
提取野生型烟草的基因组DNA 后,用设计好的引物对目的基因DFR 进行PCR 反应,然后进行琼脂糖凝胶电泳技术检测。从图1 可以看出,野生型烟草中存在DFR 基因。同时还得知,DFR 基因为1 600 bp。
2.2 不同转基因烟草品种中的DFR 基因表达分析
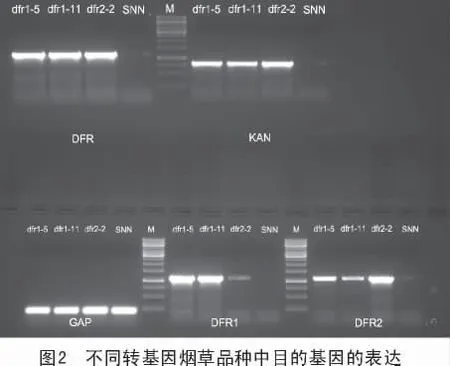
提取转基因烟草(dfr1-5,dfr1-11 和dfr2-2)和野生型烟草(SNN)幼嫩叶片组织的总RNA后,反转录人工合成cDNA,后用DFR,DFR1,DFR2,KAN,GAP 序列引物,进行PCR 反应,然后使用琼脂糖凝胶电泳检测,结果如图2 所示。
由图2 可知,DFR 基因在dfr1-5,dfr1-11 和dfr2-2 转基因烟草中的表达量基本一致,而在野生型烟草(SNN)中的表达量很少;DFR1 基因在dfr1-5 和dfr1-11 品种中超表达,在dfr2-2 品种中表达量明显变少,但在野生型烟草(SNN)中几乎不表达;DFR2 基因在dfr2-2 品种中超表达,而在dfr1-5 和dfr1-11 品种中表达量明显下降,在野生型烟草(SNN)中微量表达,且条带不太清晰。由此可知,通过转基因技术将二氢黄酮醇-4-还原酶(DFR)目的基因转入野生型烟草中,能极大地提高二氢黄酮醇-4-还原酶(DFR)基因在植物体内的表达量,增加其在植物体内的积累量,从而增强它的催化作用,促进花色素苷的生物合成。
2.3 不同转基因品种与野生型品种DFR 基因表达的差异性分析
试验结果显示,转基因获得的烟草花色较深或为红色,表明二氢黄酮醇-4-还原酶(DFR)基因得到了过量表达即超表达,符合试验预期目的。
转目的基因NtDfr1,NtDfr2 烟草中花器官的颜色与对照野生型烟草相比,明显加深且变为红色,这主要是由于在转基因烟草中二氢黄酮醇-4-还原酶得到了超表达而使花色素大量积累,但是转目的基因NtDfr1,NtDfr2 烟草之间也存在一些差异性,而无法通过肉眼分辨,因此,选用转目的基因dfr1-5,dfr1-11,dfr2-2,dfr2-3 这4 个转基因烟草植株,使用了DFR1,DFR2 序列引物、烟草GAPDH 序列引物,运用实时定量PCR反应(QRT-PCR)的方法,对这4 个转基因烟草植株的花器官中目的基因的表达量进行了分析,结果如图3 所示。
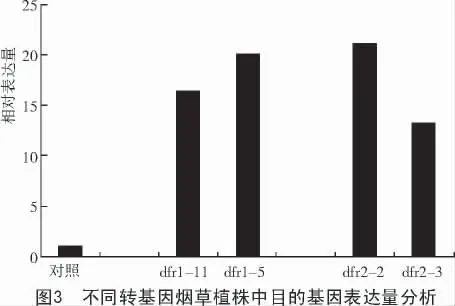
由图3 可知,转目的基因NtDfr1,NtDfr2 烟草中的二氢黄酮醇-4-还原酶(DFR)表达量远远高于野生型烟草,在14~22 倍之间,但是它们之间也存在一定的差异性,如在dfr2-2 烟草植株中,DFR 基因的表达量是对照的22 倍,dfr1-5烟草植株中表达量次之,dfr2-3 烟草植株中最少;在它的花器官中,二氢黄酮醇-4-还原酶(DFR)表达量大约是野生型烟草的14 倍左右,这些差异性可能是由目的基因在整合、复制、转录和翻译的过程中出现了一些变化而造成的,也可能是由外源基因与内源基因之间存在的共抑制性造成的,还可能是由于周围环境因素的影响而造成了它们之间的差异性。应加强利用外源基因的鉴定和遗传分析的方法,逐步分析和找出造成这种差异性的具体原因,从而提高转基因植物的转化效率和对新物种的利用率。
3 结论与讨论
植物花器官的颜色是决定其观赏价值的一个重要因素,长期以来,人们主要是通过传统育种的方式获得一些新异的花色来满足花卉市场的需求[6]。但由于传统育种技术的局限性,近年来,诸多学者开始把转基因技术引入花卉育种领域,极大地缩短了育种年限,减少了传统育种技术中常常出现的各种不良性状等因素的影响[10]。植物基因工程技术在改变花色应用中,既提高了育种效率,又可定向地修饰观赏植物的特定性状而不丧失其原有的其他性状,因此,植物基因工程技术在花卉育种研究中得到了快速的发展[11-12]。
本试验应用植物转基因技术,从野生型烟草中克隆得到二氢黄酮醇-4-还原酶(DFR)基因,然后再转入烟草中进行超表达,从而达到改变花色的目的。试验结果显示,转基因烟草的花色明显加深或变为红色;通过实时定量PCR 反应(QRT-PCR) 可知,二氢黄酮醇-4-还原酶(DFR)基因在转基因植物中得到了超表达,为植物花色素苷合成代谢途径的下一步反应提供了充足的反应底物,促进了花色素苷的生物合成,使植物的花色发生了改变。
本试验中,将NtDfr1,NtDfr2 基因转入烟草中,得到了转基因烟草DFR1 和转基因烟草DFR2 这2 个品种,在对这2 个品种进行分析时发现,它们之间也存在一定的差异性,二者中的二氢黄酮醇-4-还原酶(DFR)在体内的表达量略有差异,但是从花器官的色彩和形态上几乎没有什么差别,只有在使用实时定量PCR 反应(QRT-PCR)法进行分析时,才能看到一些异同。另外,还观察到转基因烟草植株中有部分花色变淡或变为白色,其他性状也略有所改变,生长发育也较为迟缓,这可能是由于共抑制的作用,外源二氢黄酮醇-4-还原酶(DFR)基因的导入抑制或沉默了内源二氢黄酮醇-4-还原酶(DFR)基因的顺利表达和积累。
总之,本研究所得出的结论对实际生活能产生一定的作用,尤其是运用到花卉育种领域和生物制药工程中,既能打破传统育种技术的局限性、为培育各种新奇的花色提供必要的技术手段,又能提高植物体内类黄酮类物质的积累量、为生物制药工程提供大量的原料物质来源。
[1]Erich Grotewold. The genetics and biochemistry of floral pigments[J].Plant Biol,2006,57:761-800.
[2]Jeffrey B Harborne,Christine A Williams.Advances in flavonoid research since 1992[J].Phytochemistry,2000,55:481-504.
[3] Joseph Mol,Erich Grotewold,RonaldKoes. How genes paint flowers and seeds[J].Plant Science,1998,3(6):212-217.
[4]Quattrocchio F,Baudry A,Lepiniec L,et al. The regulation of flavonoid biosynthesis[M].NewYork:Springer,2006:97-122.
[5]Koes R,Verweij W,Quattrocchio F.Flavonoids:a colorful model for the regulation and evolution of biochemical pathways[J].Trends Plant Sci,2005,10:236-242.
[6]Gert Forkmann,Stefan Martens. Metabolic engineering and applications of flavonoids [J]. Elsevier Science Ltd,2001,12(2):155-160.
[7]薛金爱,赵彦宏.烟草SSR 分布特征与开发利用[J].山西农业科学,2011,39(4):295-298,306.
[8]李玲玉.有机土壤对烟草叶片结构的影响[J].天津农业科学,2011,17(5):91-92.
[9]Forkmann G.Flavonoids as flower pigments:the formation of the natural spectrum and its extension by genetic engineering[J].Plant Breed,1991,106:1-26.
[10]曾海涛,王义琴,陈英,等.花卉花色基因工程的研究现状及存在问题[J].中国生物工程杂志,2004,24(6):54-57.
[11]Zhao Y P,Chen F D,Guo W M.Advances in genetic engineering of flower color of ornamental plants [J]. Chin Bull Bot,2003,20(1):51-58.
[12]廉利,车代弟,李静,等.花色基因工程研究进展[J].北方园艺,2004(4):8-9.
