基于响应面法从连翘叶中提取连翘酯苷A和连翘苷的工艺优化
2012-12-22刘伟霞杨建雄
刘伟霞,杨建雄
1陕西师范大学物理学与信息技术学院;2陕西师范大学生命科学学院,西安710062
连翘叶是木犀科植物连翘 Forsythia suspense (Thunb.)Vahl的干燥叶,具有清热解毒、抗菌、保肝、降血脂、抗氧化及抗衰老等作用[1-5],主要含有连翘苷、连翘酯苷、芦丁、齐墩果酸、熊果酸、右旋松脂酚等化学成分[6]。其中连翘苷具有抗氧化和降血脂的作用,对于预防动脉粥样硬化和冠心病等疾病有一定功效[7];连翘酯苷具有抑制弹性蛋白酶活性,治疗肺气肿等多种疾病的功效[8],是迄今为止从连翘属植物中发现的抗菌活性最强的成分之一。近年来的研究发现连翘叶中的连翘苷、连翘酯苷A的含量高于果实[3],且2010版中国药典规定连翘苷和连翘酯苷A的含量为连翘药材的质控指标[9]。我国的连翘叶资源丰富,价格低廉,有效提取其生物活性物质,可提高连翘叶的经济附加值。为开发和利用丰富的连翘叶资源,研究人员已分别开展了连翘苷和连翘酯苷A提取的工艺研究工作[10-12]。但是,从连翘叶中复合提取这两种活性物质的工艺研究尚未见报道。
响应面分析法是一种优化工艺条件的有效方法[13],与传统的正交实验相比,响应面分析法具有试验周期短,效率高,能在整个实验设计的区域上给出因素与响应值之间的回归方程、因素的最佳组合和响应值的最优值。本文利用响应面法优化从连翘叶中同时提取连翘酯苷A和连翘苷的工艺条件,以期为连翘叶的进一步开发利用提供实验数据。
1 仪器与试剂
1.1 仪器
Shimadzu HPLC-20A vp型高效液相色谱仪系统(日本岛津),Sartorius BP221S电子天平,KQ-300DE型数控超声清洗器(昆山市超声仪器有限公司),TU-1810紫外-可见分光光度计(北京普析通用仪器有限责任公司),数显电热恒温水浴锅(常州国华电器有限公司),旋转蒸发器RE-52AA(上海亚荣生化仪器厂),Milli-QG超纯水制备仪(美国Millipore公司)。
1.2 试剂
连翘叶2011年5月采自陕西师范大学校园内,由生命科学学院植物学教研室田先华教授鉴定。连翘酯苷A(批号:A0590~20 mg)和连翘苷(批号: A0272~20 mg)对照品均购自成都曼斯特公司,含量均在98%以上。甲醇为色谱纯,水为超纯水,其他试剂为分析纯。
2 方法与结果
2.1 含量测定方法的建立
色谱条件:大连依利特色谱柱Hypersil BDS C18柱(4.6 mm×250 mm,5 μm);流动相为甲醇(A)-水(含0.2%冰醋酸)(B),梯度洗脱:0~7 min,28%~38%A;7~11 min,38%~40%A;11~25 min,40%~60%A;25~30 min,60%A,测定波长235 nm,流速l mL/min,柱温30℃,进样量10 μL。此条件下对照品及及样品的色谱图见图1。色谱峰的理论板数按连翘酯苷峰计算在5000以上。
对照品溶液的制备:精密称取连翘酯苷A对照品和连翘苷对照品适量,加甲醇制成每1 mL含连翘酯苷A 0.576 mg和连翘苷0.270 mg的混合溶液。
样品溶液的制备:称取连翘叶粉末1 g,置三角瓶中,于不同条件下浸泡提取,放冷,抽滤,取样液1 mL,旋转蒸发仪50℃蒸干,加入50%甲醇10 mL,超声溶解,再经0.45 μm微孔滤膜过滤,滤液待用。
标准曲线:精密吸取上述对照品溶液1、2、4、6、8、10、12 μL分别进样测定,以峰面积Y为纵坐标,进样量X为横坐标,绘制标准曲线,得回归方程为:
连翘酯苷A:Y=812084X-12006,R2=0.9999。表明连翘酯苷A浓度在0.576~6.912 μg内线性关系良好。
连翘苷:Y=840808X+8539.7,R2=0.9999。表明连翘苷浓度在0.27~3.24 μg内线性关系良好。
精密度试验:取同一混合对照品溶液重复进样5次,记录峰面积,计算连翘酯苷 A的 RSD为0.30%(n=5),连翘苷的RSD为0.54%(n=5),说明该方法精密度良好。
稳定性试验:取同一混合对照品溶液在10 h之内每间隔2 h测定一次,记录峰面积,计算得连翘酯苷A的RSD为1.48%(n=6),连翘苷的RSD为0.44%(n=6),说明对照品溶液在10 h内稳定。
重复性试验:在相同条件下,将同一批样品制成5份样品溶液,分别测定含量,计算得连翘酯苷A的RSD为1.20%,连翘苷的RSD为0.80%(n=5),说明该方法重复性好。
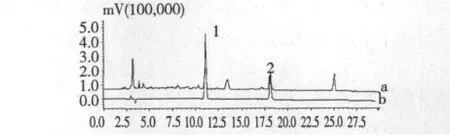
图1 样品(a)及混合对照品(b)的色谱图Fig.1 Chromatogram of sample(a)and mixture standards(b) 1.Forsythiaside;2.Phillyrin
2.2 单因素试验对连翘酯苷A和连翘苷的提取率影响
五月份采摘连翘叶[14],于鼓风干燥箱干燥24 h后粉碎,按照上述含量测定项测定滤液中连翘酯苷A和连翘苷的含量,计算提取率。
提取率=提取所得目标物质的量/连翘叶的干重× 100%
2.2.1 乙醇浓度
固定提取时间为60 min,浸提温度60℃,液料比为25∶1,考察乙醇浓度(10%,20%,30%,40%,50%,60%,70%)对连翘酯苷A和连翘苷得率的影响,连翘酯苷A的提取率分别为3.47%、4.63%、5.16%、5.76%、6.18%、6.19%、6.21%,连翘苷的提取率分别为1.27%、1.87%、2.07%、2.51%、2.71%、2.81%、2.96%。当乙醇浓度大于50%,连翘酯苷A的提取率变化不大,连翘苷的提取率提高幅度较小,并且随着乙醇浓度的提高,杂质溶出率也增多,故综合考虑,本试验选择50%乙醇为提取溶剂。
2.2.2 浸提温度
采用50%乙醇为提取溶剂,液料比为25∶1提取60 min,考察浸提温度(40,50,60,70,80,90℃)对连翘酯苷A和连翘苷提取率的影响。随着温度的升高,连翘酯苷A的提取率先增后减,分别为5.94%、6.67%、7.28%、8.00%、7.95%、7.27%,连翘苷的提取率逐渐增加,分别为2.21%、2.58%、2.77%、2.89%、2.90%、2.97%。可能的原因是连翘酯苷A分子中具有酯键,较高温度下易水解,从而影响提取率。另外,温度越高杂质溶出量也越多,故综合考虑连翘酯苷A的稳定性以及能源节约,选取70℃为提取温度。
2.2.3 液料比
采用50%乙醇为提取溶剂,70℃浸提60 min,考察液料比(10∶1,15∶1,20∶1,25∶1,30∶1)对连翘酯苷A和连翘苷提取率的影响,连翘酯苷A的提取率分别为4.88%、6.11%、6.61%、7.43%、7.36%,连翘苷的提取率分别为2.00%、2.39%、2.66%、2.98%、3.09%。可见,液料比为25∶1时,连翘酯苷A和连翘苷的提取率均达到较高,故液料比选用25∶1。
2.2.4 浸提时间
采用50%乙醇为提取溶剂,浸提温度70℃,液料比为25∶1,考察浸提时间(30,60,90,120,150 min)对连翘酯苷A和连翘苷提取率的影响,连翘酯苷A的提取率分别为7.42%、7.76%、7,78%、7.81%、7.65%,连翘苷的提取率分别为2.73%、2.88%、2.90%、2.93%、2.92%。浸提时间超过60 min则连翘酯苷A和连翘苷的提取率均增减很少。150 min时连翘酯苷A还略有降低,可能是连翘酯苷A不稳定,因水解而降低了提取率,故浸提时间选择60 min。
2.3 响应面分析法优化工艺条件[15]
2.3.1 响应面模型建立
根据Box-Behnken的中心组合实验设计原理[16],综合单因素试验考察结果,采用 Design-Expert 8.0.5b软件为辅助手段设计四因素三水平的响应面分析试验,试验因素和水平见表1。
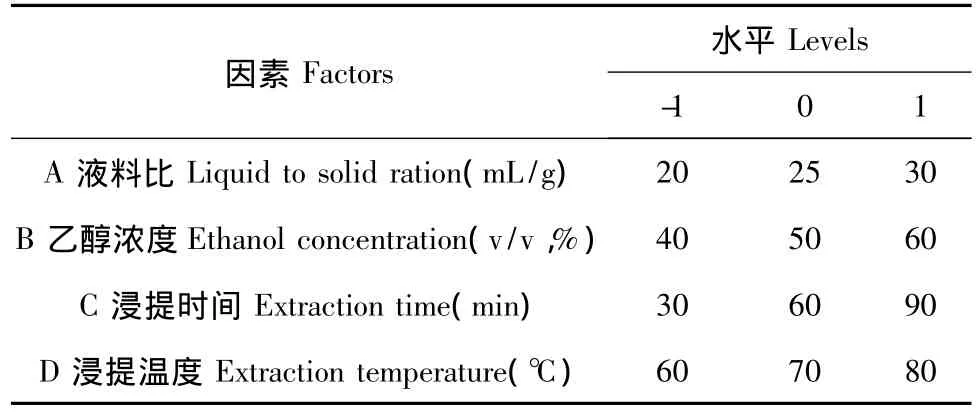
表1 Box-Behnken中心组合设计因素及水平表Table 1 Factors and levels of BBD combination experiment
对A(液料比)、B(乙醇浓度)、C(浸提时间)、D (浸提温度)四个因素做以下变换:X1=(A-25)/ 5,X2=(B-50)/10,X3=(C-60)/30,X4=(D-70)/10,以X1、X2、X3、X4为自变量,以连翘酯苷A提取率(Y1)和连翘苷提取率(Y2)为响应值,采用Design-Expert 8.0.5b进行统计分析。
2.3.2 响应面结果
共设计29个试验点,1~24号为析因实验,25~29号为中心试验。试验设计和试验结果见表2。利用Design-Expert 8.0.5b软件对表2实验数据进行回归拟合,得到以连翘酯苷A提取率(Y1)和连翘苷提取率(Y2)为响应值的二次多项回归方程为:
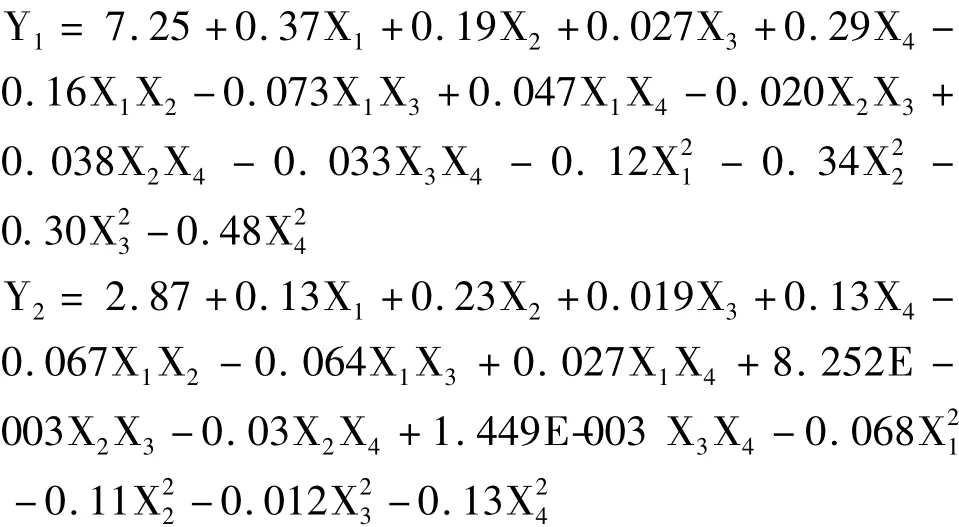
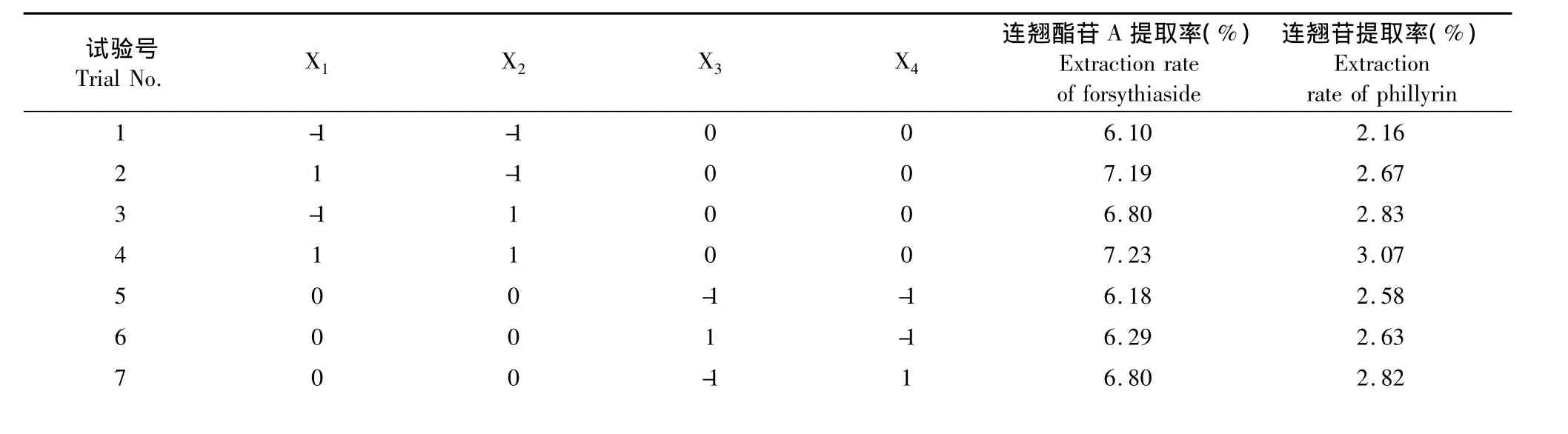
表2 Box-Behnken设计方案及试验结果Table 2 Box-Behnken Design matrix and experimental results of forsythiaside yield and phillyrin yields from F.suspense leaves
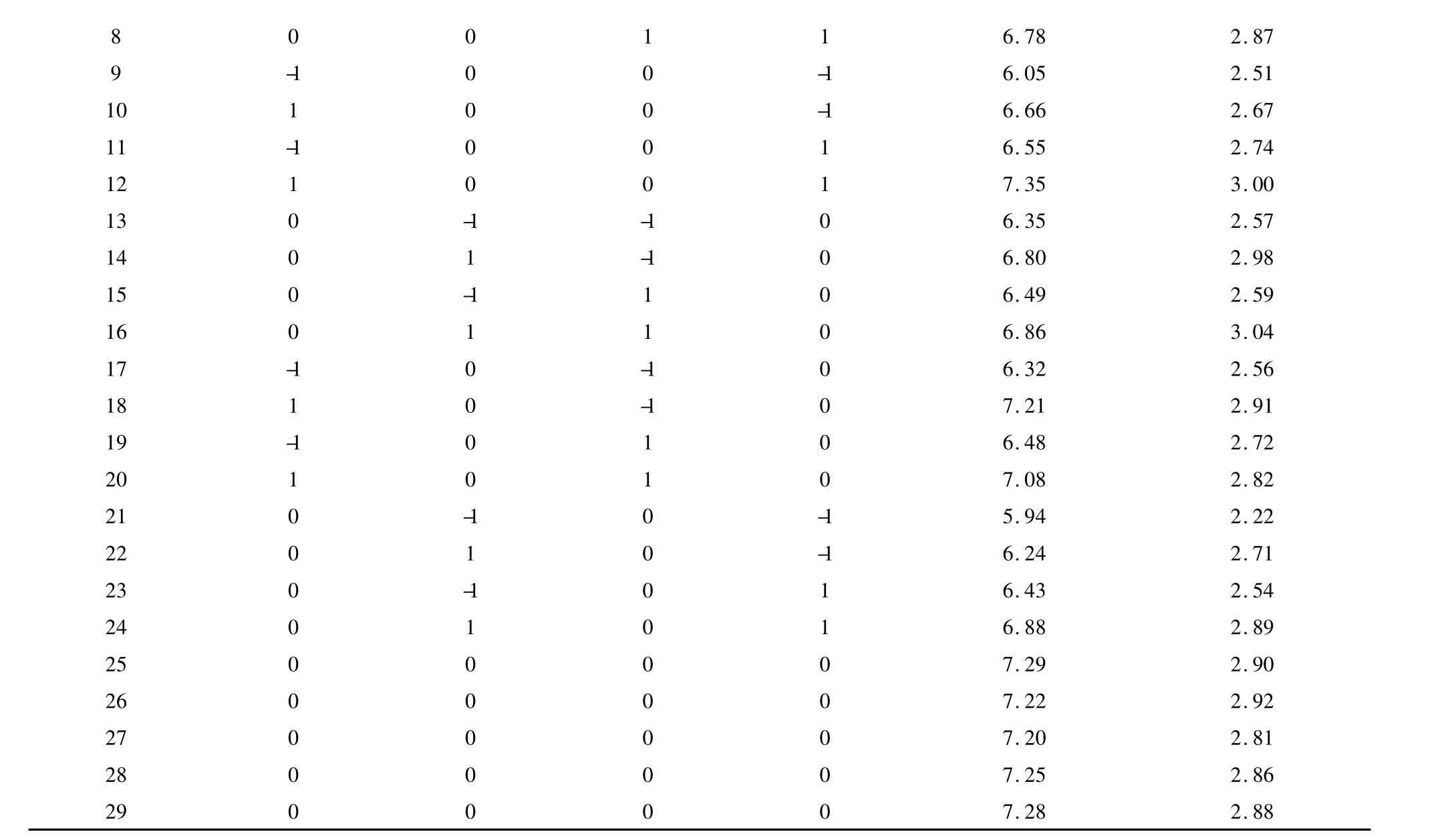
6.7 8 2.8 7 9 -1 0 0 -1 6.0 5 2.5 1 1 0 1 0 0 -1 6.6 6 2.6 7 1 1 -1 0 0 1 6.5 5 2.7 4 1 2 1 0 0 1 7.3 5 3.0 0 1 3 0 -1 -1 0 6.3 5 2.5 7 1 4 0 1 -1 0 6.8 0 2.9 8 1 5 0 -1 1 0 6.4 9 2.5 9 1 6 0 1 1 0 6.8 6 3.0 4 1 7 -1 0 -1 0 6.3 2 2.5 6 1 8 1 0 -1 0 7.2 1 2.9 1 1 9 -1 0 1 0 6.4 8 2.7 2 2 0 1 0 1 0 7.0 8 2.8 2 2 1 0 -1 0 -1 5.9 4 2.2 2 2 2 0 1 0 -1 6.2 4 2.7 1 2 3 0 -1 0 1 6.4 3 2.5 4 2 4 0 1 0 1 6.8 8 2.8 9 2 5 0 0 0 0 7.2 9 2.9 0 2 6 0 0 0 0 7.2 2 2.9 2 2 7 0 0 0 0 7.2 0 2.8 1 2 8 0 0 0 0 7.2 5 2.8 6 8 0 0 1 1 2 9 0 0 0 0 7.2 8 2.8 8
2.3.3 回归模型方差分析
二次多项回归模型方程拟合可靠性由 R2表达,其统计学上的显著性由F值检验,影响因素的线性效应、平方效应及其交互效应的显著性由模型系数的P值检验。分别对连翘酯苷A提取率和连翘苷提取率的回归模型及各参数的显著度进行验证,结果见表3a和表3b。
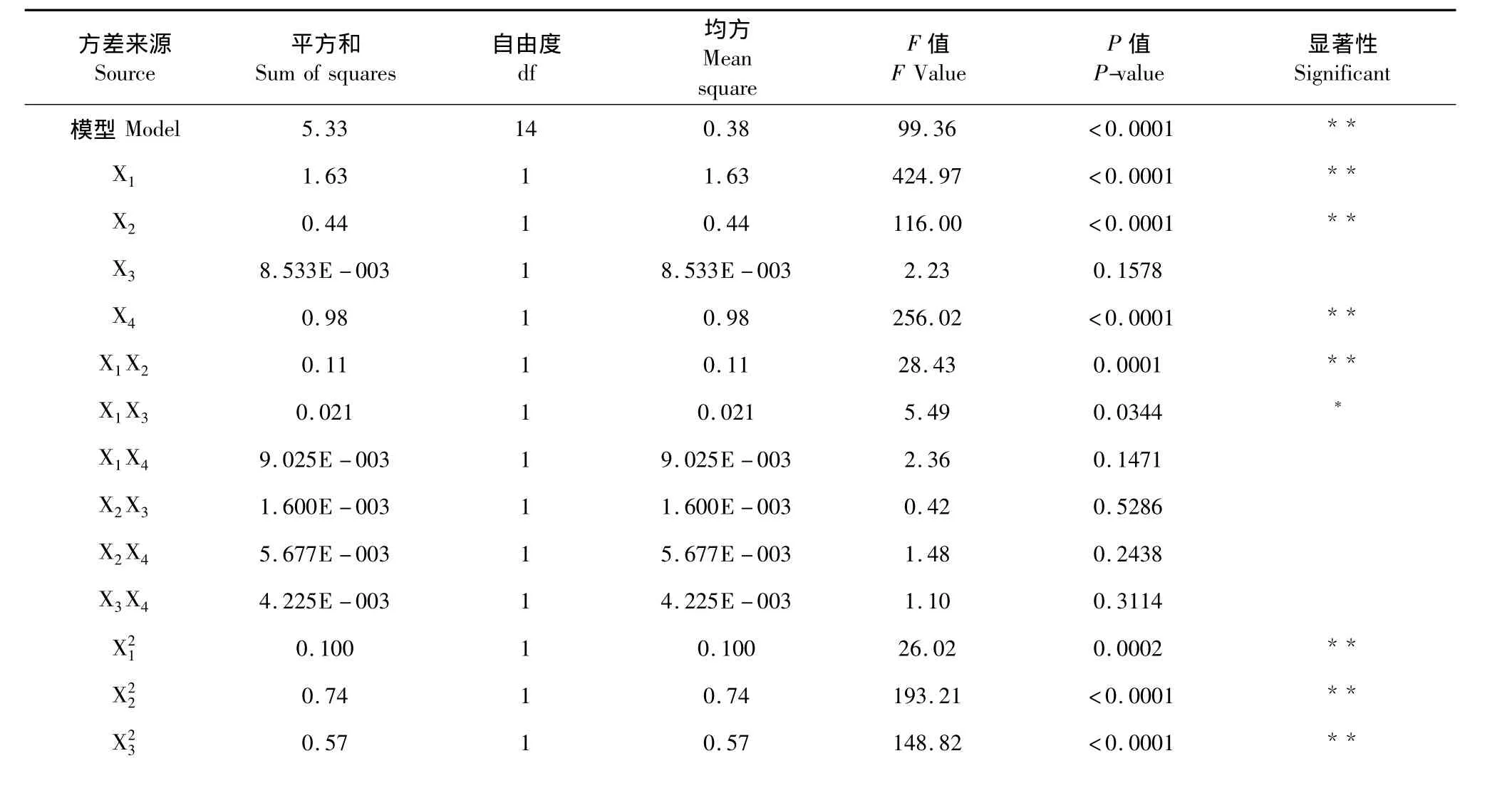
表3 a 连翘酯苷A回归模型方差分析Table 3 a Analysis of variance for Forsythiaside regression model

注:**P<0.001,*P<0.05。下同。Note:**P<0.001;*P<0.05.The same below.
由表3a可知,该模型的P<0.0001,说明模型回归高度显著。回归方程的相关系数(R2)为0.9900,说明模型响应值的变化99.00%来自所选考察变量,因此,回归方程可以较好地描述考察因子与响应值之间的关系。其中液料比、乙醇浓度、浸提温度对连翘酯苷A提取率的影响最大,浸提时间对连翘酯苷A提取率的影响最小。模型的一次项X1, X2,X4极显著,X3不显著;二次项均极显著;交互项X1X2极显著,X1X3显著,其余不显著,这表明各影响因素对于连翘酯苷A提取率的影响不是简单的线性关系。失拟度的P值为0.1337>0.05,对连翘酯苷A提取率影响不显著,说明该模型的拟合度较好。可以利用该模型确定最佳工艺条件。
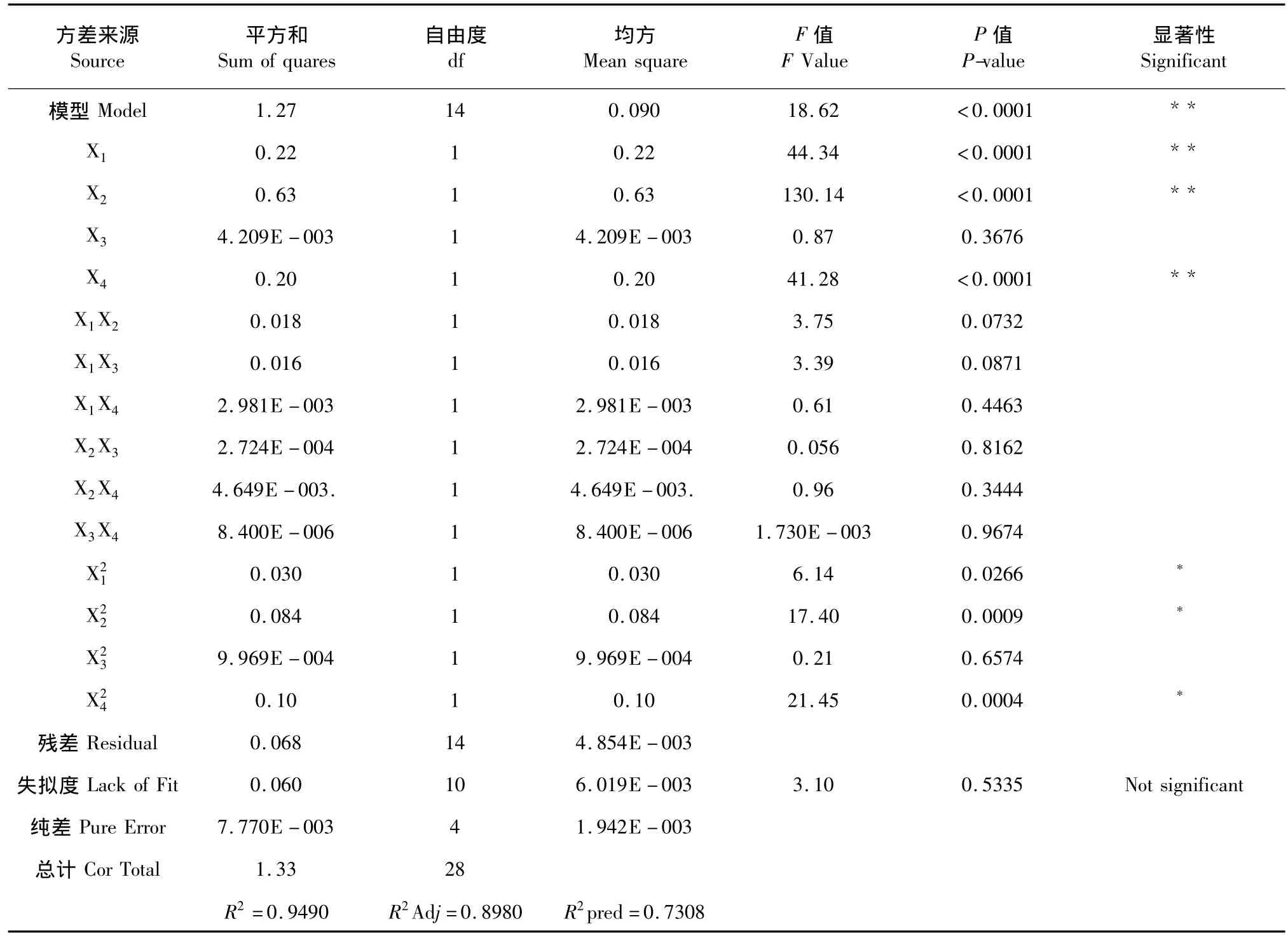
表3 b 连翘苷回归模型方差分析Table 3 b Analysis of variance for phillyrin regression model
由表3b可知,该模型的P<0.0001,说明模型回归高度显著。回归方程的相关系数(R2)为0.9490,说明模型响应值的变化94.90%来自所选考察变量。因此,回归方程可以较好地描述考察因子与响应值之间的关系。其中液料比、乙醇浓度、浸提温度对连翘苷提取率的影响最大,浸提时间对连翘苷提取率的影响最小。模型的一次项X1,X2,X4极显著,X3不显著;二次项X21、X22、X24显著,X23不显著;交互项均不显著,这表明各影响因素对于连翘苷提取率的影响不是简单的线性关系。失拟度的P值为0.1435>0.05,对连翘苷得率影响不显著,说明该模型的拟合度较好,可以利用该模型确定最佳工艺条件。
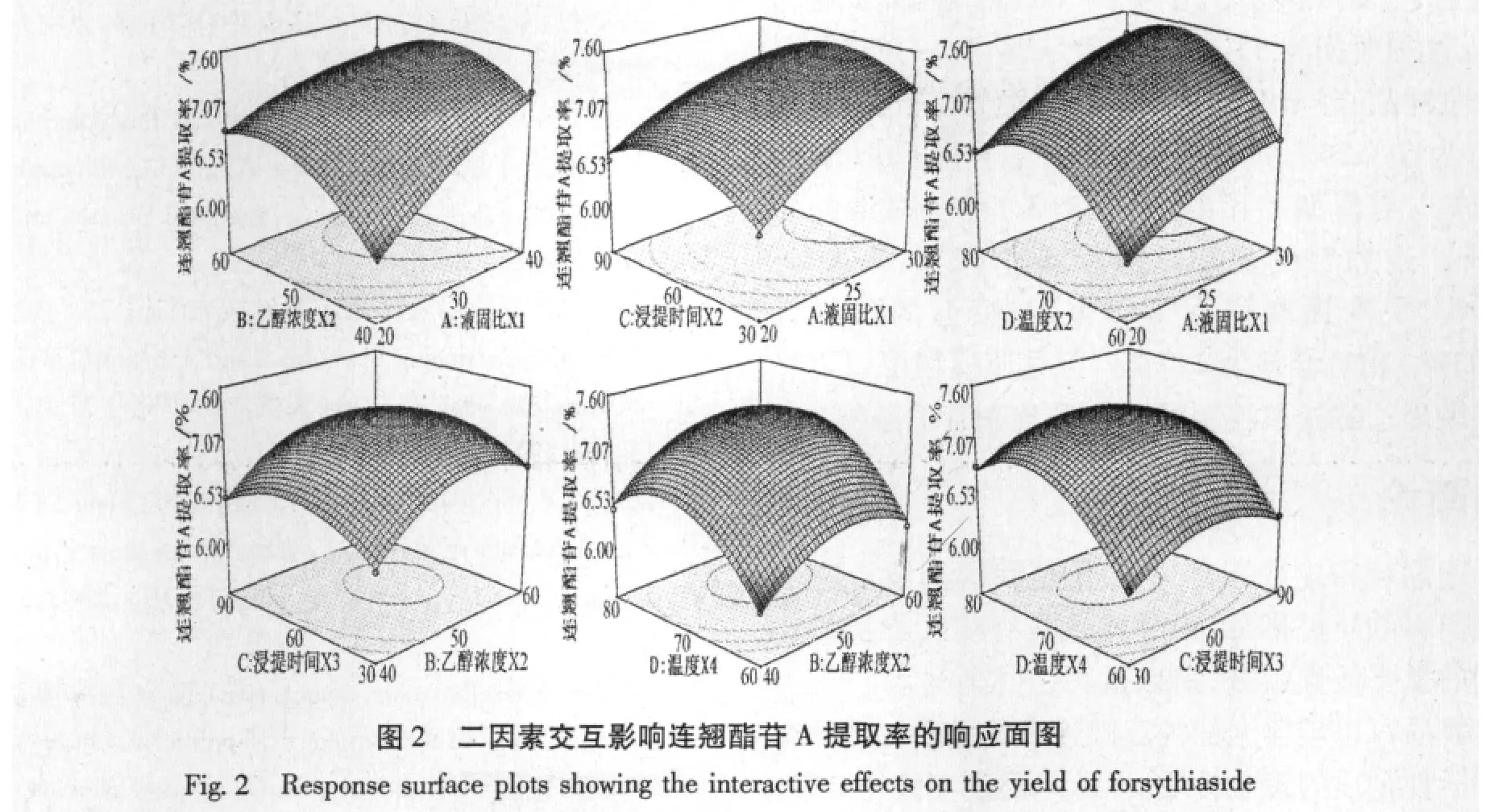
2.3.4 响应面图分析
利用Design Expert软件进行分析两两考察因素间交互作用的响应面图,如图2~3所示,可直观反应各因素和响应值及各考察因子之间的交互作用,由图2知,影响连翘酯苷A提取率的两两因素间交互作用比较显著,而从图3可知,影响连翘苷提取率的两两因素间交互作用不显著。响应面图全部开口向下,随着每个因素值的增大,响应值增大,当响应值增大到极值后,又随着因素值的增大逐渐减少,从响应面的最高点和等高线可看出在所选的范围内存在极值,即该模型有稳定点,且稳定点是最大值。模型预测最优工艺条件为:液固比30 mL/g,乙醇浓度52.88%,浸提时间53.28 min,温度74.35℃。
2.4 最优条件的验证
为了检验上述模型方程的合适性和有效性,进行验证试验。按照响应面数据并根据实际条件得出最佳工艺条件:液固比为30 mL/g,乙醇浓度为53%,浸提时间为53 min,温度为74℃。分别提取了3批样品,经HPLC法测定连翘酯苷A的提取率分别为7.52%、7.58%、7.57%,平均提取率为7.56%,与模型的预测值(7.53%)的相对误差为0.4%。连翘苷的提取率分别为3.02%、3.28%、2.96%,平均提取率为3.09%,与模型的预测值(3.03%)相对误差为2.0%。可见该模型可以较好地反映出乙醇提取连翘酯苷A和连翘苷的条件。
3 结论
连翘苷和连翘酯苷A含量是我国药典规定的连翘药材的质控指标,也是连翘具有抗病毒抗氧化作用的重要活性组分,所以选择上述两种物质作为指标物质可以较为全面的反映连翘的品质。根据这两种活性物质的理化性质,以及单因素实验的结果,二者的提取条件具有一致性,故可同时以二者的提取率为响应值寻求最佳工艺条件。
响应面法能更好地处理离散的水平值,能够更为准确地找出各因素的最佳组合和响应值的最优值。本试验通过利用响应面法研究从连翘叶中提取连翘酯苷A和连翘苷的最佳工艺,得到最佳工艺条件为:液固比为30 mL/g,乙醇浓度为53%,浸提时间为53 min,温度为74℃。该工艺提取率高,稳定性好,操作简便,适合工业化生产。
1 Yang JX(杨建雄),Hou GX(候改霞),Li FR(李发荣),et al.Effects of Forsythia suspense leaves’tea on hyperlipidemic mice.Chin J of Trad&West Med(中华中西医杂志),2003,24:1621-1623.
2 Yang JX(杨建雄),Liu J(刘静),Li FR(李发荣),et al.Study on anti-senile and anti oxidative activities of Forsythia suspense leaves tea.Acta Nutr Sin(营养学报),2004,26:65-67.
3 Li FR(李发荣),Duan F(段飞),Yang JX(杨建雄).Comparative study on the content of phillyrin in fructus forsythiae and leaves of Forsythia(Forsythia suspense).Acta Bot Boreal Occid Sin(西北植物学报),2004,24:725-727.
4 Yang JX(杨建雄),Zhu SY(朱淑云),Li FR(李发荣).Antioxidative effects of Forsythia suspense leaves tea in vitro.Food Sci(食品科学),2002,13:120-123.
5 Zhu SY(朱淑云),Yang JX(杨建雄),Li FR(李发荣).Effects of Forsythia suspense leaves extract on oxidative lesion mice.Pharm Clin Chin Mat Med(中药药理与临床),2004,20:18-20.
6 Editor Committee of Chinese Traditional Phytopharmacy(中华本草编辑委员会).Chinese Traditional Phytopharmacy (中华本草),Vol 16.Shanghai:Shanghai Science and Technology Press,1999.159.
7 Zhao YM(赵咏梅),Li FR(李发荣),Yang JX(杨建雄).Study on the reducing blood lipid and antioxidition effects of phillyrin.Nat Prod Res Dev(天然产物研究与开发),2005,17:157-159.
8 Zhang LW(张立伟),Zhao CG(赵春贵),Yang P(杨频),et al.Inhibition of elastase by forsythiaside from Fructus Forsythiae.Chem Res Appl(化学研究与应用),2002,14:119-221.
9 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010.VolⅠ,159.
10 Wang YL(王娅丽),Yang JX(杨建雄),Cai WL(柴渭莉).Investigation on glycosides extracted from Forsythia suspense leaves.Northwest Pharm J(西北药学杂志),2006,21:9-10.
11 Zhao Y(赵燕),Xuan ZY(玄振玉).Optimization of extracting technology for forsythiaside by orthogonal test.China J Exp Tradit Med Formul(中国实验方剂学杂志),2010,16 (11):13-15.
12 Jing H(靖会),Li JS(李教社),Yang YJ(杨银京).Optimization for extraction technology of forsythoside A in leaves of Forsythia suspensa by orthogonal design.China Pharm(中国药业),2011,20(15):39-41.
13 Thompson DD.Response surface experimentation.J Food Process Pres,1982,(6):155-188.
14 Zhang G(张杲),Li FR(李发荣),Wang ZZ(王喆之),et al.Determination of phillyrin,forsythiaside and rutin in folium Forsythia gathered in different periods.Nat Prod Res Dev (天然产物研究与开发),17:790-793.
15 Li QH,Fu CL.Application of response surface methodology for extraction optimization of germinant pumpkinseeds protein.Food Chem,2005,92:701-706.
16 Montgomery DC.Design and Analysis of Experiments,Fifth Edition.New York:JohnWiley&Sons Press,2001.8-19.
