葡萄植株中白藜芦醇及葡萄素含量动态积累规律研究
2012-12-22谢红旗刘发宝杨星星曾建国
谢红旗,刘发宝,杨星星,刘 薇,曾建国
1湖南农业大学园艺园林学院,长沙410128;2湖南中药提取工程技术研究中心,长沙410331; 3湖南中医药大学,长沙410007;4湖南省作物种质创新与资源利用重点实验室,长沙410128
葡萄是葡萄属(Vitis)落叶藤本植物,葡萄在世界果树生产中占据重要地位,其栽培面积和产量曾长期位居世界水果生产首位[1]。葡萄不仅营养丰富而且具有医疗保健功效,中国古代医书就有记载其根、藤、叶可入药。随着现代医学的发展,对葡萄的研究更加深入透彻,国内外学者发现葡萄中的芪类化合物具有很好的生物活性,可作为保健品和新药开发的原材料。芪类化合物(stilbenoids)是指具有1,2-二苯乙烯为骨架的化合物及其聚合物的总称,包括二苯乙烯(stilbene)、二苯乙基(bibenzyl)、菲类(phenanthrene)及它们的衍生物[2]。目前,研究较多的芪化物是白藜芦醇和葡萄素,葡萄素为白藜芦醇的二聚体。白藜芦醇具有很强的抗氧化功能和抑制心血管疾病与抗癌作用,已广泛地应用于医药、保健品、化妆品和食品添加剂等领域。芪类化合物主要分布在植物的木质部薄壁组织内,是植物受到病虫害或其他不利刺激时产生的应激产物[3]。研究发现,在葡萄属植物的根、茎、叶、果实、种子及葡萄酒中均能检测到芪化物的存在,但是由于品种、生长环境、检测部位的不同,芪化物的含量和种类也不同。王琴飞等利用高效液相色谱分析方法在葡萄叶片中同时检测到5种芪化物,它们分别为:白藜芦醇、云杉苷、ε-葡萄素、δ-葡萄素、紫檀芪[4]。Creasy等和Roggero等的研究都表明葡萄皮中存在有白藜芦醇及其低聚物[5,6],Sun等报道在葡萄籽中发现有白藜芦醇及其低聚物[7],Bavaresco等发现葡萄藤中也存在简单芪类化合物存在[8]。李婷等对不同品种的葡萄种籽、果皮、果梗、叶片、叶柄中的白藜芦醇含量进行了测定与比较[9],结果表明不同品种葡萄、不同部位白藜芦醇含量有较大差异。但未见文献对葡萄植株中不同部位在其生长周期内其主要活性成分白藜芦醇与葡萄素的动态积累规律进行调查。
本实验在对湖南境内主要葡萄品种芪类化合物资源调查的基础上,选择芪类化合物含量相对较高的红地球品种为考察对象,在其一年的生长周期内测定主要芪化物白藜芦醇与葡萄素在葡萄植株各部位的含量动态变化规律,以期为合理利用葡萄植株中芪类化合物提供依据。
1 材料与方法
1.1 材料及采样部位
葡萄材料来源于湖南浏阳永安镇葡萄园,品种为红地球葡萄品种,对葡萄植株不同部位在不同生长期的两种芪化物含量变化进行考察,采样部位于图1所示。白藜芦醇标准样品(Sigma公司),ε-葡萄素对照样品(实验室自制,含量大于98%),乙酸(分析纯);甲醇(色谱纯)。
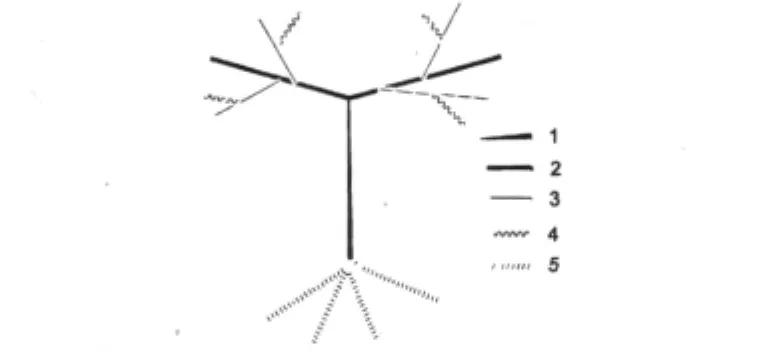
图1 采样部位示意图Fig.1 The diagram of sampling position
1.2 采样方法
1.2.1 根、藤的采样方法
采样周期:2010年4月至2011年1月,每月采集一次。对整个植株进行采收,每次一株,对根和各部位的藤(如图1所示)分开处理。
1.2.2 叶、藤的采样方法
2010年4月至2011年1月,每月两次,月初和月中各一次,采样方法:固定选取红地球品种一株,每次采集叶、图1所示的3号藤、4号藤适量,三个部位分开处理,制备供试品。
1.3 样品制备方法
将采集到的葡萄鲜材不同部位分开处理,粉碎混匀。称取粉碎的样品5 g,置于250 mL具口三角瓶内,加甲醇100 mL,称重,常温超声辅助提取1 h,放冷至室温,再称重并补重,混匀,减压过滤,得滤液,将提取液过0.45 μm滤膜,即得供试品溶液。
1.4 白藜芦醇与葡萄素分析方法
采用高效液相色谱法测定白藜芦醇与葡萄素含量,色谱条件如下:waters1525高效液相色谱系统,色谱柱:Hypersil,ODS C18柱(4.6 mm×250 mm,5 μm);2998PAD检测器,检测波长306nm;流速:0.8 mL/min;柱温:35℃;进样量:10 μL;二元梯度洗脱,流动相:(A)水-(B)乙腈,梯度洗脱方案如表1所示。

表1 高效液相色谱分析梯度洗脱方案Table 1 The scheme of gradient elution of HPLC analysis
1.5 白藜芦醇及葡萄素标准溶液的配制
准确称取一定量的反式白藜芦醇标准样品和ε-葡萄素对照品,分别置于10 mL容量瓶中,加少量甲醇超声溶解,冷却后用甲醇定容至刻度,配成白藜芦醇0.1066 mg/mL、ε-葡萄素0.5123 mg/mL的贮备液,取一定量贮备液加甲醇稀释得0.213~106.6 μg/mL的白藜芦醇和1.025~512.3 μg/mL的ε-葡萄素标准溶液,置于4℃的冰箱中避光保存备用。
2 结果与分析
2.1 白藜芦醇与葡萄素工作曲线
在上述色谱条件下测定,以色谱峰面积对质量浓度作图,得工作曲线,白藜芦醇的线性回归方程为Y=43954 X-3402.8,相关系数R=0.9999;ε-葡萄素的线性回归方程为Y=17888 X-5957,相关系数R=0.9999。其中Y为峰面积,X为白藜芦醇或ε-葡萄素标准品质量浓度。标准品与样品色谱峰如图2~4所示。
2.2 葡萄红地球根中白藜芦醇与葡萄素含量动态变化
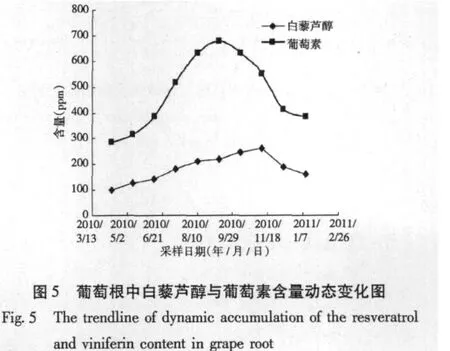
从2010年4月至2011年1月,每月的10号随机采集葡萄园中1株植株,按照样品处理方法制备供试液,分析其中白藜芦醇与葡萄素的含量,实验结果如图5所示,从图5可以看出,葡萄根中含有一定量的白藜芦醇和葡萄素,其中葡萄素的含量是白藜芦醇的含量3倍左右,且白藜芦醇与葡萄素含量在不同生长时期有着明显的变化,特别是葡萄素含量差异明显,从4月份到9月份,葡萄素的含量一直处于上升趋势,从9月份到次年1月份逐渐下降。白藜芦醇也具有相似的规律,但白藜芦醇含量在11月份达到峰值。
2.3 葡萄红地球主藤中白藜芦醇与葡萄素含量动态变化
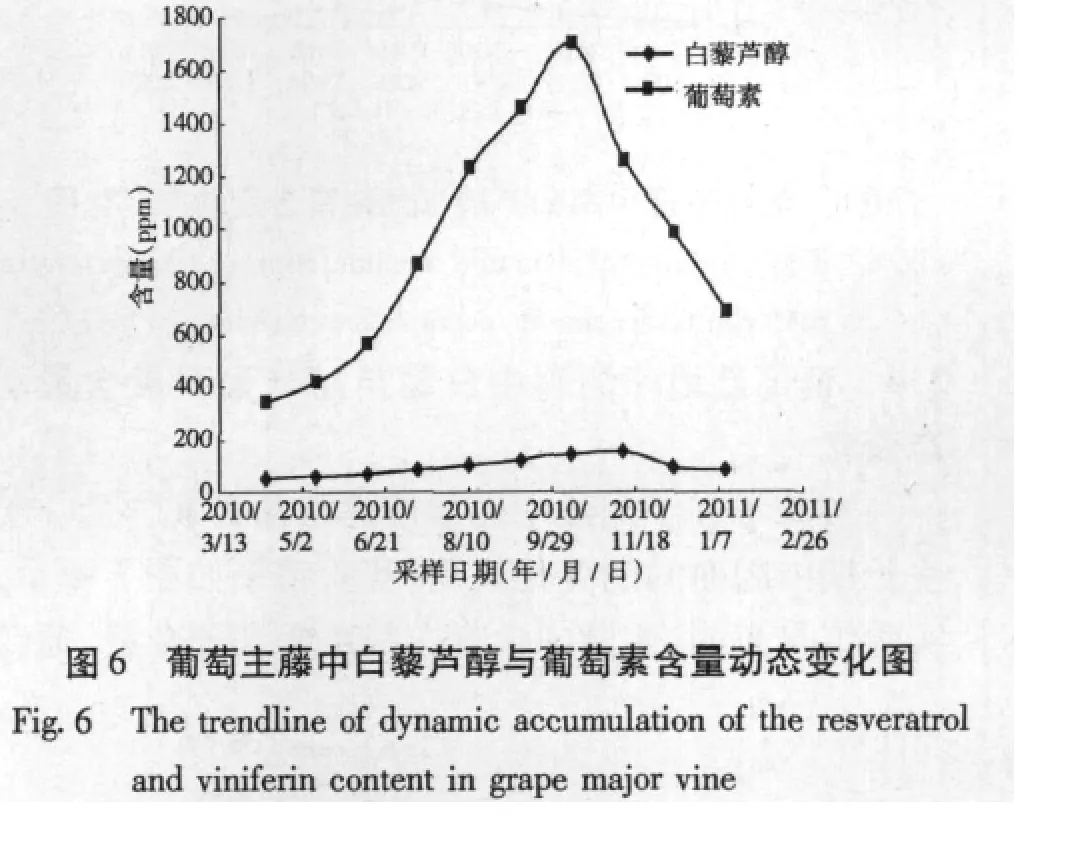
实验考查了从2010年4月到2011年1月葡萄红地球主藤中白藜芦醇与葡萄素含量随时间变化规律,实验结果如图6所示,结果表明主藤中白藜芦醇含量较根中低些,而葡萄素含量主藤则比根中高许多,到10月份,葡萄素含量达到1700 ppm以上,葡萄素含量是白藜芦醇含量10倍左右。白藜芦醇与葡萄素含量随时间变化规律相似,白藜芦醇到11月份达到最高,而葡萄素含量在10月份达到最高。
2.4 葡萄红地球侧藤中白藜芦醇与葡萄素含量动态变化
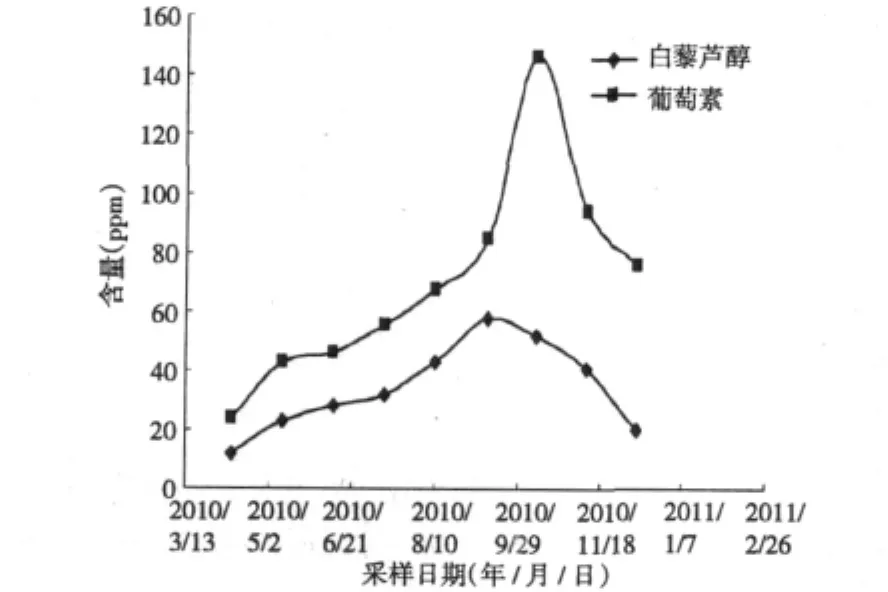
图9 葡萄叶中白藜芦醇与葡萄素含量动态变化图Fig.9 The trendline of dynamic accumulation of the resveratrol and viniferin content in grape leaves
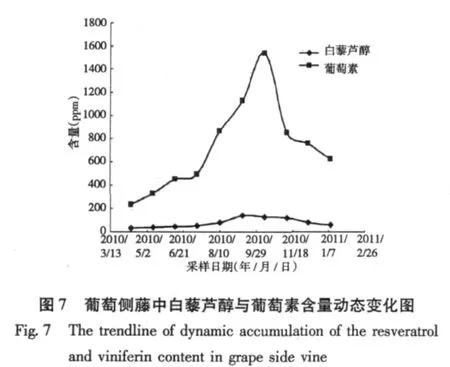
实验考查了侧藤中白藜芦醇与葡萄素含量一年生长期内随时间的变化规律,实验结果如图7所示,实验结果表明,侧藤中含有白藜芦醇和葡萄素,葡萄素含量随季节的变化影响较大,10月份含量最高,达到1600 ppm以上,白藜芦醇在9月份含量最高,约为130 ppm左右,与主藤相似,葡萄素的含量也是白藜芦醇含量的10倍左右。
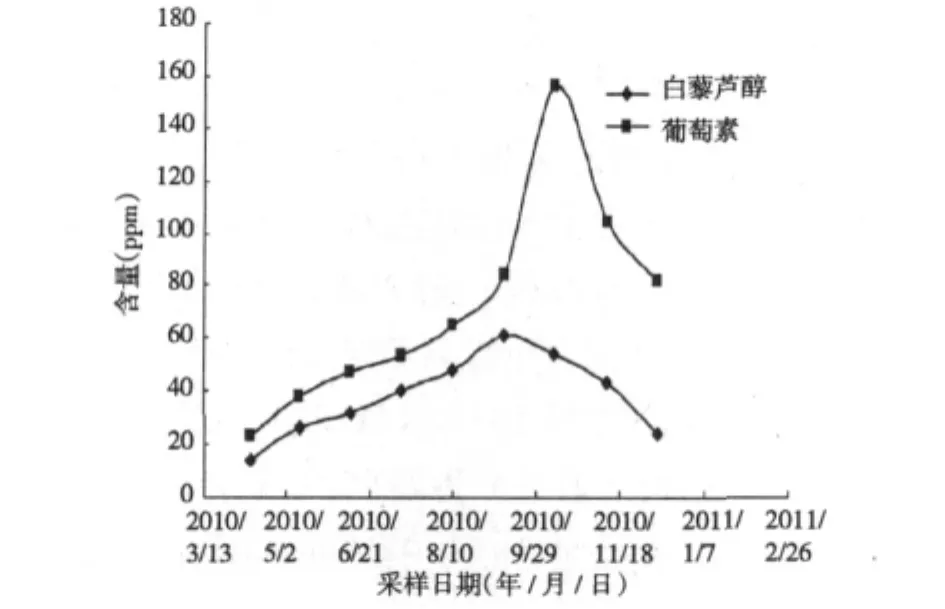
图10 葡萄叶柄白藜芦醇与葡萄素含量动态变化图Fig.10 The trendline of dynamic accumulation of the resveratrol and viniferin content in grape leafstalk
2.5 葡萄红地球支藤中白藜芦醇与葡萄素含量动态变化
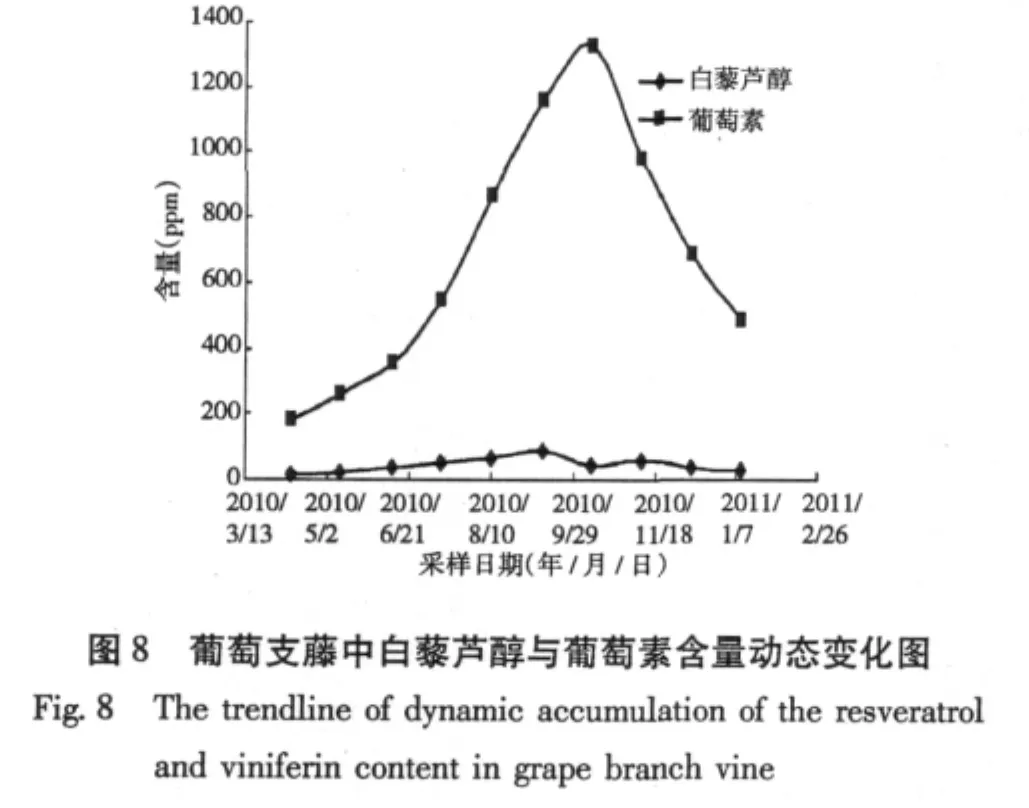
实验考查了支藤中白藜芦醇与葡萄素含量一年生长期内随时间的变化规律,实验结果如图8所示,实验结果表明,支藤中白藜芦醇含量相对根、主藤、侧藤较低,只有50%左右,而葡萄素含量较高,葡萄素含量随季节的变化影响明显,10月份含量最高,达到1300 ppm以上,而在4月份仅180 ppm。白藜芦醇与葡萄素随时间变化规律相似,都是从4月份到10月份一直呈上升趋势,从10月到次年1月份,逐渐降低。
2.6 葡萄红地球叶片及叶柄中白藜芦醇与葡萄素含量动态变化
实验考查了叶片和叶柄中白藜芦醇与葡萄素含量及随时间积累规律,实验结果如图9及图10所示,实验结果表明,叶片和叶柄中均含有白藜芦醇和葡萄素,两者葡萄素和白藜芦醇的含量没有明显区别,和藤等其他部位相比,葡萄素含量很低,仅为十分之一左右。白藜芦醇与葡萄素在叶中的积累规律相似,与其他部位的积累规律也相似,基本上都是从4月份到10月份呈上升趋势,到10月份含量达到最高峰,然后从10月到次年1月份,逐渐降低。
3 讨论
从试验结果与分析我们可以得到以下结论: 3.1 葡萄植株中的白藜芦醇和葡萄素动态含量变化范围较大,且不同部位之间含量有较大差异。总体来说不同部位白藜芦醇和葡萄素的含量情况是:主藤>侧藤>支藤>根>叶片≈叶柄。
3.2 葡萄藤中白藜芦醇和葡萄素在生长周期内含量变化趋势是先升后降,在9月份,白藜芦醇含量达到最高,而葡萄素含量在10月份达到最高,往后呈下降趋势,故选择9月中旬至10月初采收藤较适宜。此外,藤适合于作为生产白藜芦醇和葡萄素的提取原料。
3.3 葡萄叶和叶柄中白藜芦醇和葡萄素含量相差不大,在生长期含量变化趋势是先升后降,在9月份,白藜芦醇含量达到最高,而葡萄素含量在10月份达到最高,往后呈下降趋势。兼顾到9月叶正处于茂盛时期,生物总量较高,故选择9月采收叶较适宜。
3.4 葡萄根中白藜芦醇和葡萄素在生长期含量变化趋势也是先升后降,但在11月份,白藜芦醇含量达到最高,而葡萄素含量在9月份达到最高,这与藤和叶有较大差异。虽然根中白藜芦醇和葡萄素含量高于叶,但葡萄的根是不能采收的部位,故可开展根部细胞的细胞培养替代技术以保护植物资源。
1 Kong QS(孔庆山).The Records of Chinese Grape(中国葡萄志).Beijing(北京):China agricultural technology and science publishing House(中国农业科学技术出版社),2004,07.
2 Peng SX(彭司勋),Zhao SX(赵守训),Liao QJ(廖清江),et al.Medicine Chemistry Progress II(药物化学进展2).Beijing(北京):Chemical industry publishing house(化学工业出版社),2002,12:134-157.
3 Langcake P,Pryee RJ.The Production of resverotro1 and the viniferins by grapevines in Response to ultraviolet irradiation.Phytochemistry,1977,16:1193-1196.
4 Wang QF(王琴飞),Ma LY(马丽艳),Huang MJ(黄绵佳),et al.Determination of five stilbenes composition in grape leaves by high performance liquid chromatography.Chin J Anal Chem(分析化学),2008,10:1359-1363.
5 Creasy LL,Coffee M.Phytoalexin production potential of grape berries.J Am Soc Hortic Sci,1988,113:230-234.
6 Roggero JP,Garcia-Parrilla C.Effects of ultraviolet irradiation on resverotrol and changes in resveratrol and various of its derivatives in the skins of ripening grapes.Sci Aliments,1995,15:411-422.
7 Sun BS,Ribes A,Leandro MC,et al.Stilbenes:quantitative extraction from grape skins,contribution of grape solids to wine and variation during wine maturation.Anal Chim Acta,2006,563:382-390.
8 Bavaresco L,Cante E,Fregoni M,et al.Constitutive stilbene contents of grapevine cluster stems as potential source of resveratrol in wine.Vitis,1997,36:115-118.
9 Li T(李婷),Li S(李胜),Zhang QS(张青松),et al.Comparison of the resveratrol contents in different grape tissues.J Gansu Agric Univ(甘肃农业大学学报),2009,44(2):64-67.
